
- •Тема 3. Альдегиды и кетоны 36
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Основные направления реакционной способности углеводородов в зависимости от их электронного строения
- •Циклоалканы
- •Циклопропан с3н6
- •Транс-1,4-диметилциклогексан цис-1,4-диметилциклогексан
- •1. Гидрирование
- •Пропен пропан
- •2. Галогенирование
- •3. Гидрогалогенирование:
- •6. Полимеризация:
- •Алкадиены Это углеводороды, содержащие две двойные связи. Общая формула Сn h2n-2.
- •1. Гидрирование:
- •2. Гидрогалогенирование:
- •Ароматические углеводороды (арены)
- •Химические свойства
- •Заместители 2 рода ( -cooh, -so3h, -cho, -no2 и др.) – электроноакцепторы, уменьшают электронную плотность в кольце, затрудняют реакцию se и ориентируют электрофил в мета-положение.
- •Тема 2. Спирты. Фенолы. Нафтолы. Тиолы
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •Кислотность и основность органических соединений
- •Кислоты тон
- •Одноатомные спирты
- •Дегидрирование альдегид
- •Дегидрирование кетон
- •Многоатомные спирты
- •Спирты высшей атомности
- •Свойства фенолов как ароматических соединений. Реакции электрофильного замещения
- •Нафтолы
- •Ароматические спирты
- •Химические свойства
- •Глоссарий
- •Тема 3. Альдегиды и кетоны
- •Пиридоксаль пиридоксальфосфат
- •Этапы занятия и контроль усвоения знаний
- •Содержание этапов занятия
- •I. Реакции нуклеофильного присоединения
- •4. Взаимодействие с галогенсодержащими реагентами
- •II. Реакции за счет -сн2-звена
- •1. Галогенирование:
- •III. Реакции, характерные только для альдегидов
- •Глоссарий
- •Тема 4. Карбоновые кислоты и их функциональные производные
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Содержание этапов занятия
- •Этановая кислота 2-метилпропановая бутен-3-овая кислота
- •Высшие жирные кислоты (вжк)
- •Изомерия
- •Малеиновая фумаровая кислота
- •Линолевая кислота
- •Химические свойства
- •2. Реакции нуклеофильного замещения (sn ):
- •Двухосновные карбоновые кислоты
- •Трехосновные кислоты
- •Ноос–сн2–с–сн2–соон лимонная 3-гидрокси – 3-карбокси -
- •Специфические реакции двухосновных кислот
- •Тема 5. Липиды
- •Конкретные задачи
- •Вопросы для самоподготовки
- •Этапы занятия и контроль усвоения знаний
- •Омыляемые липиды
- •Омыляемые липиды
- •Жирные кислоты
- •Простые омыляемые липиды
- •Сложные омыляемые липиды
- •Фосфолипиды
- •Глицерофосфо- сфингофосфо-
- •Гликолипиды
- •Стероиды
- •Классификация стероидов
- •Эстрадиол
- •Глоссарий
Основные направления реакционной способности углеводородов в зависимости от их электронного строения
|
Класс углеводородов |
Общая формула |
Гибридизация |
Орбитали |
Связи |
Механизм и направление реакции |
|
Алканы |
СnH2n+2 |
sp3 |
4sp3 |
4 |
SR |
|
Алкены |
CnH2n |
sp2 |
3sp2, p |
3, |
AE |
|
Алкадиены (сопряженные) |
CnH2n-2 |
sp2 |
3sp2, p |
3, сопряженная -система |
AE (1,2;1,4;3,4) |
|
Арены |
CnH2n-6 |
sp2 |
3sp2,p |
3, замкнутая сопряженная -система |
SE |
Алканы
Алканаминазываются углеводороды, общая формула которых СnH2n+2
|
Название |
Структурная формула |
Брутто-формула |
|
Метан |
СH4 |
CH4 |
|
Этан |
CH3-CH3 |
C2H6 |
|
Пропан |
CH3-CH2-CH3 |
C3H8 |
|
Бутан |
CH3-CH2-CH2-CH3 |
C4H10 |
|
Пентан |
CH3-(CH2)2-СH2-CH3 |
С5Н12 |
|
Гексан |
СН3-(СН2)4-СН3 |
С6Н14и т.д. |
Низшие представители алканов при вдыхании обладают наркотическим действием, в более высоких концентрациях вызывают остановку дыхания. Токсичность и сила наркотического действия возрастают с увеличением количества углеродных атомов до 5–7. При дальнейшем изменении цепи активность снижается вследствие уменьшения летучести и растворимости в воде. Высшие представители почти инертны. Алканы физиологически менее активны, чем алкены или арены, что объясняется их строением.
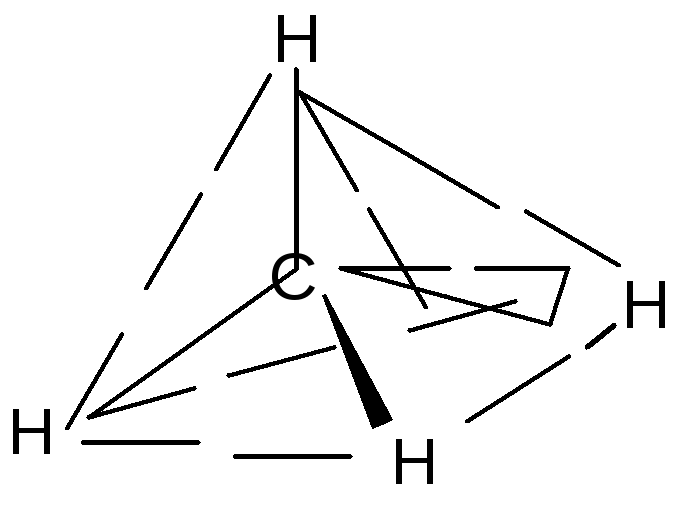
Алканы содержат атомы углерода в sp3– гибридизации. 1s– и 3р – орбитали образуют 4sp3 – гибридизованные орбитали, направленные в пространстве к вершинам тетраэдра под углом 109°. Эти орбитали участвуют в образовании 4-х прочных неполярных- связей.
С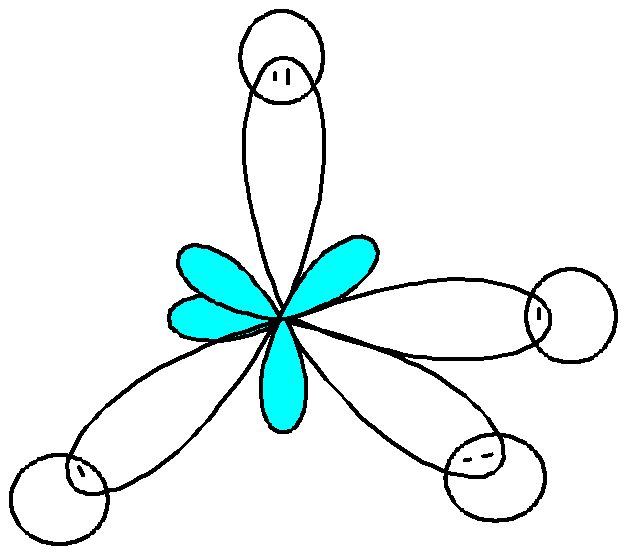
 троение
метана (СН4):
троение
метана (СН4):
а) электронное б) пространственное
(тетраэдрическое)
Строение этана (СН3-СН3):
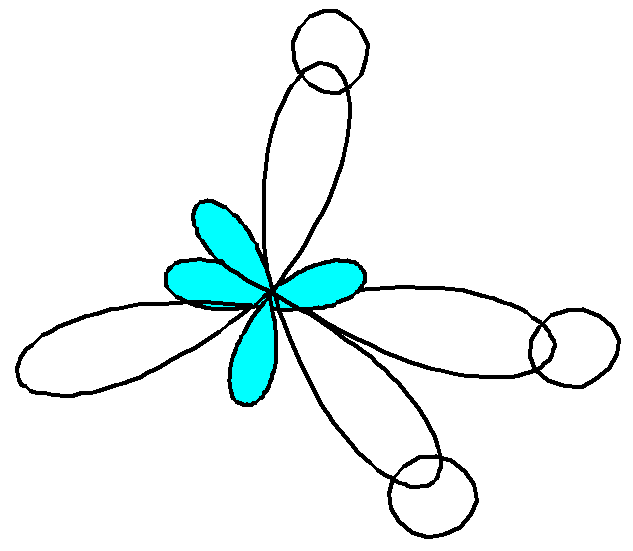
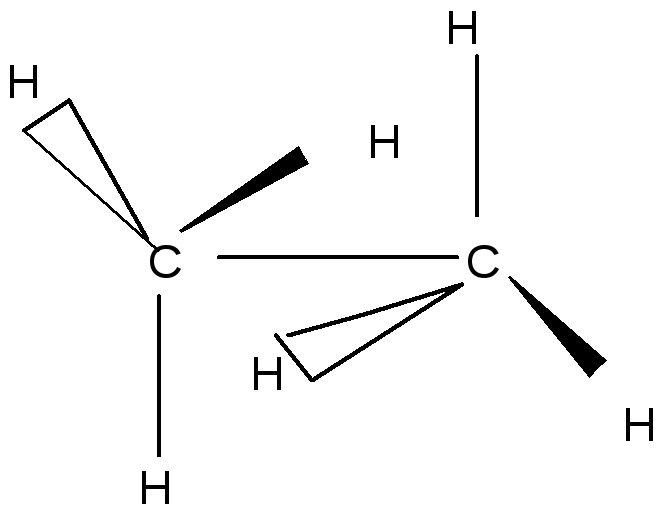
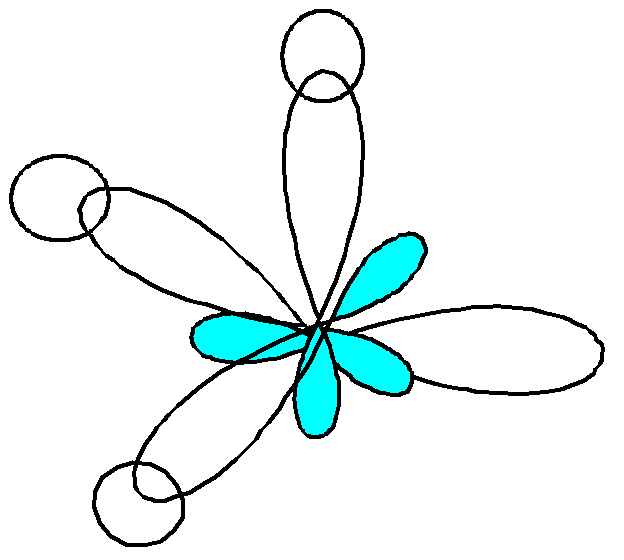
а) электронное б) пространственное
Изомерия. Для алканов характерна
1. Структурная изомерия: Например,
С




 Н3СН2СН2СН3СН3СН СН3
Н3СН2СН2СН3СН3СН СН3
бутан
СН3
изобутан (2–метилпропан)
2. Пространственная (конформационная) изомерия. Этот вид изомерии является результатом свободного вращения вокруг одинарной С-С связи. Геометрические формы молекулы, образующиеся при этом, называются конформациями. Среди множества конформаций этана выделяют экстремальные конформации – наименее (а) и наиболее (б) устойчивые:
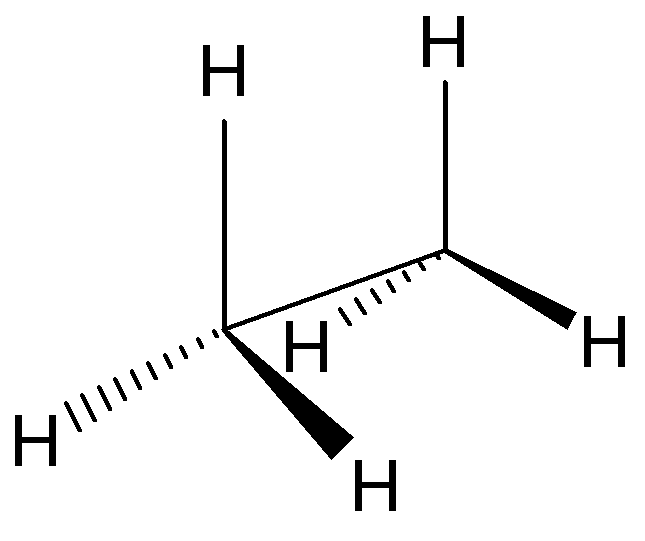
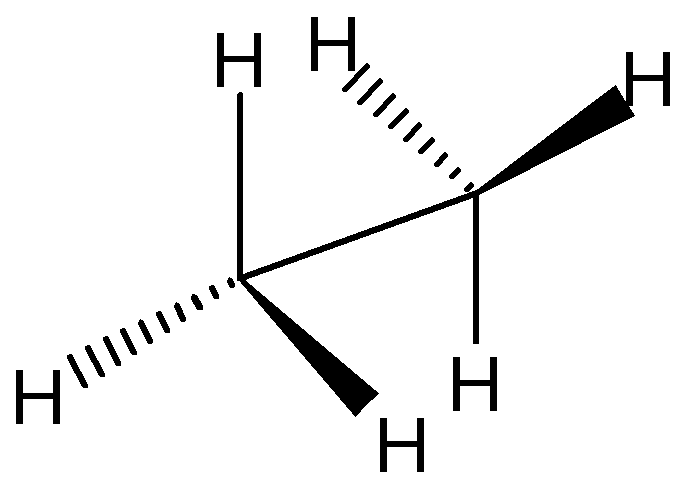
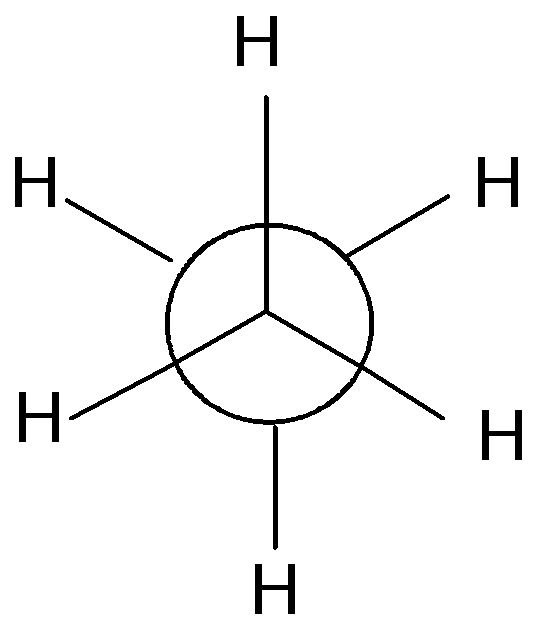
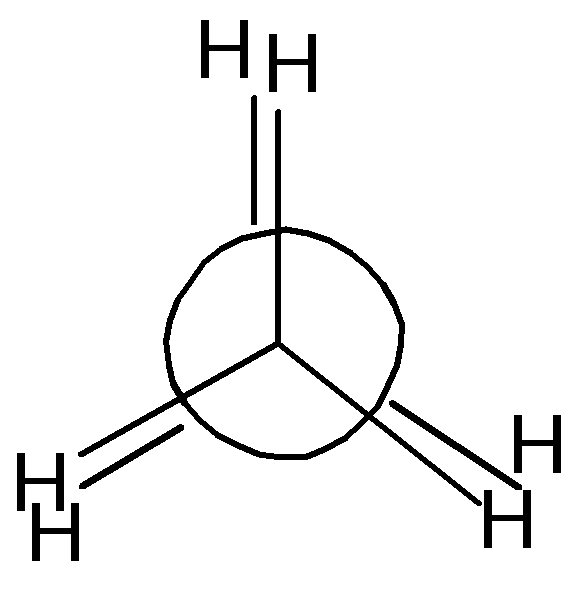
а) заслоненная б) заторможенная
В заслоненной конформации атомы водорода сближены и отталкиваются друг от друга. Это энергетически невыгодно (энергия молекулы максимальна).
В заторможенной конформации атомы водорода наиболее удалены друг от друга. Это наиболее выгодная конформация (энергия молекулы минимальна).
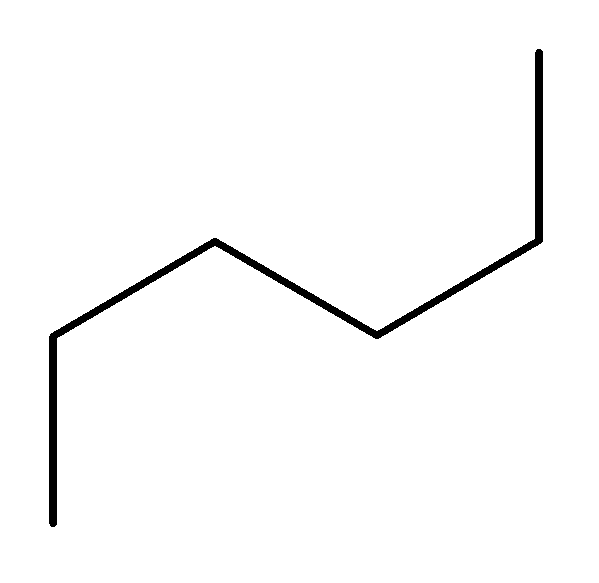
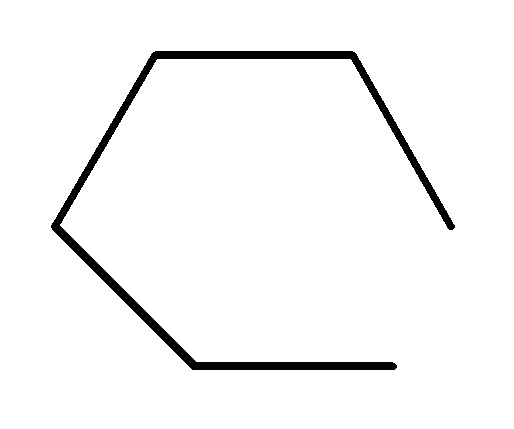
Для 5- и 6-членных углеводородных цепей можно выделить три основные конформации:
![]()
а) зигзагообразная б) нерегулярная в) клешневидная
Клешневидная конформация дает нам представление о возможности образования 5- и 6-членных циклов. Более длинные углеводородные цепи по данным рентгеноструктурного анализа имеют, в основном, зигзагообразную конформацию.
Химические свойства
Алканы относительно стабильны к таким реагентам как кислоты, щелочи, окислители при обычных условиях. Это объясняется прочностью С-С и С-Н связей.
Алканы подвергаются 2-м типам реакций:
1. Реакции замещения.
2.Термические и каталитические реакции.
Эти реакции протекают при повышенных температурах или при поглощении световой энергии через образование высоко реактивных свободных радикалов.
Рассмотрим реакцию радикального замещения SR, например, реакцию галогенирования. Она включает несколько этапов.
1-й этап – инициирование. На этом этапе молекула галогена под действием кванта света гомолитически расщепляется на два радикала:
h
 Br:
Br Br + Br
Br:
Br Br + Br
гомолиз
2-й этап – рост радикальной цепи.Радикал галогена атакует молекулу алкана. Связь С:Н расщепляется гомолитически с образованием алкильного радикала:
С Н3-СН-СН2-СН3+BrСН3-С-СН2-СН3+H:Br.
Н3-СН-СН2-СН3+BrСН3-С-СН2-СН3+H:Br.
CH3CH3
Галогенирование алканов обычно приводит к смеси изомеров. Но, в первую очередь, радикальной атаке подвергаются третичные, затем вторичные и в последнюю очередь первичные С-Н- связи:
перв. трет. втор. перв.
СН3 – СН - СН2 - СН3
СН3
перв.
Далее образовавшийся алкил-радикал реагирует с новой молекулой галогена с образованием нового радикала галогена:
Br
.
 СН3-С-СН2-СН3+Br:BrСН3-С-СН2-СН3+Br
СН3-С-СН2-СН3+Br:BrСН3-С-СН2-СН3+Br
СН3CH3
Таким образом, развивается радикальная цепь.
3-й этап – обрыв цепи,или рекомбинация радикалов. Он возможен в результате следующих превращений:
а )
Br + Br Br2
)
Br + Br Br2
б )
Br + R
R- Br
)
Br + R
R- Br
в )R+RR–R
)R+RR–R
Среди галогенпроизводных алканов наиболее физиологически активны хлорпроизводные. Они проявляют наркотическое действие, понижая кровяное давление. В ряду хлорзамещенных метана: СН3Сl – хлористый метил, CH2Cl2 – хлористый метилен, CHCl3 – хлороформ, CCl4 – четыреххлористый углерод – усиливаются наркотическая активность и токсичность.
Окисление. Алканы вступают в реакции окисления только при очень высокой температуре и в присутствии катализаторов.
