
- •от автора
- •СОКРАЩЕНИЯ, ВСТРЕЧАЮЩИЕСЯ В ЛЕКЦИЯХ
- •Аминокслоты и белки
- •Нуклеотиды
- •Витамины
- •Ферменты
- •Углеводы
- •Липиды
- •Гормоны
- •СТРОЕНИЕ, СВОЙСТВА И КЛАССИФИКАЦИЯ АМИНОКИСЛОТ И БЕЛКОВ
- •КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
- •По абсолютной конфигурации молекулы
- •По оптической активности
- •По участию аминокислот в синтезе белков
- •АМИНОКИСЛОТЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •СТРОЕНИЕ И СВОЙСТВА ПЕПТИДНОЙ СВЯЗИ
- •ФУНКЦИИ БЕЛКОВ
- •УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВОЙ СТРУКТУРЫ
- •Первичная структура
- •Вторичная структура
- •Третичная структура
- •Четвертичная структура
- •Амфотерность
- •Влияние рН на заряд белка
- •Растворимость
- •МЕТОДЫ ОСАЖДЕНИЯ БЕЛКОВ
- •Денатурация
- •Обратимое осаждение
- •Высаливание
- •Осаждение водоотнимающими средствами
- •Изменение рН
- •СВОЙСТВА БЕЛКОВЫХ РАСТВОРОВ
- •КЛАССИФИКАЦИЯ БЕЛКОВ
- •А. По функции
- •Б. По строению
- •1. По форме молекулы
- •2. По количеству белковых цепей в одной молекуле
- •3. По химическому составу
- •КЛАССИФИКАЦИЯ ПРОСТЫХ БЕЛКОВ
- •Альбумины
- •Глобулины
- •Гистоны
- •Протамины
- •Коллаген
- •Эластин
- •СТРОЕНИЕ И КЛАССИФИКАЦИЯ СЛОЖНЫХ БЕЛКОВ
- •Нуклеопротеины
- •Фосфопротеины
- •Липопротеины
- •Хромопротеины
- •Гемопротеины
- •Цитохромы
- •Флавопротеины
- •Металлопротеины
- •Гликопротеины (гликоконъюгаты)
- •Гликопротеины
- •Протеогликаны
- •Гликопротеины
- •Протеогликаны
- •ВИТАМИНЫ, ИХ КОФЕРМЕНТНЫЕ ФОРМЫ, ФУНКЦИИ
- •Общая характеристика
- •ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Метаболизм
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Гипервитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Антивитамины
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •ВОДОРАСТВОРИМЫЕ ВИТАМИНЫ
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В1
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины В2
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Антивитамины
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Метаболизм
- •Биохимические функции
- •Гиповитаминоз
- •Лекарственные формы
- •Источники
- •Суточная потребность
- •Строение
- •Биохимические функции
- •Гиповитаминоз
- •ФЕРМЕНТЫ, СВОЙСТВА, КЛАССИФИКАЦИЯ, РЕГУЛЯЦИЯ АКТИВНОСТИ
- •ЭТАПЫ ФЕРМЕНТАТИВНОГО КАТАЛИЗА
- •МЕХАНИЗМЫ КАТАЛИЗА
- •ТИПЫ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- •СХОДСТВО И ОТЛИЧИЯ ФЕРМЕНТОВ И НЕОРГАНИЧЕСКИХ КАТАЛИЗАТОРОВ
- •Сходство
- •Отличия
- •СТРОЕНИЕ ФЕРМЕНТОВ
- •Изоферменты
- •Мультиферментные комплексы
- •ПРИНЦИПЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
- •СВОЙСТВА ФЕРМЕНТОВ
- •СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- •Механизмы специфичности
- •ИНГИБИРОВАНИЕ ФЕРМЕНТОВ
- •Необратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •ЭНЗИМОПАТОЛОГИИ
- •ИСПОЛЬЗОВАНИЕ ФЕРМЕНТОВ И ИХ ИНГИБИТОРОВ В МЕДИЦИНЕ
- •Энзимодиагностика
- •Энзимотерапия
- •Использование ингибиторов ферментов
- •КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
- •НОМЕНКЛАТУРА ФЕРМЕНТОВ
- •I класс. Оксидоредуктазы
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •V класс. Изомеразы
- •Систематическое название образуется:
- •Пример 1
- •Пример 2
- •а. Систематическое название образуется:
- •Пример 1
- •Пример 2
- •Анаболизм
- •Катаболизм
- •I этап
- •II этап
- •III этап
- •ОСНОВНЫЕ ИСТОЧНИКИ ЭНЕРГИИ В КЛЕТКЕ
- •ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ
- •Регуляция пируватдегидрогеназного комплекса
- •ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ
- •Регуляция ЦТК
- •ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ
- •Краткая характеристика
- •Принцип работы дыхательной цепи
- •Ферментные комплексы дыхательной цепи
- •I комплекс, НАДН-KoQ-оксидоредуктаза
- •IV комплекс, цитохром с – кислород-оксидоредуктаза
- •V комплекс
- •Работа комплексов дыхательной цепи
- •Регуляция окислительного фосфорилирования
- •РАЗОБЩИТЕЛИ
- •ИНГИБИТОРЫ ФЕРМЕНТОВ ДЫХАТЕЛЬНОЙ ЦЕПИ
- •Расчет энергетической ценности коэффициента Р/О при окислении некоторых аминокислот
- •ГИПОЭНЕРГЕТИЧЕСКИЕ СОСТОЯНИЯ
- •ИСПОЛЬЗОВАНИЕ АТФ И ЕГО ПРЕДШЕСТВЕННИКОВ В МЕДИЦИНЕ
- •ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •АЗОТИСТЫЙ БАЛАНС
- •ВНЕШНИЙ ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
- •Желудок
- •Регуляция желудочного пищеварения
- •Соляная кислота
- •Пепсин
- •Гастриксин
- •Двенадцатиперстная кишка и тонкий кишечник
- •Регуляция кишечного пищеварения
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Карбоксипептидазы
- •Аминопептидазы
- •Дипептидазы
- •Толстый кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ БЕЛКА У ДЕТЕЙ
- •ТРАНСПОРТ АМИНОКИСЛОТ ЧЕРЕЗ МЕМБРАНЫ
- •НАРУШЕНИЕ ПРОЦЕССОВ ПЕРЕВАРИВАНИЯ БЕЛКОВ
- •Пищевые аллергии
- •Целиакия
- •Гниение белков в кишечнике
- •ДЕТОКСИКАЦИОННЫЕ СИСТЕМЫ ПЕЧЕНИ
- •Микросомальное окисление
- •Конъюгация
- •Образование животного индикана
- •ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ
- •Судьба аминокислот в клетке
- •Превращение аминокислот по радикалу
- •Превращение аминокислот по карбоксильной группе
- •Гистамин
- •Физиологические эффекты
- •Серотонин
- •Физиологические эффекты
- •Физиологические эффекты
- •Дофамин
- •Физиологические эффекты
- •Обезвреживание биогенных аминов
- •Превращение аминокислот с участием аминогруппы
- •Типы дезаминирования
- •Окислительное дезаминирование
- •Прямое окислительное дезаминирование
- •Непрямое окислительное дезаминирование (трансдезаминирование)
- •Механизм трансаминирования
- •Дезаминирование
- •Энзимодиагностика с помощью аминотрансфераз
- •Роль трансаминирования и трансдезаминирования
- •Обмен и роль креатина
- •ОБРАЗОВАНИЕ И УБОРКА АММИАКА
- •ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ
- •СВЯЗЫВАНИЕ АММИАКА
- •ТРАНСПОРТ АММИАКА
- •Глюкозо-аланиновый цикл
- •УДАЛЕНИЕ АММИАКА ИЗ ОРГАНИЗМА
- •Синтез мочевины
- •Синтез аммонийных солей
- •ГИПЕРАММОНИЕМИИ
- •Наследственные формы
- •Приобретенные формы
- •ГИПОТЕЗЫ ТОКСИЧНОСТИ АММИАКА
- •ЧАСТНЫЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ И ИХ НАРУШЕНИЯ
- •ПУТИ ИСПОЛЬЗОВАНИЯ ЦИСТЕИНА
- •Цистиноз
- •Цистиноз ранний нефропатический
- •Цистиноз нефропатический поздний
- •Цистиноз доброкачественный взрослых
- •Основы лечения
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛИЦИНА И СЕРИНА
- •ВЗАИМОСВЯЗЬ ОБМЕНА ГЛИЦИНА, СЕРИНА, ЦИСТЕИНА И МЕТИОНИНА
- •Гомоцистеинемия
- •ПУТИ ИСПОЛЬЗОВАНИЯ ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ КИСЛОТ
- •ОБМЕН ФЕНИЛАЛАНИНА И ТИРОЗИНА
- •Катаболизм фенилаланина и его нарушения
- •Фенилкетонурия I (классическая)
- •Фенилкетонурия II
- •Обмен тирозина и его нарушения
- •Тирозинемия типа I
- •Тирозинемия типа II
- •Тирозинемия новорожденных
- •Алкаптонурия
- •Альбинизм
- •Паркинсонизм
- •Лейциноз (болезнь мочи с запахом кленового сиропа)
- •Изовалератацидемия
- •ОБМЕН ТРИПТОФАНА
- •Синдром Хартнупа (триптофанурия)
- •СТРОЕНИЕ И ОБМЕН НУКЛЕОТИДОВ
- •ВНЕШНИЙ ОБМЕН НУКЛЕОПРОТЕИНОВ
- •ПУРИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пуриновых оснований и нуклеотидов
- •Регуляция синтеза пуриновых нуклеотидов
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Распад пуриновых нуклеотидов
- •Реутилизация пуриновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПУРИНОВЫХ ОСНОВАНИЙ
- •Подагра
- •Основы лечения
- •Мочекаменная болезнь
- •Основы лечения
- •Синдром Леша-Нихана
- •ПИРИМИДИНОВЫЕ НУКЛЕОТИДЫ
- •Синтез пиримидиновых оснований и нуклеотидов
- •СИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВ
- •Синтез тимидилтрифосфата
- •Регуляция синтеза пиримидинов
- •Физиологическая регуляция
- •Лекарственная регуляция
- •Распад пиримидиновых оснований
- •Реутилизация пиримидиновых оснований
- •НАРУШЕНИЕ ОБМЕНА ПИРИМИДИНОВЫХ ОСНОВАНИЙ
- •Оротатацидурия
- •Наследственная форма
- •Приобретенная форма
- •НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ КАК ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ
- •МАТРИЧНЫЕ БИОСИНТЕЗЫ
- •ОСНОВНОЙ ПОСТУЛАТ МОЛЕКУЛЯРНОЙ БИОЛОГИИ
- •СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ
- •Строение дезоксирибонуклеиновой кислоты
- •Строение хроматина
- •Строение рибонуклеиновых кислот
- •РЕПЛИКАЦИЯ ДНК
- •ПОВРЕЖДЕНИЯ И РЕПАРАЦИЯ ДНК
- •ТРАНСКРИПЦИЯ
- •Стадии транскрипции
- •Инициация
- •Элонгация
- •Терминация
- •Процессинг РНК
- •Процессинг предшественника рРНК
- •Процессинг предшественника мРНК
- •Процессинг предшественника тРНК
- •Регуляция транскрипции
- •Прокариоты
- •Лактозный оперон
- •Триптофановый оперон
- •Эукариоты
- •Внутриклеточная регуляция
- •Лекарственная регуляция
- •Ингибирование
- •Активация
- •ГЕНЕТИЧЕСКИЙ КОД
- •Свойства биологического кода
- •АДАПТОРНАЯ РОЛЬ ТРАНСПОРТНЫХ РНК
- •ТРАНСЛЯЦИЯ
- •Инициация
- •Элонгация
- •Терминация
- •Полирибосомы
- •Посттрансляционная модификация белков
- •Фолдинг белков
- •Лекарственная регуляция трансляции
- •ГЕНОТИПИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ
- •СТРОЕНИЕ И ОБМЕН УГЛЕВОДОВ
- •ФУНКЦИИ УГЛЕВОДОВ
- •КЛАССИФИКАЦИЯ
- •Моносахариды
- •Производные моносахаридов
- •Дисахариды
- •Полисахариды
- •Гомополисахариды
- •Гетерополисахариды
- •ИСПОЛЬЗОВАНИЕ УГЛЕВОДОВ В БИОЛОГИИ И МЕДИЦИНЕ
- •ВНЕШНИЙ ОБМЕН УГЛЕВОДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ УГЛЕВОДОВ У ДЕТЕЙ
- •Нарушения переваривания дисахаридов
- •Роль целлюлозы в пищеварении
- •ПЕРЕНОС ГЛЮКОЗЫ ЧЕРЕЗ МЕМБРАНЫ
- •Всасывание в кишечнике
- •Транспорт из крови через клеточные мембраны
- •РЕАКЦИИ ВЗАИМОПРЕВРАЩЕНИЯ САХАРОВ
- •Превращение галактозы
- •Нарушения превращения галактозы
- •Превращение фруктозы
- •Нарушения превращения фруктозы
- •Эссенциальная фруктозурия
- •Наследственная фруктозурия
- •СУДЬБА И ИСТОЧНИКИ ГЛЮКОЗЫ В КЛЕТКЕ
- •Фосфорилирование-дефосфорилирование глюкозы
- •МЕТАБОЛИЗМ ГЛИКОГЕНА
- •Синтез гликогена
- •Мобилизация гликогена
- •Регуляция обмена гликогена
- •Активация фосфорилазы гликогена
- •Ковалентная модификация
- •Кальций-зависимая активация
- •Аллостерическая активация
- •ГЛИКОГЕНОВЫЕ БОЛЕЗНИ
- •Гликогенозы
- •Печеночные гликогенозы
- •Мышечные гликогенозы
- •Смешанные гликогенозы
- •Агликогенозы
- •ОКИСЛЕНИЕ ГЛЮКОЗЫ
- •Гликолиз
- •Первый этап гликолиза
- •Второй этап гликолиза
- •Гликолитическая оксидоредукция
- •Энергетический эффект окисления глюкозы
- •Анаэробное окисление
- •Аэробное окисление
- •Эффект Пастера
- •Челночные системы
- •Глицеролфосфатный челночный механизм
- •Малат-аспартатный челночный механизм
- •ГЛЮКОНЕОГЕНЕЗ
- •Обход десятой реакции гликолиза
- •Обход третьей реакции гликолиза
- •Обход первой реакции гликолиза
- •Взаимосвязь гликолиза и глюконеогенеза
- •Регуляция гликолиза и глюконеогенеза
- •Регуляция глюконеогенеза
- •Регуляция гликолиза
- •СИНТЕЗ ГЛЮКОЗЫ ИЗ АМИНОКИСЛОТ
- •МЕТАБОЛИЗМ ЭТАНОЛА
- •Утилизация этанола
- •Спиртовое брожение
- •ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ОКИСЛЕНИЯ ГЛЮКОЗЫ
- •Значение пентозофосфатного пути
- •Нарушения пентозофосфатного пути
- •РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ГЛЮКОЗЫ В КРОВИ
- •Снижение глюкозы крови
- •Повышение глюкозы крови
- •Гипергликемические состояния
- •Сахарный диабет
- •Причины
- •Сравнительная характеристика типов сахарного диабета
- •Осложнения сахарного диабета
- •Быстрые последствия
- •Отдаленные последствия
- •СТРОЕНИЕ И ОБМЕН ЛИПИДОВ
- •КЛАССИФИКАЦИЯ ЛИПИДОВ
- •ФУНКЦИИ ЛИПИДОВ
- •СТРОЕНИЕ ЛИПИДОВ
- •Жирные кислоты
- •Роль жирных кислот
- •Типы эйкозаноидов
- •Синтез эйкозаноидов
- •Лекарственная регуляция синтеза
- •Триацилглицеролы
- •Функции триацилглицеролов
- •Прогоркание жиров
- •Фосфолипиды
- •Глицерофосфолипиды
- •Сфингофосфолипиды
- •Холестерол
- •Функции холестерола
- •Гликолипиды
- •ВНЕШНИЙ ОБМЕН ЛИПИДОВ
- •Ротовая полость
- •Желудок
- •Кишечник
- •СВОЙСТВА, СОСТАВ И ФУНКЦИИ ЖЕЛЧИ
- •Свойства и состав
- •Роль желчи
- •Образование желчных кислот
- •Кишечно-печеночная циркуляция
- •Нарушение желчеобразования
- •ОСОБЕННОСТИ ПЕРЕВАРИВАНИЯ ЛИПИДОВ У ДЕТЕЙ
- •НАРУШЕНИЕ ПЕРЕВАРИВАНИЯ ЛИПИДОВ
- •ВСАСЫВАНИЕ ЛИПИДОВ
- •РЕСИНТЕЗ ЛИПИДОВ В СТЕНКЕ КИШЕЧНИКА
- •Ресинтез триацилглицеролов
- •Ресинтез эфиров холестерола
- •Ресинтез фосфолипидов
- •ФОРМЫ ТРАНСПОРТА ЛИПИДОВ В КРОВИ
- •ТРАНСПОРТ ТРИАЦИЛГЛИЦЕРОЛОВ В КРОВИ
- •Характеристика хиломикронов
- •Общая характеристика
- •Функция
- •Метаболизм
- •Характеристика липопротеинов очень низкой плотности
- •Общая характеристика
- •Функция
- •Метаболизм
- •ПРОМЕЖУТОЧНЫЙ ОБМЕН ЛИПИДОВ
- •Источники и судьба жирных кислот
- •Состояние покоя и отдыха в абсорбтивный период
- •Голодание, мышечная работа, состояние покоя в постабсорбтивный период
- •ИСПОЛЬЗОВАНИЕ ТРИАЦИЛГЛИЦЕРОЛОВ
- •Общая характеристика мобилизации жиров
- •Транспорт жирных кислот и глицерола
- •Окисление жирных кислот с нечетным числом углеродных атомов
- •Окисление ненасыщенных жирных кислот
- •Пример 1. Окисление пальмитиновой кислоты
- •Пример 2. Окисление линолевой кислоты
- •КЕТОНОВЫЕ ТЕЛА
- •ЗАПАСАНИЕ ЖИРОВ
- •Биосинтез жирных кислот
- •Удлинение цепи жирных кислот
- •Гормональная регуляция
- •Метаболическая регуляция
- •Общие принципы биосинтеза
- •Синтез фосфатидной кислоты
- •Синтез триацилглицеролов
- •Синтез фосфолипидов
- •Липотропные вещества
- •НАРУШЕНИЯ ОБМЕНА ТРИАЦИЛГЛИЦЕРОЛОВ
- •Жировая инфильтрация печени
- •Ожирение
- •Основы лечения
- •Сахарный диабет II типа
- •Основы лечения
- •ОБМЕН ХОЛЕСТЕРОЛА
- •Источники
- •Выведение
- •Биосинтез
- •Регуляция синтеза холестерола
- •ТРАНСПОРТ ХОЛЕСТЕРОЛА И ЕГО ЭФИРОВ
- •Характеристика липопротеинов высокой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •Характеристика липопротеинов низкой плотности
- •Общая характеристика
- •Функция
- •Обмен
- •НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРОЛА
- •Атеросклероз
- •Стадии атеросклероза
- •1 стадия – повреждение эндотелия
- •2 стадия – стадия начальных изменений
- •3 стадия – стадия поздних изменений
- •4 стадия – стадия осложнений
- •Основы лечения
- •Нарушения обмена липопротеинов
- •Тип I. Гиперхиломикронемия
- •1. Подтип IIa (семейная гиперхолестеролемия)
- •Болезни накопления липидов – липидозы
- •ГОРМОНЫ
- •КЛАССИФИКАЦИЯ ГОРМОНОВ
- •Классификация по строению
- •Классификация по влиянию на обмен веществ
- •Классификация по месту синтеза
- •МЕХАНИЗМЫ ДЕЙСТВИЯ ГОРМОНОВ
- •Мембранные рецепторы
- •Аденилатциклазный механизм
- •Кальций-фосфолипидный механизм
- •Гуанилатциклазный механизм
- •Цитозольные рецепторы
- •ИЕРАРХИЯ И ПРИНЦИПЫ РЕГУЛЯЦИИ ГОРМОНАЛЬНЫХ СИСТЕМ
- •ГОРМОНЫ ГИПОТАЛАМУСА
- •ГОРМОНЫ ГИПОФИЗА
- •Соматотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Семейство пептидов проопиомеланокортина
- •Липотропный гормон
- •Мишени и эффекты
- •Меланоцитстимулирующий гормон
- •Строение
- •Синтез
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ, РЕГУЛИРУЮЩИЕ ОБМЕН КАЛЬЦИЯ И ФОСФОРА
- •Кальцитриол
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Паратиреоидный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Гипофункция
- •Гиперфункция
- •Кальцитонин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ТИРЕОИДНОЙ ФУНКЦИИ
- •Тиреотропный гормон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Йодтиронины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГОРМОНЫ ПЕРИФЕРИЧЕСКИХ ЖЕЛЕЗ
- •Катехоламины
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкагон
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Инсулин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •ГРУППА ГОРМОНОВ РЕПРОДУКТИВНОЙ СИСТЕМЫ
- •Окситоцин
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Гонадотропные гормоны
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Половые гормоны
- •Строение
- •Синтез
- •Механизм действия
- •Женские половые гормоны
- •Регуляция синтеза и секреции
- •Гормональный цикл женщины
- •Мишени и эффекты
- •Патология
- •Мужские половые гормоны
- •Механизм действия
- •Регуляция синтеза и секреции
- •Мишени и эффекты
- •Патология
- •Производные проопиомеланокортина
- •Адренокортикотропный гормон
- •Строение
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Глюкокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •Минералокортикоиды
- •Строение
- •Синтез
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология
- •АЗОТСОДЕРЖАЩИЕ ВЕЩЕСТВА КРОВИ
- •Составные компоненты крови
- •БЕЛКИ КРОВИ
- •Типы протеинограмм
- •Белки острой фазы
- •Функции белков плазмы крови
- •ОСОБЕННОСТИ КОЛИЧЕСТВА БЕЛКОВЫХ ФРАКЦИЙ У ДЕТЕЙ
- •ИНДИВИДУАЛЬНЫЕ БЕЛКИ ПЛАЗМЫ КРОВИ
- •Альбумин
- •ФЕРМЕНТЫ КРОВИ
- •Энзимодиагностика
- •Причины изменения активности ферментов в крови
- •Группы ферментов сыворотки крови
- •Единицы измерения активности ферментов
- •ОСТАТОЧНЫЙ АЗОТ КРОВИ
- •Фракции остаточного азота
- •ОБМЕН ЖЕЛЕЗА
- •Суточная потребность
- •Пищевые источники
- •Растительная пища (в 100 г)
- •Животная пища (в 100 г)
- •Всасывание
- •Метаболизм железа
- •Выведение
- •Нарушение обмена железа
- •Избыток железа
- •Железодефицит
- •Причины
- •Симптомы
- •ГЕМОПРОТЕИНЫ. ОБМЕН ГЕМА
- •СТРОЕНИЕ И СИНТЕЗ ГЕМА
- •Регуляция синтеза гема
- •МИОГЛОБИН
- •ГЕМОГЛОБИН
- •Строение гемоглобина
- •Нормальные и патологические формы гемоглобина
- •Нормальные формы
- •Патологические формы
- •Изменение рН среды
- •Кооперативное взаимодействие
- •Роль 2,3-дифосфоглицерата
- •Нарушение синтеза гемоглобина
- •Порфирии
- •Талассемии
- •ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ
- •КАТАБОЛИЗМ ГЕМА
- •НАРУШЕНИЯ ОБМЕНА БИЛИРУБИНА
- •Гемолитическая желтуха
- •Механическая желтуха
- •Паренхиматозная желтуха
- •Нарушения обмена билирубина у детей
- •Гемолитическая болезнь новорожденного
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Физиологическая (транзиторная) желтуха новорожденных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Желтуха недоношенных
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Негемолитическая гипербилирубинемия новорожденных, вызываемая молоком матери
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •Причины
- •Клиническая диагностика
- •Лабораторная диагностика
- •Основы лечения
- •КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
- •РОЛЬ ВНЕКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •РОЛЬ ВНУТРИКЛЕТОЧНЫХ ИОНОВ ВОДОРОДА
- •ОСНОВНЫЕ ПОКАЗАТЕЛИ КОС
- •Водородный показатель
- •Нормальные величины
- •Клинико-диагностическое значение
- •Парциальное давление углекислого газа
- •Нормальные величины
- •Клинико-диагностическое значение
- •Нормальные величины
- •Клинико-диагностическое значение
- •Концентрация буферных оснований
- •Нормальные величины
- •Клинико-диагностическое значение
- •КОМПЕНСАЦИЯ ИЗМЕНЕНИЙ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА В ПЛАЗМЕ КРОВИ
- •Буферные системы
- •Бикарбонатная буферная система
- •Фосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •Дыхательная система
- •Костная ткань
- •Печень
- •Почки
- •Реабсорбция бикарбонат-ионов
- •Ацидогенез
- •Аммониегенез
- •ВНУТРИКЛЕТОЧНАЯ РЕГУЛЯЦИЯ КОНЦЕНТРАЦИИ ИОНОВ ВОДОРОДА
- •Метаболический ацидоз
- •Причины
- •Компенсация
- •Метаболический алкалоз
- •Причины
- •Компенсация
- •Респираторный ацидоз
- •Причины
- •Компенсация
- •Респираторный алкалоз
- •Причины
- •Компенсация
- •ВОДНЫЙ БАЛАНС
- •Источники воды
- •Выведение воды
- •Регуляция водного баланса
- •БИОХИМИЯ ПОЧЕК
- •ЭКСКРЕТОРНАЯ ФУНКЦИЯ
- •РЕГУЛИРУЮЩАЯ ФУНКЦИЯ
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •МЕХАНИЗМ ОБРАЗОВАНИЯ МОЧИ
- •Ультрафильтрация
- •Лабораторная оценка фильтрации
- •Реабсорбция
- •Проксимальный извитой каналец
- •Тонкое нисходящее колено петли Генле
- •Тонкое восходящее колено петли Генле
- •Толстая восходящая часть петли Генле
- •Дистальный каналец
- •Конечный отдел дистального канальца и собирательные трубочки
- •Лабораторная оценка реабсорбции
- •БИОХИМИЯ ПЕЧЕНИ
- •Функции печени
- •МЕТАБОЛИЧЕСКАЯ ФУНКЦИЯ
- •Углеводный обмен
- •Липидный обмен
- •Белковый обмен
- •Пигментный обмен
- •Оценка метаболической функции
- •ОБЕЗВРЕЖИВАЮЩАЯ ФУНКЦИЯ
- •Реакции микросомального окисления
- •Антипириновая проба
- •Реакции конъюгации
- •БИОТРАНСФОРМАЦИЯ С ОБРАЗОВАНИЕМ ТОКСИЧНЫХ ПРОДУКТОВ
- •Органотоксичность
- •Химический канцерогенез

biokhimija.ru |
Тимин О.А. Лекции по биологической химии |
97 |
|
|
|
в их составе мало незаменимых аминокислот, доля тех или иных аминокислот в растительном белке резко отличается от таковой животного белка.
Так как аминокислоты необходимы в определенном соотношении, то возникает понятие "лимитирующей аминокислоты", т.е. поступающей в минимальном и недостаточном количестве. Отсутствие этой аминокислоты препятствует использованию (включению в состав белка) других аминокислот, которых может быть достаточно.
Также в таких продуктах, как бобовые (соя, горох, фасоль) содержится пептид
– ингибитор трипсина, ухудшающий переваривание этих продуктов в сыром, термически необработанном виде.
У детей при недостатке белка в пище задерживается рост, отстает физическое и умственное развитие, изменяется состав костной ткани, снижается активность иммунной системы и сопротивляемость к заболеваниям, тормозится деятельность эндокринных желез. Выраженным нарушением потребления белков является квашиоркор – нехватка белков, особенно животных, в пище. В результате возникает дисбаланс аминокислотного состава пищи и недостаток незаменимых аминокислот. Заболевание наиболее характерно для слаборазвитых стран Азии и Африки и его начало совпадает с отнятием ребенка от груди матери (1,5-3 годика), когда он лишается полноценного белка и переходит на скудное растительное питание взрослых. У больных наблюдается истощение, остановка роста, отечность, анемия, нарушение интеллекта и памяти, умственная отсталость, гипопротеинемия и аминоацидурия.
ВНЕШНИЙ ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
Переваривание белков начинается в желудке, продолжается в двенадцатиперстной кишке и тонком кишечнике. Распад белков и аминокислот может происходить также в толстом кишечнике под влиянием микрофлоры.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
ЖЕЛУДОК
Вжелудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
РЕГУЛЯЦИЯ ЖЕЛУДОЧНОГО ПИЩЕВАРЕНИЯ
Осуществляется нервными (условные и безусловные рефлексы) и гуморальными механизмами.
К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин выделяется специфичными G-клетками:
o в ответ на раздражение механорецепторов,
o в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков), o под влиянием n.vagus.
Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также гастрин обеспечивает секрецию гистамина.
Гистамин, образующийся в энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам) слизистой оболочки желудка, взаимодействует с
Обмен аминокислот и белков |
98 |
|
|
Н2-рецепторами на обкладочных клетках желудка, увеличивает в них синтез и выделение соляной кислоты.
Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока.
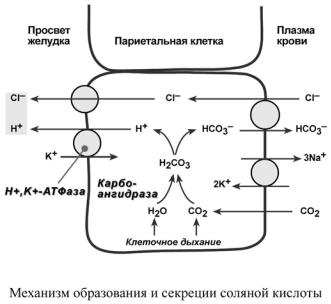
СОЛЯНАЯ КИСЛОТА
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+ и переносящие ионы Сl– из крови в полость желудка.
Функции соляной кислоты o денатурация белков пищи, o бактерицидное действие,
oвысвобождение железа из комплекса с белками и перевод его в двухвалентную форму, что необходимо для его всасывания,
o превращение неактивного пепсиногена в активный пепсин,
oснижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина.
ПЕПСИН
Пепсин – эндопептидаза, то есть расщепляет внутренние пептидные связи в молекулах белков и пептидов.
Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), блокирующий работу фермента, т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Оптимум рН для пепсина 1,5-2,0. Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутами-
новой кислоты и т.д.
