
- •Кафедра биохимии
- •Современные представления о биологическом окислении
- •Этапы унифицирования энергии пищевых веществ и образования субстратов тканевого дыхания
- •Цикл Кребса
- •Реакции цтк
- •Энергетический баланс одного оборота цтк
- •Оксидазный путь использования кислорода в клетке
- •Хемиосмотическая теория Митчелла
- •Современные представления о механизме окислительного фосфорилирования
- •Механизм окислительного фосфорилирования
- •Процесс окисления
- •Процесс фосфорилирования
- •Сопряжения и разобщения окислительного фосфорилирования
- •Коэффициент окислительного фосфорилирования
- •Транспорт веществ через мембрану митохондрий
- •Теплопродукция
- •Дыхательный контроль
- •Лекция № 6
- •2. Митохондриальные монооксигеназные системы
- •Диоксигеназные реакции
- •Пероксидазный и радикальный пути использования кислорода
- •Образование активных форм кислорода
- •Свойства активных форм кислорода
- •Использование активных форм кислорода в организме
- •Повреждающее действие активных форм кислорода в организме
- •Антиоксидантная система
- •1. Ферментативная антиоксидантная система
- •2. Неферментативная антиоксидантная система
1. Ферментативная антиоксидантная система
К ферментам, защищающим клетки от действия активных форм кислорода, относят супе-роксиддисмутазу, каталазу и глутатионпероксидазу. Наиболее активны эти ферменты в печени, надпочечниках и почках, где содержание митохондрий, цитохрома Р450и пероксисом особенно велико.
Супероксиддисмутаза(СОД) превращает супероксидные анионы в перекись водорода:
2О∙2 + 2H+ → H2O2+ O2
Изоферменты СОД находятся и в цитозоле (Cu2+ иZn2+) и в митохондриях (Mn2+) и являются как бы первой линией защиты, потому что супероксидный анион образуется обычно первым из активных форм кислорода. СОД — индуцируемый фермент, т.е. синтез его увеличивается, если в клетках активируется СРО.
Каталаза- геминовый фермент, катализирует реакцию разрушения перекиси водорода. При этом образуется вода и молекулярный кислород:
2Н2О2 → H2O+ O2
Каталаза находится в основном в пероксисомах, где образуется наибольшее количество перекиси водорода, а также в лейкоцитах, где она защищает клетки от последствий «респираторного взрыва» и в эритроцитах, где она защищает гем гемоглобина от окисления.
Глутатионпероксидаза— обеспечивает разрушение перекиси водорода и гидропероксидов липидов при окислении глутатиона (у-глутамилцистеинилглицин): Н2О2+ 2 GSH → 2 Н2О + G-S-S-G. Глутатионпероксидаза в качестве кофермента содержит селен.
Глутатионредуктазавосстанавливает окисленный глутатион с участием НАДФН2:
GS-SG + НАДФН2 → 2 GSH + НАДФ+.
Недостаток глутатиона в клетках, например эритроцитах, который может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы приводит к активации перекисного окисления; это, в частности, наблюдается при некоторых видах гемолитических анемий.
Фосфолипазав мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (LOOH), тем самым разрушаются гидроперекиси липидов, предотвращается разветвление цепей окисления липидов в мембранах.
2. Неферментативная антиоксидантная система
"Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол).
Витамин Е(α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от СРО. Различают 8 типов токоферолов, но α-токоферол наиболее активен. α-Токоферол отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), а сам превращается в малоактивный свободный радикал, что прерывает ПОЛ:
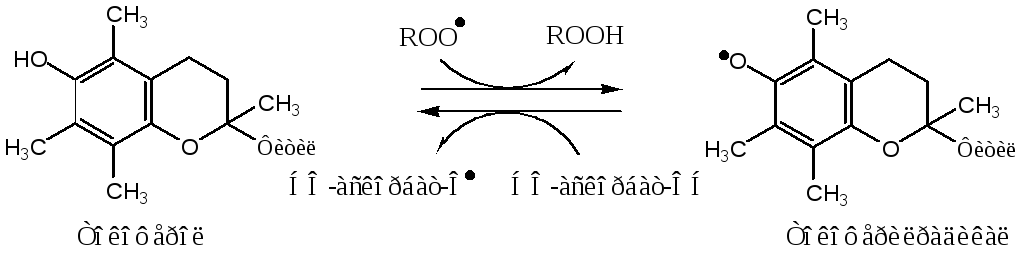
Регенерацию α-токоферола осуществляет витамин С.
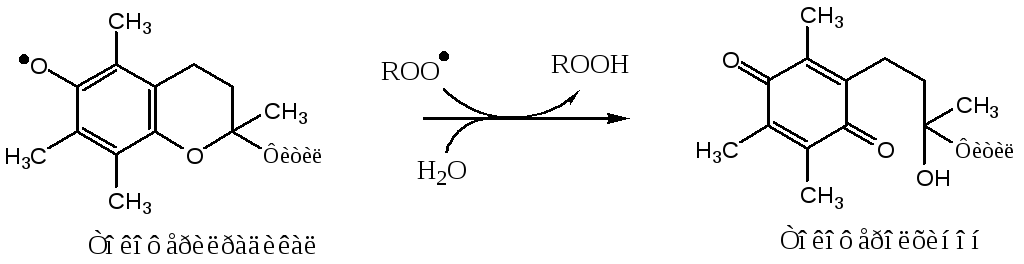
Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон.
Витамин Сингибирует СРО с помощью двух различных механизмов:
1). восстанавливает в мембранах токоферолхинон до витамина Е:
НО-аскорбат-ОН + α-ТФ-О·→ α-ТФ-ОН + НО-аскорбат-О·(семидегидроаскорбиновая к-та)
НО-аскорбат-О·+ α-ТФ-О·→ α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та)
Регенерация аскорбиновой кислоты идет с участием ферментативных систем:
а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохромb5:
2НО-аскорбат-О·+ НАДН2 → 2НО-аскорбат-ОН + НАД+
б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы:
2НО-аскорбат-О·+ НАДН2 → 2НО-аскорбат-ОН + НАД+
в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы:
О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ+
г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы:
О=аскорбат=О + 2GSH → НО-аскорбат-ОН +GS-SG
2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ.
Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.
Литература:
В.В. Кржечковская, А.А. Кубатиев, Ю.И. Наумов. Мембраносвязанный цитохром b5 и метаболизм липидов (реакции не связанные с участием системы цитохрома р -450). Серия. Критические технологии. Мембраны, 2004, № 2 (22).
