
1 модуль / Prostye_belki
.pdf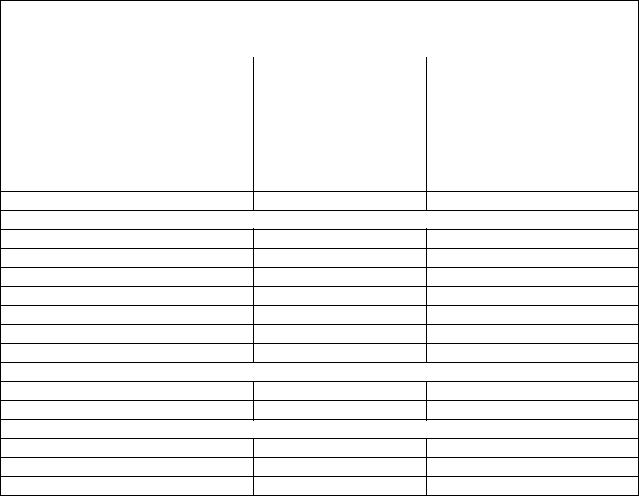
ЗАНЯТИЕ № 1
Тема: «Химическое строение белка».
Цель занятия: изучить особенности строения и свойства природных аминокислот; усвоить принцип образования из них пептидов и белков; использовать полученные знания для понимания основ структурно-функционального многообразия белковых молекул.
План подготовки к занятию:
1.Общее понятие о белках. Их классификация и биологическая роль.
2.Аминокислоты, как структурны единицы белковой молекулы.
3.Структура и биологические свойства пептидов. Представители.
4.Методы анализа белков (гидролиз, хроматография, солевое фракционирование, диализ, гельфильтрация, электрофорез, качественные цветные реакции на белки).
Задания и упражнения:
1.Повторить формулы 20 универсальных аминокислот. Обратить внимание на α- углеродный атом, функциональные группы и строение боковых радикалов ( R–групп).
2.Заполнить формулами аминокислот таблицу 1 в соответствии с полярностью их R-групп. При заполнении таблицы отметить цветными карандашами ионогенные полярные группировки (- COOH, -NH2, -NH) неионогенные полярные группировки (-ОН, -SH –CONH2), неполярные радикалы (алифатические цепи, ароматические кольца, не содержащие функциональных групп). Какие из них гидрофильны и легко гидратируются, а какие гидрофобные и не гидратируются? Таблица 1. «Классификация аминокислот»
Классификация аминокислот в соответствии с полярностью их R -групп
Классификация аминокислот. |
Название |
Формула |
|
I. Неполярные R. -группы |
|
|
|
1. |
Аланин |
|
|
2. |
Валин |
|
|
3. |
Лейцин |
|
|
4. |
Изолейцин |
|
|
5. |
Метионин |
|
|
6. |
Фенилаланин |
|
|
7. |
Триптофан |
|
|
8. Пролин
II Неионогенные полярные R –группы
1.Глицин
2.Серин
3.Треонин
4.Цистеин
5.Тирозин
6.Аспарагин
7.Глутамин
III. Ионизированные (отрицательно заряженные) полярные R. -группы
1.Аспарагиновая кислота
2.Глутаминовая кислота
IV. Ионизированные (положительно заряженные) полярные R, -группы
1.Аргинин
2.Лизин
3.Гистидин
3.Выучить буквенные сокращения названий аминокислот.
4.Написать тетрапептид: ала-сер-про-фен. Обратить внимание:
1) на излом полипептидной цепи в месте включения пролин 2) на отсутствие атома водорода при атоме азота аминогруппы пролина, образующей пептидную связь с серином.
5.Назвать пептид
H2N-CH-CO-NH-CH2-CO-NH-CH-CO-NH-CH—C-NH—CH-COOH
CH2OH |
|
CH2 |
CH3 O |
CH2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
||
|
|
|
|
|
CH3 CH3 |
|
|
|
|
|
|
||
|
|
|
|
|
||
Выделить в нем цветными карандашами пептидов связи и R -группы. Отметить N -конец (со |
||||||
свободной |
NH2-группой) и C - конец (со свободной СОOHгруппой). Указать гидрофобные и |
|||||
гидрофильные радикалы. |
|
|
|
|||
6.Познакомиться со схемой диссоциации пептида, общая формула которого
COOH
R COOH
NH2
COO- |
|
|
|
|
|
|
+H+ |
|
|
|
|
+H+ |
|
|
|
|
|
+OH |
COO |
|
|
COOH |
|
|
COOH |
||||||||||
R—COO- |
|
|
|
R--COO |
|
pH<7 R |
|
COO |
|
|
|
R |
|
COOH |
|||
|
|
|
|
|
|
|
|||||||||||
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
pH>7 |
NH3 |
|
|
|
NH3 |
pH<7 |
|
|
NH3 |
|
|
||||||
|
|
|
|
|
|
|
|||||||||||
7.Написать формулу пептида: ала-глу-асн-лиз. Аминогруппы и карбоксильные группы в боковых радикалах представить в ионизированном состоянии при рН = 7,0. Определить, как заряжен пептид? Как изменится его заряд при рН > 7,0, при рН < 7,0?
8.Изучить таблицу 2 и объяснить, от чего зависит биологическая активность и специфичность указанных пептидов.
Таблица 2. Биологически активные пептиды
Название |
Строение |
Действие |
|
|
|
Вазопрессин |
цис-тир-фен-гли-асп-цис- |
Антидиуретическое |
|
про-лиз-гли-NH2. |
|
Окситоцин |
цис-тир-иле-глн-асн-цис- |
Стимулирует сокращение |
|
про-лей-гли-NH2 |
матки |
|
|
|
Брадикицин |
арг-лро-про-гли-фен-сер - |
Противовоспалительное |
|
про-фен-арг |
|
Энкефалин |
тир-гли-глу-фен-мет |
Анальгезирующее |
|
|
|
9.Назвать:
а) универсальные цветные реакции на белки; б) специфические цветные реакции на аминокислоты.
Объяснить, для каких целей используют эти две группе цветных реакций?
10.Объяснить, что такое гидролиз белков. Почему он является одним из важнейших методов исследования белков? Написать схему кислотного гидролиза белка. Объяснить, под контролем, какой цветной реакции следует вести гидролиз.
11.Вспомнить основы хроматографического анализа аминокислот. С какой целые применяют этот метод анализа белков? Какую цветную реакцию используют для идентификации аминокислот при хроматографическом анализе?
12.Написать формулу пептида, дающего следующие положительные цветные реакции:
а) биуретовую б) ксантопротеиновую в) Миллона г) Фоля.
Литература:
1.Конспект лекций
2.Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник.- 3-е изд., перераб. и доп.- М.: Медицина, 2007. – 704 с., ил.
3.Николаев А.Я. Биологическая химия: Учебник - 3-е изд., перераб. и доп.- М.: МИА, 2004.- 568 с., ил.
4.Строев Е.А. Биологическая химия: Учебник.- М.: Высш. шк., 1986.- 479 с., ил.
Дополнительная литература:
1.Страйер Л. Биохимия: В 3-х томах. Пер. с англ. – М.: Мир, 1984.
2.Ленинджер А. Основы биохимии: В 3-х томах. Пер. с англ.– М.: Мир, 1985.
3.Мари Р. и др. Биохимия человека: В 2-х томах. Пер. с англ.– М.: Мир,1993.

ЗАНЯТИЕ № 2
Тема: «Физико-химические свойства белков».
Цель занятия: изучить особенности пространственной организации белковых молекул; знать свойства нативного белка, факторы, вызывающие его денатурацию и механизм реакций осаждений.
План подготовки к занятию:
1.Уровни структурной организации белковой молекулы,
2.Связи, участвующие в стабилизации структур.
3.Взаимосвязь между уникальной структурной организацией белков и их нативными свойствами.
4.Физико-химические свойства белков (заряд, гидратация, растворимость, факторы устойчивости в растворах).
5.Денатурация. Признаки денатурации. Факторы, вызывающие денатурацию.
6.Реакции осаждения белков: высаливание, реакции необратимого осаждения.
Задания и упражнения:
1.Назвать уровни организации белковых молекул. Дать определение каждому из них.
2.Какие из перечисленных типов внутримолекулярных взаимодействий стабилизируют первичную, вторичную, третичную и четвертичную структуру белка: а) пептидные; б) дисульфидные; в) водородные; г) ионные; д) гидрофобные.
3.Изучить приведенный ниже пептид и определить, в образовании каких связей могут участвовать R-группы составляющих его аминокислот:
4.Среди предложенных аминокислот: асп, фен, лей, глу, илей, асн, глн, мет, лиз, вал, три, про выбрать высокогидрофильные и высокогидрофобные кислоты.
5.Чем обусловлена различная растворимость глобулярных и фибриллярных белков?
6.Какая аминокислота всегда находится на месте изгиба полипептидной цепи в молекулах глобулярных белков?
7.Назвать факторы устойчивости белков в водных растворах.
8.Почему изоэлектрическая точка различна для разных белков?
9.Написать тетрапептид асп-глу-тре-ала. В какой среде лежит его ИЭТ? Почему, белок наименее устойчив в изоэлектрическом состоянии?
10.Какие, из перечисленных физико-химических свойств белков обуславливают степень их гидратации?
а) заряд; б) молекулярная масса; в) тип внутримолекулярных связей; г) форма молекулы д) наличие полярных групп.
11.В молекулах всех белков есть центры связывания (активный центры) с разнообразными веществами (лигандами).
Знать, что:
а) эти активные центры представляют собой уникальное сочетание определенных аминокислотных остатков;
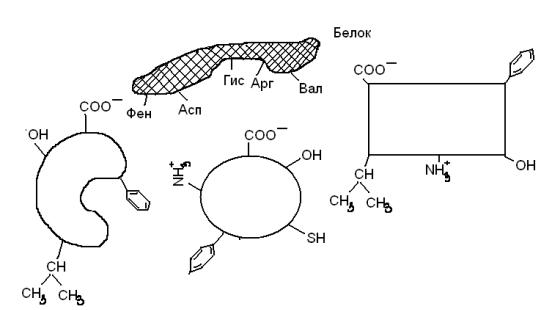
б) связи между белком и лигандом могут быть ковалентными, сложноэфирными, гликозидными, амидными) и нековалентными (водородными, ионным, гидрофобными); в) белки проявляют высокую избирательность (специфичность по отношению к различным лигандам;
г) высокая специфичность обеспечивается химическим и пространственным соответствием (комплементарностью) структуры активного центра белка структуре лиганда.
Изучить схему активного центра белка, ответить на вопросы:
А) Какой из перечисленных лигандов с наибольшей вероятностью будет взаимодействовать с активным центром данного белка?
Б) Назовите типы связей между белком и лигандом.
В) На каком уровне организации белковой молекулы формируется ее активный центр?
12.Что такое обратимое осаждение, чем его можно вызвать, меняются ли нативные свойства белка при таком осаждении?
13.Дать определение денатурации. Какие уровни пространственной организации белка нарушаются при этом процессе?
14.Что общего и чем отличаются друг от друга (по признакам) процессы высаливания и денатурации (подберите каждой цифре буквенный ответ)
А - высаливание |
1. Выпадение в осадок |
В - для денатурации |
2. Нарушение конформации |
С - для обоих процессов |
3. Растворение после диализа |
Д - ни для одного |
4. Сохранение нативной конформации |
5.Гидролиз пептидных связей
15.Почему при отравлении солями свинца к мути рекомендуется принимать яичные и молочные белки с последующим промыванием желудка?
Литература:
1.Конспект лекций
2.Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник.- 3-е изд., перераб. и доп.- М.: Медицина, 2007. – 704 с., ил.
Дополнительная литература:
1.Страйер Л. Биохимия: В 3-х томах. Пер. с англ. – М.: Мир, 1984.
2.Ленинджер А. Основы биохимии: В 3-х томах. Пер. с англ.– М.: Мир, 1985.
3.Мари Р. и др. Биохимия человека: В 2-х томах. Пер. с англ.– М.: Мир,1993.
