
литература / Sharapov_V._Datchiki
.pdf
Глава 21. Электрохимические и биохимические датчики
21.4. Кондуктометрические устройства
Типичным примером лабораторного электрокондуктомера является прибор согласно схеме, изображенной на рис. 21.3.
Рис. 21.3. Схема лабораторного электрокондуктомера
При питании прибора от стабилизированного источника напряжения U0 ток Ix будет пропорционален удельной электропроводности раствора. Действительно
I |
x |
|
U 0 |
U Y |
kU |
o |
, |
|
|||||||
|
|
|
0 x |
|
|
||
|
|
|
Rx |
|
|
|
|
где Yx — электропроводность раствора между электродами; 0 — удельная электропроводность раствора; k — постоянная электродной системы, которая определяется ее геометрическими размерами.
Ток Ix поступает на вход трансформатора Тp, являющегося согласовательным преобразователем для электронного усилитела ЭУ.
Схема выпрямления позволяет избежать фазовой погрешности, которая возникает за счет комплексного характера сопротивления кондуктометрического преобразователя. Температурная компенсация происходит в зависимости от типа исследуемого раствора при помощи терморезисторов RT1 или RT2, что позволяет привести температурную погрешность при изменении температуры исследуемого раствора в границах от (20…50) °С до (0,5…1)% на каждые 10 °С изменения температуры от ее номинального значения.
На рис. 21.4 изображена схема промышленного кондуктометрического концентратомера для измерений концентрации проточной жидкости, который состоит из резистивного электрохимического преобразователя, выполненного в виде двух плоскопараллельных пластин, помещенных в исследуемый раствор. Преобразователь включен в одно из плеч автоматического моста переменного тока.
Резисторы R4, R0, R1, R2, которые образуют другие три плеча моста,
21.4. Кондуктометрические устройства
изготовлены из манганинового провода. Для уменьшения температурной погрешности параллельно плечу R4 включают терморезистор Rt, помещенный в исследуемый раствор измеряемой концентрации.
При анализе агрессивных растворов используют безэлектродные (бесконтактные) кондуктометрические концентратомеры, преимуществом которых является отсутствие электродов, которые могли бы поляризоваться или загрязняться. Это повышает надежность и точность бесконтактных концентратомеров.
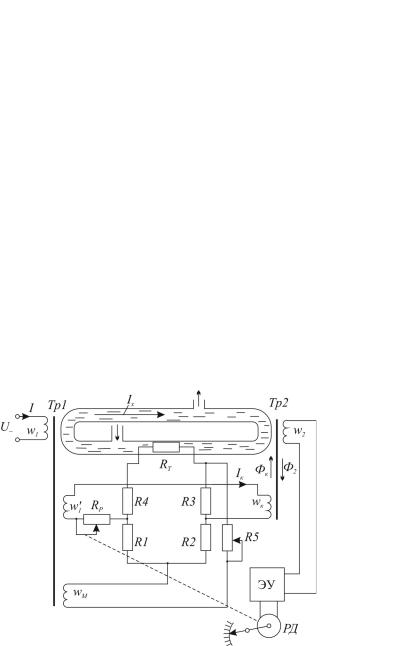
На рис. 21.5 показана схема такого прибора, в котором первичный трансформаторный безэлектродный преобразователь состоит из силового Тр1 и измерительного Тр2 трансформаторов, первичные w1 и измерительные w2 обмотки которых индуктивно связаны между собой короткозамкнутым витком в виде стеклянной трубки, через которую протекает исследуемая жидкость. Трубка с жидкостью является одновременно вторичной обмоткой трансформатора Тр1 и первичной трансформатора Тр2. Под действием переменного магнитного потока, который создается током I в обмотке w1, в жидкости индуктируется ЭДС, в результате которой протекает ток Iх. Значение тока пропорционально гx — удельной электропроводности исследуемого раствора, а, следовательно, исследуемой концентрации сх. Ток Iх создает магнитный поток в сердечнике трансформатора Тр2, индуктируя в обмотке w2 ЭДС E2 , значение которой также пропорционально.
Рис. 21.5. Схема бесконтактного промышленного кондуктометрического концентратомера
ЭДС E2 усиливается усилителем и приводит в движение вал реверсивного двигателя РД, который перемещает ползунок реохорда Rp, изменяя ток Iк в цепи обмотки wk. В сердцевине трансформатора Тр2 создается магнитный поток Фк противоположный к магнитному потоку Ф2, который создается током Iх. В момент равенства этих потоков ЭДС E2 уменьшается до порога чувствительности усилителя и вращение вала РД прекращается, а указатель шкалы займет положение, которое отвечает измеряемой концентрации.

Глава 21. Электрохимические и биохимические датчики
Для автоматической коррекции влияния изменения температуры исследуемой жидкости на показания прибора служит четырехплечий мост, который питается от обмотки wм и включен выходной диагональю в цепь обмоток w91 и wk и реохорда Rp. Мост образуют температуро-независимые (манганиновые) резисторы R1, R2, R3, R4 и термозависимое сопротивление RТ, которое помещено в исследуемую жидкость.
21.5.Измерительные преобразователи рН-метров
Впрактике анализа растворов значительное место занимают потенциометрические методы измерения концентрации определенных ионов. Потенциометрический метод основывается на использовании закона Нернста, который устанавливает зависимость электродного потенциала от концентрации соответствующих ионов в растворе (21.1).
Принцип действия гальванических преобразователей рН метров основан на зависимости электродных потенциалов от активности водородных ионов, по которой можно определить свойства, в частности, концентрацию водных растворов.
Суть этого способа такова. Даже самая чистая вода имеет некоторую электрическую проводимость, определяемую наличием в ней некоторого количества ионов, которые возникают в результате реакции, которая называется автопротолизом [9]
Н2О + Н2О ` Н3О+ + ОН.
Суть автопротолиза заключается в перемещении ионов водорода Н+ от одних молекул воды к другим. Следовательно, в водородных растворах, да и в чистой воде, свободных ионов Н+ нет, а есть гидратированные ионы гидроксония Н3О+.Однако для упрощения диссоциацию представляют как
Н2О ` Н+ + ОН,
то есть считают, что молекулы воды частично диссоциируют на ионы водорода Н+ и ионы гидроксила ОН-.
Для дистиллированной воды и нейтральных растворов активность аН+ ионов водорода равняется активности аОН- ионов гидроксила. Для водных растворов кислот aH 7 aОН и тем больше, чем больше концентрация кислот, а для водных растворов щелочей aH = aОН и уменьшается при увеличении концентрации. В то же время для данной температуры произведение этих активностей всегда остается постоянным как для воды, так и для водных растворов кислот и щелочей, и характеризуется так называемым ионным произведением воды:
K H2O aH aOH .
Установлено, что при нормальной температуре (20 °С) ионное произведение воды K H 2O 10 14 (моль/л). В чистой воде или в нейтральном растворе активность ионов Н+ и ОН- одинакова, то есть
a |
H |
a |
|
K |
H 2O |
10 7 |
моль/л. |
|
|
ОН |
|
|
|||
21.5. Измерительные преобразователи рН-метров
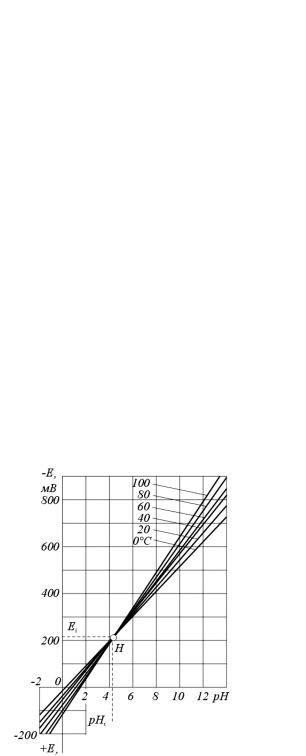
Ионное произведение воды при данной температуре остается постоянным также и для любого водного раствора, в частности, для растворов кислот с остатком ионов Н+ или щелочей с избытком ионов ОН-. В это же время ионное произведение воды является некоторой функцией температуры, в частности, при t = 0 °С KH2O 10 15 моль/л, а при t = 50 °С KH2O 10 13,2 моль/л. В соответствии с температурой изменяется также концентрация водородных ионов, а следовательно, для однозначного определения рн необходимо знать температуру раствора.
Следовательно, при KH2O const для оценки свойств водных растворов достаточно измерять, например, активность водородных ионов. На практике для удобства вычислений активность водородных ионов характеризуют водородным показателем рН, который определяется как отрицательный логарифм активности ионов водорода:
pH lg (aH ) lg ( fH cH ).
Показатель рН для водных растворов при нормальной температуре изменяется от 0 для концентрированных водных растворов кислот до 14 единиц для концентрированных водных растворов щелочей. В растворах неводных растворителей показатель рН в зависимости от концентрации будет изменяться в других пределах, например, в аммиаке от 0 до 32,7 ед. Принцип построения шкалы рН объясняет рис. 21.6.
|
|
|
|
|
|
|
|
[OH] моль/л |
pH |
100 |
102 |
104 |
106 |
108 |
1010 |
1012 |
1014 |
|
|
|
|
|
|
|
pOH |
|
14 |
|
|
|
|
|
|
|
0 |
12 |
|
|
|
|
|
|
|
2 |
10 |
|
|
|
|
|
|
|
4 |
8 |
|
щелочь |
|
H2O (25 °С) |
|
6 |
||
6 |
|
|
|
|
|
|
|
8 |
4 |
|
|
|
|
кислота |
|
10 |
|
2 |
|
|
|
|
|
12 |
||
|
|
|
|
|
|
|
||
0 |
|
|
|
|
|
|
|
14 |
|
1014 |
1012 |
1010 |
108 |
106 |
104 |
102 |
100 [OH+] моль/л |
Рис. 21.6. К принципу построения шкалы рН
Прибор, предназначенный для измерения рН, называют рН-метром. Самый точный и наиболее универсальный метод измерений рН базируется на определении электродных потенциалов разных электродов, размещенных в исследуемом растворе. Гальванические преобразователи рН-метров состоят из двух полуэлементов: стеклянного измерительного, электродный потенциал которого является функцией рНх исследуемого раствора и вспомогательного, электродный потенциал которого известен и не зависит от свойств исследуемого раствора.
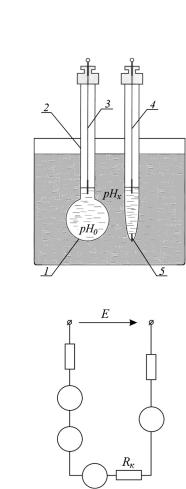
Стеклянный измерительный полуэлемент (рис. 21.7, а) — это тонкостенная (0,05...0,1 мм) колба 2, нижняя сферическая часть 1 которой изготовлена из специального мембранного стекла и заполнена так называемым буферным

21.5. Измерительные преобразователи рН-метров
ребра. От исследуемого раствора внутренняя часть электрода изолирована резиновыми мембранами, в пространстве между которыми находится также 3,5 н раствор КСl. Диффузионный потенциал на поверхности разделительной мембраны достигает 10 мВ. Общее сопротивление электрода не превышает 20 кОм.
Вспомогательный полуэлемент может быть размещен в исследуемом растворе или за его пределами, но в обоих случаях соединен с исследуемым раствором с помощью соответственно разделительной мембраны или электролитического ключа. На рис. 21.7, а вспомогательный полуэлемент помещен в исследуемый раствор и электрически соединен с ним с помощью электролитического ключа 5. Эквивалентная электрическая схема такого гальванического преобразователя приведена на рис. 21.7, б. Здесь ех и еd — соответственно электродные потенциалы измерительного и вспомогательного полуэлементов, Rex и Red — соответственно полные сопротивления измерительного и вспомогательного электродов; Rк — сопротивление электролитического ключа.
Выходной величиной такого гальванического преобразователя будет разница электродных потенциалов
E ex ed e0 ed epH pH E0 epH pH.
Выбор системы электродов для первичного преобразователя рН-метра, их конструктивное оформление и технические характеристики определяются условиями эксплуатации, диапазоном измерения, необходимой точностью. Для промышленных рН-метров электродная система обеспечивается дополнительной защитной арматурой для защиты от механических воздействий и для крепления к исследуемому объекту.
Основными составляющими погрешности первичных преобразователей рН-метров являются щелочная, диффузионная и температурная погрешности.
Щелочная погрешность возникает в щелочных средах в связи с процессами ионного обмена щелочных элементов, то есть перехода щелочных ионов (натрия или лития) из мембранного стекла стеклянного электрода в исследуемый раствор. Щелочная погрешность снижает значение измеряемого рН и функционально зависит как от значения рН, так и от концентрации щелочных ионов (натрия или лития). Одним из основных способов уменьшения щелочной погрешности является разработка специального мембранного стекла. Нужно также отметить, что щелочная погрешность резко уменьшается с повышением температуры.
При измерении рН проточных растворов в результате образования диффузионного потенциала, который формируется на диафрагме электрода сравнения, возникает так называемая диффузионная погрешность. При использовании в электроде сравнения концентрированных растворов электролитов с приблизительно одинаковой подвижностью анионов и катионов при исследовании достаточно разведенных растворов (с концентрацией меньше чем 0,1 моль/л) диффузионный потенциал не превышает ±(0,2...0,3) мВ. Для сильноконцентрированных растворов диффузионный потенциал может достигать до 10 мВ при полезной ЭДС в сотни милливольт. Для уменьшения диффузионных потенциалов вспомогательный электрод соединяют с исследуемым раствором с помощью электролитического ключа, заполненного насыщенным раствором КСl, на границах с которым диффузионные потенциалы не превышают 1...2 мВ.
21.6. Ионометры
Как следует из последнего выражения, температурную компенсацию можно в небольшом интервале изменения температур осуществить с помощью одного термозависимого сопротивления.
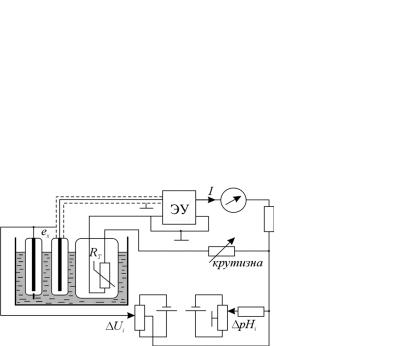
Принципиальная схема рН-метра уравновешивающего преобразования с автоматической коррекцией температурной зависимости и ручным введением поправок, которые отвечают значениям координат изопотенциальной точки, приведена на рис. 21.9.
Рис. 21.9. Принципиальная схема рН-метра с коррекцией
ЭДС гальванического преобразователя поступает на вход усилителя, охваченного глубокой отрицательной обратной связью, и сравнивается с компенсирующим напряжением, значение которого определяется током І и параметрами корректирующих элементов цепи обратной связи. При достаточно большом коэффициенте усиления электронного усилителя значение выходного тока І будет пропорциональным ЭДС Ех, и следовательно, будет мерой измеряемого рН.
21.6. Ионометры
Ионометрия — это выборочное измерение концентрации ионов определенных электрохимических элементов в растворах. Аналогично, как и концентрацию ионов водорода, активную концентрацию ионов других химических элементов оценивают отрицательным логарифмом активности этих ионов, то есть показателем рМ (здесь М — химический элемент, концентрацию ионов которого измеряют).
Развитие ионометрии привело к созданию нового вида электродных сенсоров — ионоселективных электродов (ИСЭ). И если начальный этап развития ионометрии был связан с интенсивным поиском новых электродных материалов и новых конструкций, то впоследствии основное внимание уделялось глубокому изучению ионной селективности, механизма электродных реакций, расширению практического использования ионных сенсоров, особенно в клинической практике и при исследовании окружающей среды.
Появление новых аналитических методов, основанных на использовании ИСЭ, объясняется широкими возможностями этих сенсоров при исследова-

Глава 21. Электрохимические и биохимические датчики
нии активности ионов натрия, калия, кальция, фторид-, хлорид-, нитрат- и сульфидионов. ИСЭ могут использоваться при исследовании органических соединений, таких как амигдалин, холестерин, мочевина и др., а также при определении концентрации растворимых газов, например, аммиака, окислов азота, диоксида углерода.
Ионоселективный электрод — это электрохимический преобразователь, предназначенный для потенциометрического определения активности определенных ионов, в большинстве случаев в водных растворах, а в отдельных случаях и в неводных средах (в последнем случае есть необходимость введения так называемого индифферентного электролита).
Типичная электродная система иономера состоит из измерительного ИСЭ и электрода сравнения. На рис. 21.10 приведена электрическая цепь с ионоселективным измерительным электродом в паре с одним из обычных электродов сравнения. Это так называемая измерительная цепь с переносом.
Измерительный ионоселективный электрод (полуэлемент) состоит из ионоселективной мембраны 1, внутреннего контактного раствора 2 (или твердого контакта — полностью твердофазная конструкция) и внутреннего измерительного электрода 3. Второй полуэлемент образован внешним электродом сравнения 4, который погружен в стандартный электролит (солевой мостик) 5, который контактирует с исследуемым раствором
через диафрагму 6 (рис. 21.10).
ИСЭ можно классифицировать согласно природе электродноактивного материала мембраны на такие типы:
—электроды с твердой мембраной, для изготовления которых используются кристаллические материалы;
—стеклянные мембранные электроды, изготовленные из литиевого, алюмосили-
Рис. 21.10. Типичная электродная си- |
катного или многокомпонентного стек- |
стема ионометра |
ла; |
—электроды на основе жидких ионообменников, мембрана которых состоит из
несмешивающейся с водой органической фазы. Она содержит подвижные ионы или ионные соединения (щелочи, соли, гидрофобные кислоты);
—электроды с жидкими мембранами на основе нейтральных носителей. Мембрана является электронейтральным раствором специфических комплексосоздающих реагентов (ионофоров), которые образуются в инертной полимерной матрице;
—ионоселективные полевые транзисторы, которые являются гибридными устройствами, содержащими ионоселективный электрод и полевой транзистор на основе системы металл — оксид металла [10, 12].

