
- •Наследственные факторы
- •Центральные нейрогенные механизмы. Роль лептина в жировом обмене
- •Метаболические особенности организма
- •Гиподинамия
- •Гиперплазия жировой ткани
- •Психологические и социально - экономические влияния
- •VIII. Сахарный диабет 2-го типа – заключительный этап развития метаболического синдром
Лекционный материал по теме :
«Метаболический синдром (синдром Х). Этиология, патогенез, исходы»
Из истории изучения метаболического синдрома. Определение понятия «метаболический синдром»
1. Г.Ривен (G.Reaven) в 1988 г. высказал предположение о том, что в основе значительного числа случаев возникновения артериальной гипертензии, сахарного диабета 2-го типа, атеросклероза и ишемической болезни сердца лежат инсулинорезистентность и гиперинсулинемия.
Он предложил для обозначения сочетания этих этиологических и патогенетических факторов термин «синдром Х».
В целом по данным Ривена синдром Х включает в себя гиперинсулинемию, инсулинорезистентность, повышение уровня холестерина и липопротеинов низкой плотности, понижение уровня липопротеинов высокой плотности и артериальную гипертензию.
2. Н.Каплан (N.M.Kaplan) в 1989 г., исследуя те же проблемы сердечно-сосудистой патологии, предложил термин «смертельный квартет» для объединения таких этиопатогенетических факторов как инсулинрезистентность и гиперинсулинемия, нарушение толерантности к глюкозе, алиментарное ожирение, артериальная гипертензия.
В настоящее время в патофизиологических и клинических работах данный симптомокомплекс чаще всего именуется как метаболический синдром или синдром Х
3. Таким образом, метаболический синдром характеризуется сочетанием нескольких метаболических дефектов, которые при отсутствии должного лечения с высокой вероятностью приводят к развитию таких тяжелых патологических состояний, как атеросклероз и сахарный диабет 2-го типа (инсулиннезависимый сахарный диабет).
Клинические проявления метаболического синдрома
1. Инсулинрезистентность, гиперинсулинемия, нарушение толерантности к глюкозе
2. Алиментарное ожирение абдоминального типа
3. Артериальная гипертензия
4. Системный атеросклероз
5. Ишемическая болезнь сердца
6. Хроническая сердечная недостаточность
Патогенетические механизмы развития инсунрезистентности и гиперинсулинемии
Определение понятия «инсулинрезистентность»
Инсулинрезистентность – это нарушение механизма биологического действия инсулина, сопровождающееся нарушением толерантности к глюкозе инсулинзависимых тканей и гиергликемией
Инсулиновые рецепторы. Функции инсулина в клеточном метаболизме. Рецепторы глюкозы

Согласно современным представлениям, на мембранах клеток находятся особые гликопротеиновые образования, являющиеся рецепторами инсулина. Наибольшее их количество
(до 250 000 рецепторов на клетку) - в гепатоцитах, а наименьшее (до 5000 рецепторов на клетку) - в жировой ткани. Таким образом, клетки организма обладают поистине бессчетным количеством инсулиновых рецепторов, однако, в норме функционирует всего до 10% от их общего количества. Другими словами, система захвата инсулина клетками многократно сдублирована, что свидетельствует о ее исключительной важности для организма.
Инсулиновый рецептор – это сложный белок, состоящий из двух пар субъединиц.
-субъединицы находятся на наружной поверхности мембраны клетки и обеспечивают контакт и соединение с молекулами инсулина. -субъединицы располагаются трансмембранно, их внутренняя (по отношению к мембране клетки) часть обладает тирозинкиназной активностью. Тирозинкиназа инсулинового рецептора обеспечивает связывание и фосфорилирование (дефосфорилирование) так называемых «СИР-белков», то есть белков субстрата инсулинового рецептора. Каскад реакций фосфорилирования белков и является основным передающим и исполнительным аппаратом клетки, благодаря чему обеспечивается выполнение функций инсулина в клетке (см. схему), в том числе, и транслокация рецепторов глюкозы в мембрану клетки и транспорт глюкозы в цитоплазму клеток инсулинозависимых тканей.
Глюкоза переносится в клетки организма двумя основными путями:
- за счет активного транспорта, связанного с затратами энергии и зависящего от
концентрации натрия в среде, из которой транспортируется глюкоза;
- за счет облегченной диффузии.
И в том, и в другом случае переносчиками глюкозы являются специальные трансмембранные белки (рецепторы глюкозы), образующие гидрофильные трансмембранные каналы.
Рецепторы, зависящие от натрия, обнаруживаются только на клетках эпителия почечных канальцев и кишечника и обеспечивают транспорт глюкозы против градиента концентрации. Рецепторы облегченной диффузии обеспечивают транспорт глюкозы по градиенту концентрации (из крови, где концентрация глюкозы достаточно высока, в клетку, где ее концентрации равна нулю) и расположены на клетках всех других тканей организма. Без посредства этих рецепторов глюкоза, не смотря на разницу ее концентрации внутри и вне клетки, пройти через мембрану не может.
Рецепторы облегченной диффузии (их насчитывается 5 видов) могут находиться как в мембране клеток, так и мембранных везикулах в протоплазме клеток. Четыре вида рецепторов не зависят от инсулина и транспортируют глюкозу в клетки без его воздействия на клеточные инсулиновые рецепторы.
Рецепторы, зависящие от инсулина, содержатся только в клетках так называемых «инсулинозависимых тканей» – скелетной и сердечной мускулатуре, жировой ткани. Под действием инсулина на инсулиновые рецепторы клеток этих тканей транспорт глюкозы в клетку возрастает в 30 – 40 раз. Резкое ускорение транспорта глюкозы связано с особенностью клеток инсулинозависимых тканей, в которых подавляющее большинство рецепторов глюкозы содержится в мембранных везикулах. Их встраивание в мембрану клеток происходит только после соединения инсулинового рецептора с молекулой инсулина, который после этого и передает сигнал, обеспечивающий быстрое передвижение везикул к мембране клетки и встраивание рецепторов глюкозы в мембрану. Схема этого процесса представлена ниже.
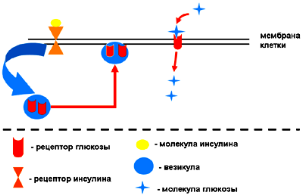
Из приведенного выше текста понятно, что возможность проникновения глюкозы в клетки инсулинзависимых тканей полностью зависит от соединения молекулы инсулина с инсулиновым рецептором, а также от того насколько успешно сигнал от этого соединения будет передан на исполнительный аппарат клетки. Кроме того, нужно иметь в виду, что основными потребителями глюкозы в организме являются именно инсулинзависимые ткани1, и, таким образом, отсутствие потребления этими тканями глюкозы приведет к значительному увеличению ее концентрации в крови, то есть к гипергликемии.
Ниже приведены диагностические критерии ВОЗ по определению нарушений толерантности тканей к глюкозе.
Определение уровня глюкозы в крови после приема утром натощак 75 г глюкозы:
- уровень глюкозы ниже 7ммоль/л (125 мг%) – норма;
- уровень глюкозы 7,1 – 11,1 ммоль/л (200мг%) – нарушенная толерантность к глюкозе;
- уровень глюкозы выше 11,1 ммоль/л – сахарный диабет (скорее всего инсулиннезависимый сахарный диабет).
Существует достаточно много причин, благодаря которым может быть нарушена функция инсулинового рецептора. Перечислим основные из них:
1. Мутации, вызывающие дефекты связывания инсулина с рецептором
2. Мутации, ускоряющие деградацию рецептора
3. Мутации, снижающие скорость биосинтеза рецептора
4. Мутации, затрудняющие внутриклеточный транспорт молекулы инсулина
5. Мутации, снижающие активность рецепторной тирозинкиназы
В целом, схему развития инсулинрезистентности и гиперинсулинемии можно представить в следующем виде.

Алиментарное ожирение как один из важных факторов развития метаболического синдрома
В самом простом смысле алиментарное ожирение можно определить как повышенное содержание жировой ткани в организме, возникающее в результате избыточного питания. Удельный вес этого страдания среди всех форм ожирения составляет 75%.
Ожирение относится к наиболее распространенным заболеваниям, с прогрессивным увеличением частоты во всех странах с высоким уровнем экономического развития. В этих странах по данным ВОЗ около 30% населения имеет массу тела, превышающую норму на 20% и более, то есть практически каждый третий страдает ожирением. Наиболее часто ожирение встречается в возрастных группах старше 50 лет, особенно у женщин. Особое значение для развития метаболического синдрома имеет так называемый «абдоминальный тип ожирения», то есть ситуация, при которой жировая ткань получает наибольшее распространение в абдоминальной области.
Висцеральная (абдоминальная) жировая ткань, в отличие от жировой ткани другой локализации, богаче иннервирована, имеет более широкую сеть капилляров и непосредственно сообщается с портальной системой. Висцеральные адипоциты имеют высокую плотность
ß-адренорецепторов и низкую плотность рецепторов к инсулину. Благодаря этому обстоятельству висцеральная жировая ткань повышенно чувствительна к липолитическому действию катехоламинов и мало реагирует на антилиполитическое действие инсулина.
В развитии алиментарного ожирения, в том числе – и ожирения абдоминального типа, играет роль целый ряд факторов, указанных на прилагаемой схеме.

Наследственные факторы
Генетические исследования показывают, что, если потомство двух родителей с нормальной массой тела имеет лишь 10% вероятности ожирения, то возможность избыточного веса у потомства одного или обоих тучных родителей составляет 50% и 80%, соответственно. Однако имеются данные, что у приемных детей тучных родителей частота ожирения выше, чем у приемных детей родителей с нормальной массой тела. Это говорит о том, что, в развитии ожирения наряду с генетическими факторами, немаловажную роль играют и условия питания в семье.
В то же время у животных были установлены генетические дефекты, способствующие ожирению. Эти факторы приводят к снижению возбудимости гипоталамического центра сытости, в результате чего чувство насыщения возникает при приеме гораздо большего количества пищи, чем это требуется нормальным животным. Кроме того, генетически детерминированными могут быть и повышенная пролиферация адипоцитов, и дефекты многочисленных ферментов липолиза.
Центральные нейрогенные механизмы. Роль лептина в жировом обмене
Центры жирового обмена и потребления пищи локализуются в различных участках ЦНС, но главная регуляция этих процессов осуществляется в гипоталамусе. Уменьшение или увеличение содержания в этой области серотонина и триптофана может сопровождаться изменением пищевого поведения и массы тела. Кроме того, гипоталамус регулирует выброс инсулина и глюкагона, имеющих отношение и к липогенезу, и к липолизу. Таким образом, перестройка вегетативных центров может способствовать развитию ожирения.
В развитии алиментарного ожирения, значительную роль играет описанный относительно недавно гормон лептин (по своему строению и характеру действия его можно отнести и к цитокинам). Функции лептина в организме представлены на следующей схеме.

Лептин повышенно продуцируется жировой тканью при увеличении ее массы, переедании, а также при повышенной секреции инсулина и глюкокортикоидов. Соединяясь со специфическими лептиновыми рецепторами нейронов гипоталамуса, коры больших полушарий, таламуса и некоторых других структур ЦНС, лептин тормозит выработку ряда гипоталамических нейропептидов, в частности, нейропептида Y, который, по современным данным, служит стимулятором нейронов пищевого центра. Результатом этого процесса является снижение аппетита, повышение тонуса симпатической нервной системы, интенсификация процессов метаболизма. Следует указать, что у людей, страдающих ожирением, уровень лептина в крови не только не снижается, но даже может быть выше нормального. Это объясняется рядом причин, основные из которых демонстрирует прилагаемая схема.

Нарушения эндокринной регуляции
Гиперинсулинизм, гиперфункция коры надпочечников, гипотиреоз снижение продукции СТГ, гипофункция половых желез, гиперпродукция адренокортикотропина - сами по себе могут играть важную роль в развитии ожирения. Однако, даже если секреция указанных гормонов является нормальной, но находится на верхней или нижней границе нормы, в условиях переедания такие состояния могут сыграть роль фактора, “помогающего” ожирению.
