
физика все лабы / 205 / лабораторная 205
.docПетербургский Государственный Университет Путей Сообщения
Кафедра: «Физика». Лаборатория: «Электрофизика».
Лабораторная работа № 205
по теме: «Определение параметров электропроводности электролита»
Выполнил студент Проверил преподаватель:
группы ПМ-012
Ядрихинская Мария
Санкт-Петербург
2001
-
Цель работы – определение параметров электропроводности электролита.
-
Порядок выполнения работы.
-
Собрать электрическую цепь.
-
После проверки схемы преподавателем или лаборантом включить вилку шнура питания выпрямителя в сеть. Замкнуть ключ, установить ток в цепи с помощью регулятора тока на передней панели выпрямителя 0.8 – 1.5 А, измеряя его амперметром, включенным в цепь.
-
Разомкнуть ключ, вынуть катод из электролита: просушить его и взвесить, записать в таблицу значение m1. Не касаться пальцами поверхности электрода!
-
Катод снова поместить в вольтаметр, замкнуть ключ, пропускать установленный постоянный ток в течение 10 минут (ток в цепи поддержать постоянным). Отметить по вольтметру напряжение на электродах U , записать в таблицу значения U, I, t, h (по делениям на электроде)
-
Разомкнуть ключ, вынуть пластинку с осажденной на ней медью, просушить и взвесить. Записать в таблицу m2.
-
Измерить ширину пластинки a и расстояние между электродами d.
-
Определить значения k, F, e. Оценить погрешности этих величин.
-
Рассчитать параметры электролитической проводимости
j, E, , n, V+, V-, r+, r-,
-
Перечень и характеристики измерительных приборов.
-
№
Название прибора
Род тока
Система прибора
Класс точности
Пределы измерения
Цена деления
1
Амперметр
2
Вольтметр
-
С
 хема
установки.
хема
установки.














 + -
+ -

 K A
K A

































-
Протокол наблюдений.
Таблица 1.
|
m1 кг |
m1 кг |
m2 кг |
m2 кг |
m кг |
m кг |
IА |
I А |
t с |
t с |
UВ |
U В |
h М |
d м |
a м |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-
Расчетные формулы.
K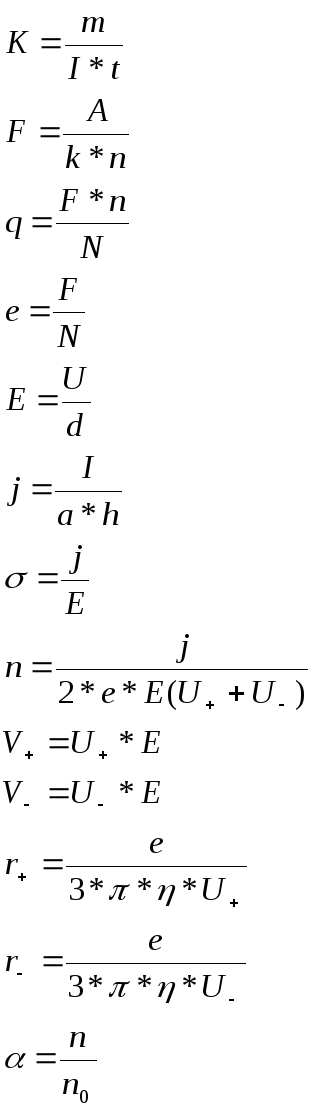 - электрохимический эквивалент меди
- электрохимический эквивалент меди
m – масса выделившейся меди
I – сила тока
t – время его прохождения
F – число Фарадея
А – атомный вес АCu=64
n – валентность nCu=2
q – заряд, с прохождением которого через электролит связано выделение каждого атома
e – заряд электрона e=1,6*10-19Кл
N – число Авогадро N=6,02*1023 атомов
Е – напряженность электрического поля
U – напряжение на электродах
d – расстояние между электродами
j - плотность тока в электролите
a – ширина пластинки
h – глубина погружения электродов в электролит
- удельная электропроводность
n – концентрация носителей заряда
U+, U- - подвижности ионов U+(Cu++)=9.3*10-8м3/(В*с)
U-(SO4--)=14.2*10-8м3/(В*с)
V+, V- - скорость движения иона в электролите под действием электрического поля
r+, r- - радиус сольватации (или толщину ионной атмосферы)
![]() -
вязкость воды при комнатной температуре
-
вязкость воды при комнатной температуре
![]() =1.055*10-3кг/(м*с)
=1.055*10-3кг/(м*с)
![]() -
степень диссоциации
-
степень диссоциации
n0 – концентрация молекул n0=5.555*1026м-3
= 3.14
-
Вычисления.

8. Выводы.
