
Замараев - часть 2
.pdf
выбрать какое-либо другое состояние (например, состояние, соответствующее бесконечно разбавленному раствору). В этом случае для расчета коэффициентов активности в дос- таточно разбавленных растворах можно воспользоваться тео- рией сильных электролитов Дебая–Хюккеля:
|
|
|
|
ln f = - Z2 A |
I |
, |
|
|
(5.12) |
|||
|
|
|
|
i |
|
|
i |
|
|
|
||
где |
Zi – заряд иона в |
единицах заряда |
электрона; |
|||||||||
I = |
1 |
åCj × Z2j |
– ионная сила; Cj – концентрация иона j-го типа; |
|||||||||
|
||||||||||||
2 |
j |
|
|
|
|
|
|
|
|
|
|
|
Zj – его заряд, |
A – коэффициент, равный |
|
|
|
||||||||
|
|
|
|
e3 |
|
|
|
|
|
|
||
|
|
|
A = |
|
|
2 p×NA |
, |
(5.13) |
||||
|
|
|
e ×kБT |
|
1000 e ×kБT |
|||||||
где e – заряд электрона; NA – число Авогадро; e – диэлектри- ческая постоянная среды. Для воды при 25 °C
A = 0,51× 2,3 . (5.14)
Применим формулы (5.11), (5.12) и (5.14) для описания ре-
акции между двумя ионами AZA и AZB с зарядами Z |
A |
и Z : |
||||||||
|
|
|
|
|
|
|
|
|
B |
|
AZA + AZB |
|
|
|
[A ∙∙ ∙∙ B](ZA + ZB ) ¾¾® P(ZA + ZB ) |
|
|||||
|
|
|
||||||||
|
|
|
|
|||||||
(в этом уравнении реакции [A ∙ ∙ ∙ ∙B](ZA + ZB ) |
– активированный |
|||||||||
комплекс, P(ZA + ZB ) – продукт реакции). Получим |
|
|
||||||||
ln k = ln ko + A |
|
[(ZA + ZB )2 - Z2A - ZB2 ], |
|
|
||||||
I |
|
|
||||||||
|
ß |
|
|
|
|
|||||
|
ln k = ln ko + 2 ZA ZB × A × |
|
. |
|
(5.15) |
|||||
|
I |
|
||||||||
Для воды при 25 °C с учетом численного значения (5.14)
формула (5.15) принимает вид |
|
lg k = lg ko + 1,02× ZA × ZB × I . |
(5.16) |
Из уравнения (5.16) видно, что k экспоненциально зависит от корня квадратного от ионной силы раствора. При этом k
97
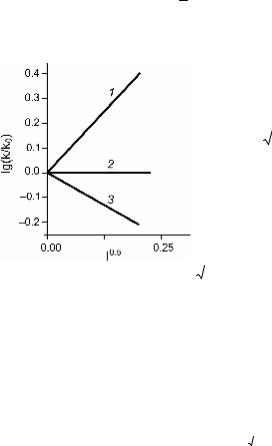
растет при увеличении 
 I для реакций между одноименно заряженными ионами и уменьшается для реакций между раз- ноименно заряженными ионами.
I для реакций между одноименно заряженными ионами и уменьшается для реакций между раз- ноименно заряженными ионами.
|
|
|
|
|
|
|
|
|
В |
качестве |
примера |
||||
|
|
|
|
|
|
|
|
на рис. 5.6 представлен |
|||||||
|
|
|
|
|
|
|
|
качественный |
вид |
за- |
|||||
|
|
|
|
|
|
|
|
висимостей |
lg k / ko |
от |
|||||
|
|
|
|
|
|
|
|
|
|
|
для реакций гидра- |
||||
|
|
|
|
|
|
|
|
|
I |
|
|||||
|
|
|
|
|
|
|
|
тированного |
электрона |
||||||
|
|
|
|
|
|
|
|
с ионами |
KFe(CN)2- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
(прямая 1), молеку- |
|||||||
|
|
|
|
|
|
|
|
лами O2 и H2O2 (пря- |
|||||||
|
|
|
|
|
|
|
|
мая 2) и ионами H3O+ |
|||||||
|
|
|
|
|
|
|
|
(прямая 3). |
|
|
|
||||
Рис. 5.6. Зависимости lgk / ko |
|
|
|
|
|
|
Этими данными, |
в |
|||||||
от I |
для |
|
|
||||||||||||
|
частности, |
доказано, |
|||||||||||||
реакций гидратированного электрона: |
|
||||||||||||||
|
что |
реагирующая час- |
|||||||||||||
1) eaq− + KFe(CN)62− |
¾¾® KFe(CN)36 |
− ; |
|
||||||||||||
|
тица |
имеет |
заряд |
||||||||||||
− |
− |
|
|
|
|
|
|
ZA = -1. |
Это |
явилось |
|||||
|
∙ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) eaq + O2 ¾¾® |
O 2 ; |
|
|
|
|
|
|
одним из доказательств |
|||||||
|
∙ |
|
|
|
|
|
|
||||||||
3) eaq− + H3O+ ¾¾® H + H2O |
|
|
реальности |
существо- |
|||||||||||
|
|
|
|
|
|
|
|
вания |
гидратирован- |
||||||
ного электрона как химической частицы. |
|
|
|
|
|
|
|||||||||
Зависимость скорости реакции между ионами |
|
|
|
||||||||||||
|
|
|
×101,02×ZA ×ZB |
|
|
|
|
|
|
||||||
|
W = k |
o |
I |
× C |
A |
× C |
|
|
(5.17) |
||||||
|
|
|
|
|
|
|
|
|
B |
|
|
|
|
||
от концентрации в растворе посторонней соли, меняющей ионную силу, называют первичным солевым эффектом. Эта
зависимость прямо следует из выражения W = k × CA × CB для
W и выражения (5.16) для k.
Вторичным солевым эффектом называют влияние ионной силы на скорость реакции, оказываемое не непосредственно, а через сдвиг равновесия, изменяющий концентрацию одного из реагентов.
Например, при диссоциации слабого электролита
98

HA ¾¾® H+ + A− ,
такого как уксусная кислота CH3COOH, константа равновесия
диссоциации имеет вид
|
C |
A |
− C |
+ |
|
|
|
|
C2 − |
|
|
|
|
K = |
|
H |
|
× f |
A |
− × f |
+ » |
A |
× f |
A |
− × f |
+ . |
|
|
|
|
|
|
|||||||||
|
|
aHA |
|
|
H |
|
aHA |
|
H |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
Выражая коэффициенты активности fA− и fH+ через фор- мулу (5.12), получаем, что
CA− » 100,5
 I ×
I × 
 K × aHA .
K × aHA .
При добавлении посторонней соли CA− будет расти пропор-
ционально 100,5
 I . При этом будет расти скорость реакции и с участием частицы A− .
I . При этом будет расти скорость реакции и с участием частицы A− .
Г. Роль диэлектрической постоянной
В тех случаях, когда ионная сила раствора близка к нулю, главным фактором, влияющим на коэффициенты активности реагентов и активированного комплекса, становится диэлек- трическая постоянная среды e.
Если рассматривать реагирующую частицу, например A, как шар радиуса rA, имеющий заряд ZA, то электростатическая энергия этого шара в среде с диэлектрической постоянной e
равняется
|
Z2 |
× e2 |
|
Uε = |
A |
|
. |
2 e ×r |
|||
|
|
A |
|
Чтобы перенести этот шар из вакуума с ε = 1 в среду, надо
совершить работу |
|
|
|
|
|
|
|
DA = Uε - Uε= |
= |
Z2 |
× e2 |
æ |
1 |
ö |
|
A |
|
× ç |
|
|
-1÷ . |
||
1 |
2 rA |
è e |
ø |
||||
|
|
||||||
Отсюда получаем выражение для коэффициента активности частицы в растворе:
|
DA |
|
Z2 |
× e2 |
æ |
1 |
ö |
|
ln fA = |
|
= |
A |
|
× ç |
|
|
- 1÷ . |
RT |
2 rAkБT |
|
|
|||||
|
|
è e |
ø |
|||||
99

В последней формуле в знаменателе правой части стоит кон- станта Больцмана kБ , а не газовая постоянная R, так как ве-
личина DA рассчитана нами для переноса одной молекулы,
а не одного моля. Если мы найдем аналогичным способом |
||||||||||||||||||||
величины ln f и ln f ¹ , то получим, что для реакции |
|
|||||||||||||||||||
B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
AZA + AZB |
|
|
|
|
|
|
|
[A ···· B]¹ (ZA +ZB ) ¾¾® P(ZA +ZB ) |
||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
||||||||||||||||
логарифм константы скорости равняется |
|
|
|
|
||||||||||||||||
|
|
|
ln k = ln ko + ln |
fAfB |
= |
|
|
|
|
|||||||||||
|
|
|
¹ |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
f |
|
|
|
|
|
|
ù . |
|
e2 |
æ 1 |
ö |
éZ2 |
Z2 |
(Z |
A |
+ Z )2 |
||||||||||||
= ln ko + |
|
|
|
|
× ç |
|
|
- 1÷ |
× ê |
A |
+ |
|
B |
- |
|
B |
ú |
|||
2 KБT |
|
|
|
|
|
|
r¹ |
|||||||||||||
|
è e |
ø |
ë rA |
rB |
|
|
û |
|||||||||||||
Впоследнем выражении ko – константа скорости в среде с
ε= 1, r¹ – радиус активированного комплекса.
Для оценки положим r¹ » rA » rB = r . |
Тогда получим, что |
||||||||||||||||
|
|
e2 |
|
2 Z |
Z |
æ |
|
1 |
ö |
|
|
||||||
ln k = ln ko + |
|
|
|
|
× |
|
|
|
A B |
×ç1 |
- |
|
÷ |
= |
|
||
2 KБT |
|
|
|
|
|
e |
|
||||||||||
|
|
|
|
r |
|
|
è |
|
ø |
. |
(5.18) |
||||||
|
|
|
e2 |
|
|
Z |
|
Z |
|
|
e -1 |
|
|
||||
= ln ko + |
|
× |
|
A |
B |
× |
|
|
|
|
|||||||
|
KБT |
|
|
r |
|
e |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Таким образом, в зависимости от относительного знака за-
рядов реагирующих частиц константа скорости может как увеличиваться, так и уменьшаться с ростом e. При этом для одноименно заряженных частиц k растет, а для разноименно заряженных падает с ростом e. Аналогичные, но более сла- бые эффекты наблюдаются для электронейтральных частиц, обладающих электрическим дипольным моментом.
100
Лекции по химической кинетике
Ч. 2
Подписано в печать |
|
Формат 60х84/16 |
||
Печать офсетная. |
|
Уч.-изд.л. |
|
|
Тираж |
экз. |
Заказ № |
Цена |
р. |
Редакционно-издательский отдел Новосибирского университета; участок оперативной полиграфии НГУ; 630090, Новосибирск-90, ул. Пирогова, 2.
Компьютерная верстка Н. А. Чистякова
