
- •Национальный исследовательский ядерный университет «мифи»
- •Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объёму вытесненного водорода
- •Методика выполнения работы
- •Контрольные вопросы.
- •Лабораторная работа №2 Зависимость свойств элементов от положения в периодической системе д.И.Менделеева
- •Выполнение работы
- •Лабораторная работа №4 Гидролиз солей
Министерство образования и науки Российской Федерации
Федеральное государственное автономное образовательное учреждение
высшего профессионального образования
Национальный исследовательский ядерный университет «мифи»
Волгодонский инженерно-технический институт
ФАКУЛЬТЕТ ____________________
КАФЕДРА ____________________
СПЕЦИАЛЬНОСТЬ ____________________
ОТЧЁТ
по лабораторным работам по общей химии
Студента________________________________________________
(группа, курс) (фамилия, имя, отчество)
Принял преподаватель______________________________________
(фамилия, имя, отчество)
______________________________________
(дата) (подпись)
Волгодонск 2015 г.
Лабораторная работа №1 определение молярной массы эквивалента (эквивалентной массы) металла по объёму вытесненного водорода
Ц е л ь р а б о т ы: Ознакомиться с методикой определения и расчёта молярной массы эквивалента металлов.
О б о р у д о в а н и е и м а т е р и а л ы: штатив, две бюретки на 50 см3, пробирка с газоотводной трубкой, термометр, барометр, аналитические весы и разновесы; навеска металла около 0,01 г; 2,5 М раствор НС1.
Методика выполнения работы
По объёму вытесненного водорода можно определить молярные массы эквивалентов активных металлов (магния, алюминия, цинка и т.д.), способных вытеснять водород из разбавленных кислот.
Прибор для определения молярной массы эквивалента металлов изображён на рис. 1.1. и состоит из:

2) реакционной пробирки;
3) газоотводной трубки;
4) штатива.
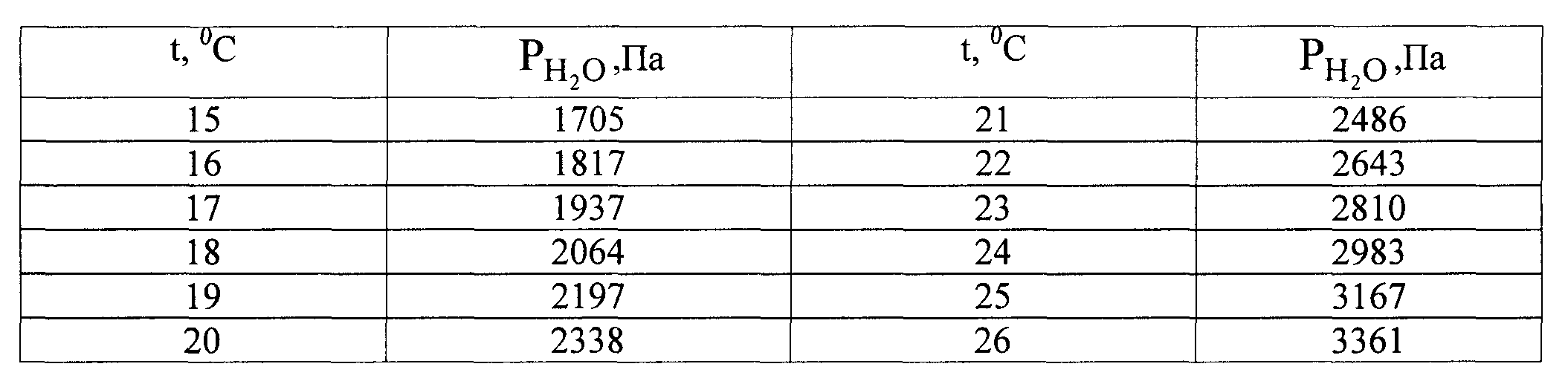
Налить в пробирку 4-5 см3 2,5 М раствора хлористоводородной кислоты, 5 капель раствора Со(NO3)2 – катализатора. Навеску металла количественно перенести в пробирку c кислотой, которую плотно присоединить к прибору. Тотчас начинается выделение водорода и вода вытесняется из правой бюретки в левую. Пока идёт реакция, записать показания барометра и термометра; по табл. 1 определить давление насыщенных паров воды.Когда весь металл растворится, прекратится понижение уровня воды в бюретке. Окончательный точный отсчёт показаний бюретки производится после охлаждения пробирки до комнатной температуры (через 3-5мин.).
Результаты измерений записывают по форме:
Масса металла, m=..., г
Показания бюретки до проведения реакции V1=..., см3
Показания бюретки после реакции V2=..., см3
Объём выделившегося водорода VH2 =V2 – V1=..., см3
Температура окружающей среды t=..., ° С; Т=273 +t= ..., К
Атмосферное давление Р=..., Па
Давление
насыщенных паров воды
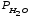 =
...,
Па
=
...,
Па
Парциальное
давление водорода
 =
=
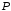 -
-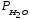 =
..., Па
=
..., Па
Объём выделившегося водорода приводят к нормальным условиям на основании уравнения состояния идеального газа, объединяющего законы Бойля-Мариотта и Гей-Люссака:

где
P0
-
нормальное
давление, равное 101325 Па; Vo
- объём газа при нормальных условиях,
см3;
То - 273 К;
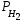 -
парциальное давление сухого водорода;
-
парциальное давление сухого водорода; -
объём газа в условиях опыта; Т - температура
опыта по абсолютной шкале температур.
-
объём газа в условиях опыта; Т - температура
опыта по абсолютной шкале температур.
Таким образом, объём водорода, приведённый к нормальным условиям, определяется по уравнению:
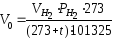 ;
;
По закону эквивалентов в случае, когда одно из реагирующих веществ находится в твёрдом состоянии, а второе - в газообразном, молярная масса эквивалента металла определяется по формуле:

где
m
- масса металла; МЭоп
- молярная масса эквивалента металла;
Vo
-объём газа, приведённый к нормальным
условиям; Vэ
-
молярный объём эквивалента газа.
Молярный
объём эквивалента водорода, составляющий
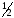 объёма его моля, занимает при нормальных
условиях 11200 см3/моль.
объёма его моля, занимает при нормальных
условиях 11200 см3/моль.
Таблица 1.
Давление насыщенного водяного пара в равновесии с водой
Затем студенты вычисляют теоретическую величину молярной массы эквивалента металла и находят относительную ошибку определения:
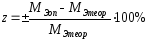
В конце работы записываются выводы.
Общий вывод по работе:
|
|
| ||
|
|
| ||
|
|
| ||
|
|
| ||
|
Работу выполнил Студент группы
|
Работу принял Преподаватель |
Дата | |
