
- •Материалы для лекции строение и свойства металлов. Фазовые превращения строение и свойства металлов. Фазовые превращения
- •3. Диаграммы состояния
- •1 Диаграммы состояния с неограниченной растворимостью компонентов в жидком и твердом состояниях
- •2 Диаграммы состояния сплавов, имеющих структуру механической смеси.
- •3 Диаграмма состояния сплавов для случая ограниченной взаимной растворимости компонентов в твердом состоянии и образования эвтектики
- •2.6. Связь между свойствами сплавов и типом диаграммы состояния
- •5.9.1. Строительные стали
- •3.1. Железо и его соединения с углеродом
- •3.2. Компоненты, фазы, линии и точки диаграммы (fe – Fe3c)
- •3.3. Превращения, происходящие при нагреве и охлаждении сталей и чугунов
1 Диаграммы состояния с неограниченной растворимостью компонентов в жидком и твердом состояниях
Простейший вид диаграмма состояния имеет в том случае, когда вещества обладают неограниченной растворимостью как в жидкой, так и в твердой фазе. Таким свойством обладают системы Cu-Ni ; Ag-Au; Вi-Sb и др. Диаграмма состояния таких сплавов (типа сигары) приведена на рис. 1, где по оси ординат нанесены температуры, а по оси абсцисс - концентрации. Линия аNKb называется линией ликвидуса, линия аМLb - линией солидуса. Выше линии ликвидуса имеется однородная жидкость. Ниже линии солидуса - однородный твердый раствор. Заштрихованная область является областью расслоения на жидкую и твердую фазы. При построении кривой охлаждения сплава концентрации С видно, что она имеет две критические точки К и М (рис. 2), соответствующие началу и концу затвердевания соответственно.
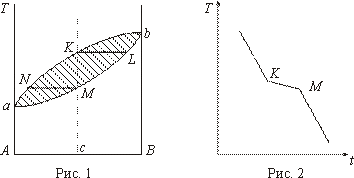
Изменение наклона кривых указывает на наличие температурного интервала, в котором происходит выделение теплоты кристаллизации, в отличие от чистого компонента, у которого выделение теплоты кристаллизации происходит при одной строго определенной температуре.
2 Диаграммы состояния сплавов, имеющих структуру механической смеси.
Компоненты данных сплавов неограниченно растворяются в жидкой фазе и практически не растворимы в твердой. Механические смеси (рис. 5.21). Механические смеси образуются в тех случаях, когда компоненты не способны к химическому взаимодействию и не растворяются один в другом в твердом состоянии. В этом случае оба компонента кристаллизуются в свои системы, но они объединены общими связями, и элементарной кристаллической ячейкой сплава является сложная решетка компонентов А и Б.
.
В том случае, когда вещества обладают неограниченной растворимостью в жидкой фазе и совсем не растворяются друг в друге в твердой (Bi-Cd; Ag-Pb), они образуют диаграмму с наличием эвтектики (рис. 3). На диаграмме точками а и b обозначены температуры затвердевания чистых веществ А и В. Линия аЕb - температуры начала кристаллизации в зависимости от состава смеси (линия ликвидуса). Точка Е, в которой пересекаются обе кривые кристаллизации, называется эвтектической точкой, а кристаллы, выделяющиеся в ней, называются эвтектикой. Эвтектика представляет собой мелкодисперсную смесь кристаллов чистых компонент.

рис. 3
3 Диаграмма состояния сплавов для случая ограниченной взаимной растворимости компонентов в твердом состоянии и образования эвтектики
И, наконец, вещества, обладающие неограниченной растворимостью в жидкой и частичной растворимостью в твердой фазе, образуют диаграмму, представленную на рис. 4.
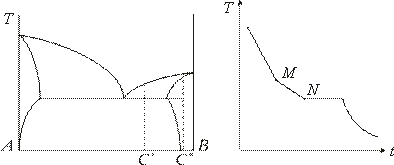 рис.4
рис.5
рис.4
рис.5
К
таким комбинациям относятся Рb-Bi; Bi-Sn;
Pb-Sb. Для других комбинаций веществ вид
диаграмм состояния может быть значительно
сложнее. Рассмотрим процесс затвердевания
сплава концентрации
![]() веществ,
дающих чисто эвтектическую диаграмму
состояния (рис. 3). Кривая
веществ,
дающих чисто эвтектическую диаграмму
состояния (рис. 3). Кривая![]() ,
есть кривая изменения температуры
начала кристаллизации вещества А в
зависимости от его концентрации в
расплаве. Поэтому ордината точки М есть
температура
,
есть кривая изменения температуры
начала кристаллизации вещества А в
зависимости от его концентрации в
расплаве. Поэтому ордината точки М есть
температура![]() ,
при которой из данного расплава начинают
выделяться кристаллы вещества А в чистом
виде. По мере выпадения кристаллов А
расплав становится богаче веществом
В, а следовательно выделение кристаллов
А должно происходить при более низкой
температуре, чем
,
при которой из данного расплава начинают
выделяться кристаллы вещества А в чистом
виде. По мере выпадения кристаллов А
расплав становится богаче веществом
В, а следовательно выделение кристаллов
А должно происходить при более низкой
температуре, чем![]() ;
действительно, одновременно с
кристаллизацией вещества А температура
расплава понижается. Когда температура
расплава достигнет эвтектической
температуры (точка N), а концентрация
сплава, соответственно концентрации
эвтектического сплава (
;
действительно, одновременно с
кристаллизацией вещества А температура
расплава понижается. Когда температура
расплава достигнет эвтектической
температуры (точка N), а концентрация
сплава, соответственно концентрации
эвтектического сплава (![]() ),
начинается затвердевание эвтектики. В
процессе затвердевания сплава
эвтектической концентрации температура
не изменяется. Кривая зависимости
температуры охлаждающегося расплава
концентрации
),
начинается затвердевание эвтектики. В
процессе затвердевания сплава
эвтектической концентрации температура
не изменяется. Кривая зависимости
температуры охлаждающегося расплава
концентрации![]() от
времени представлена на рис.5.
от
времени представлена на рис.5.
 рис.6
рис.7
рис.6
рис.7
Таким
образом, кристаллизация сплава начинается
при температуре тем более низкой, чем
ближе концентрация сплава к эвтектической,
и заканчивается при эвтектической
температуре. На основании сказанного
видно, что для веществ, имеющих чисто
эвтектическую диаграмму состояния,
линией солидуса является линия KNEL
(рис.3). Для веществ с ограниченной
растворимостью кривые охлаждения
сплавов концентраций![]() и
и![]() (см.
рис. 4) представлены, на рис.6. Цель работы
состоит в построении диаграммы состояния
системы Pb-Sn и определении эвтектической
точки. Хотя диаграмма состояния сплава
Pb-Sn и не принадлежит к числу чисто
эвтектических (эти вещества обладают
небольшой взаимной растворимостью,
диаграмма типа рис.4), рабочие концентрации
выбраны так, что построение диаграммы
для простоты можно вести так же, как и
эвтектической.
(см.
рис. 4) представлены, на рис.6. Цель работы
состоит в построении диаграммы состояния
системы Pb-Sn и определении эвтектической
точки. Хотя диаграмма состояния сплава
Pb-Sn и не принадлежит к числу чисто
эвтектических (эти вещества обладают
небольшой взаимной растворимостью,
диаграмма типа рис.4), рабочие концентрации
выбраны так, что построение диаграммы
для простоты можно вести так же, как и
эвтектической.
