
Пустов Ю.А., Ракоч А.Г.- Диагностика и экспертиза коррозионных разрушений металлов - Курс Лекций
.pdfлегированием стабилизирующими (карбидообразующими) элементами – титаном,
ниобием, или танталом.
Молибден
Молибден заметно усиливает склонность высокохромистых и хромоникелевых сплавов к самопассивации, повышает их коррозионную стойкость в неокислительных и слабоокислительных средах и благоприятно влияет на стойкость к МКК. Считают, что причиной повышения устойчивости к МКК является способность молибдена входить в состав сложных карбидов, частично замещая в них хром, повышая тем самым концентрацию твердого раствора хрома в приграничной зоне. Вместе с тем, в
окислительных и сильно окислительных средах молибден вызывает уменьшение стойкости сталей против МКК, поскольку обогащенные молибденом карбиды,
промежуточные σ-фазы (Fe-Cr-Mo) или сегрегации молибдена обладают в этих средах низкой коррозионной стойкостью. В присутствии молибдена возможно также образование химически нестойких χ-фазы (Fe36Cr12Mo10) и η-фазы (Fe2Mo).
Кремний
Кремний двойственно влияет на стойкость закаленных аустенитных сталей к МКК.
При испытаниях в сильно окислительных средах в сталях с пониженным содержанием углерода (порядка 0,03 %) увеличение концентрации кремния от 0,14 до 0,8 %
увеличивает на порядок глубину проникновения МКК в закаленном состоянии.
Установлено, что в закаленной стали повышение содержания кремния повышает энергетический уровень граничных зон за счет более напряженных границ и более высокой плотности дислокаций в приграничной области. Еще в большей степени негативное влияние примесного (технологического) кремния проявляется в сенсибилизированных сталях (отпуск при 650°С): кремний изменяет структуру и химический состав, способствует выделению по границам зерен карбидной фазы Ме23С6,
нестойкой в окислительной среде.
Вместе с тем, в слабоокислительных средах технологическая добавка кремния (т.е. ≤0,8 %) практически не влияет на склонность к МКК, что связывают с повышением термодинамической активности углерода в присутствии кремния.
Если в стали содержится от 3 до 5 % кремния, то ее коррозионная стойкость резко повышается вследствие образования защитных пассивных пленок.
Фосфор
41
В связи с низкой растворимостью в аустените фосфор образует сегрегации по границам зерен и значительно усиливает чувствительность закаленных сталей к МКК в сильноокислительных средах. В процессе отпуска фосфор оказывает влияние на карбидообразование, сам образует избыточные фазы виде дисперсных карбофосфидов Ме23(С, Р)6, причем их выделение происходит с более высокой скоростью по сравнению с простыми карбидами типа Ме23С6 в сталях, не содержащих фосфора.
Бор
Бор является технологической примесью в коррозионностойких сталях, вводится в
количестве ~ 0,001…0,006 % для повышения способности сталей к горячей пластической деформации. Существенное влияние бора на чувствительность к МКК связано с изменением структуры стали как в закаленном, так и отпущенном состояниях.
Бор, также как и фосфор, обладает ограниченной растворимостью в аустените.
Поэтому даже при высокотемпературных нагревах бор присутствует в виде сегрегаций на границах зерен. Так, в стали Х18Н11, содержащей 0,002…0,006 % бора, его переход в твердый раствор наблюдается только при температуре выше 1300°С. В процессе отпуска бор замедляет выделение карбидов, σ-фазы и других интерметаллидов и предупреждает образование пограничных выделений. Бор повышает температуру начала выделения и растворения карбидов.
Азот
Азот является сопутствующим элементом в коррозионностойких сталях,
получаемых методом открытой плавки, и всегда присутствует в пределах ≤0,05 %. Иногда азот сознательно вводят в состав сталей с целью частичной замены никеля и для повышения прочностных свойств. Поскольку, как правило, азот присутствует в сталях вместе с углеродом, рассматривается их совместное влияние на склонность к МКК.
При отпуске азотсодержащих сталей происходит выделение нитридов хрома,
которые также как и карбиды хрома вызывают склонность к МКК. Однако скорость их образования ниже, чем карбидов хрома.
Влияние азота становится наиболее заметным при его концентрации ≥0,2 %, когда дальнейшее увеличение его содержания приводит к увеличению чувствительности сталей к МКК тем в большей степени, чем больше азота. Закономерности влияния азота и углерода на основные параметры МКК – Тmax, Tкр, τкр аналогичны. Несмотря на то, что увеличение содержания азота вызывает сдвиг области проявления МКК в сторону более высоких температур, глубина проникновения МКК вследствие образования нитридов
42
ниже, чем при образовании карбидов хрома. При равном содержании углерода и азота на образование нитридов расходуется меньше хрома, чем на образование карбидов, что вызывает меньшее обеднение приграничного аустенита растворенным хромом.
В коррозионностойких сталях, стабилизированных титаном, азот увеличивает склонность к МКК по причине связывания части титана в нитриды, что вызывает необходимость увеличения концентрации титана.
Титан, ниобий, тантал
Титан, ниобий и тантал – эффективные карбидообразующие элементы, вводимые в
состав коррозионностойких сталей для связывания углерода и предотвращения образования карбидов хрома. Чаще всего используются титан и ниобий. Необходимое для предотвращения МКК содержание этих элементов зависит от состава стали, режимов термической обработки и условий эксплуатации. Но соотношение концентраций между ними и углеродом устанавливается в соответствии со стехиометрической формулой соответствующих карбидов. Так, для полного связывания углерода рекомендуется вводить титан в 5-кратном, ниобий – 8…11-кратном, а тантал – в 20-ти и более кратном количестве по отношению к углероду.
Образующиеся при этом специальные карбиды TiC и NbC являются растворимыми, растворимость их зависит от степени стабилизации, но температура их растворения выше температуры растворения карбидов хрома. Несмотря на то, что температурные интервалы проявления склонности к МКК нестабилизированных и стабилизованных карбидообразующими элементами сталей близки, при длительной выдержке у стабилизированных сталей склонность к МКК исчезает. Причиной этого то,
что в этих сталях на начальных стадиях отпуска из-за замедленной диффузии титана и ниобия образуется не специальные карбиды TiC и NbC, а некоторое количество карбидов типа Me23C6 {Cr23C6 и/или (Fe,Cr)23C6}. При дальнейшей выдержке образуются TiC или
NbC, равновесие твердофазной реакции [Cr]+[C]↔Cr23C6 смещается влево, что сопровождается растворением хрома в аустените и устранением обеднения хромом приграничных областей.
Для предотвращения МКК в окислительных средах для стабилизации сталей используют только ниобий, поскольку в этих условиях TiC неустойчив. Ниобий также более предпочтителен в азотсодержащих сталях, так как он менее склонен к образованию нитридов, чем титан.
43
Термообработка
Параметры МКК зависят от размера зерен. Тем выше температура закалки, тем больше размер зерен и тем меньше протяженность их границ. Поэтому в крупнозернистой стали количество карбидов на единицу поверхности границы выше, чем в мелкозернистой. Повышаются Тmax, Tкр и уменьшается τкр, увеличивается глубина проникновения МКК, т.е происходят такие же изменения, как при увеличении содержания углерода.
Для большинства аустенитных сталей склонность к МКК устраняется нагревом в области температур 1020…1060ºС, обеспечивающим полное растворение карбидов и уменьшение влияния сегрегирующих в области границ зерен примесей, и последующей быстрой закалкой (в воде или на воздухе).
Склонность к МКК может также быть понижена стабилизирующим отжигом в течение 2…4 часов в интервале температур 850…950ºС. Такой отжиг наиболее эффективен в сталях, легированных титаном и ниобием. В процессе его проведения происходит полное связывание углерода стабилизирующими добавками (Ti, Nb) и
образование крупных разобщенных (не связанных друг с другом) карбидов хрома в основном в теле зерна. Последующий провоцирующий нагрев (отжиг при более низких температурах) не приводит к образованию карбидов по границам зерен, поэтому склонность к МКК отсутствует.
6.2.Питтинговая коррозия
6.2.1.Определение питтинговой коррозии. Диагностические признаки, основные понятия и термины. Причины и условия возникновения
Питтинговая (точечная) коррозия (ПК) − образование в металле коррозионных язвенных полостей (питтингов), начинающееся с его поверхности. Питтинговой коррозии подвергаются углеродистые и нержавеющие стали, сплавы на основе алюминия, никеля,
титана и других металлов и сплавов, находящихся в пассивном состоянии в средах,
содержащих стимулирующие ПК ионы Cl-, Br-, J-, SO42 и др. (морская вода, соляная кислота, смеси соляной и азотной кислоты и т.п.).
Диагностические признаки ПК:
разрушение металла (сплава) сосредоточено в отдельных точках запассивированной поверхности;
44
материальный эффект коррозии (потери массы) практически полностью обусловлен растворением металла (сплава) в локальных участках поверхности
(питтингах);
при слиянии нескольких точек (питтингов) и относительно небольшой их глубине наблюдается язвенная коррозия;
при внешне незначительном поражении поверхности возможно возникновение сквозного питтинга (перфорация)
В зависимости от условий формирования и развития (температура, кислотность,
химический состав раствора) форма питтингов может быть различной: полусферические,
цилиндрические, полиэдрические, открытые, закрытые и т.д.
Полусферическую форму имеют так называемые полированные питтинги. Они имеют блестящую внутреннюю поверхность, что указывает на изотропное, не зависящее от структуры растворение, близкое по механизму к электрополировке. Такие питтинги возникают на железе, нержавеющих сталях, алюминии, тантале, сплавах на основе никеля,
титана кобальта.
Ограненные (кристаллографические) питтинги и питтинги неправильной формы
(анизотропно растущие в различно ориентированных зернах металла), как правило,
являются травленными. Они обнаруживаются на железе, углеродистых,
низколегированных и нержавеющих сталях, никеле, алюминии, цинке, хроме. Форма таких питтингов соответствует правильным пирамидам, призмам и сложным многогранникам. Тип огранки определяется пустотами кристаллической решетки,
образовавшимися на начальных стадиях зарождения питтингов.
В результате слияния множества мелких кристаллографических питтингов формируются крупные (полусферические) питтинги.
Питтинги характеризуются не только формой, но и видом. Характерные виды питтингов представлены на рисунке 6.4.
45
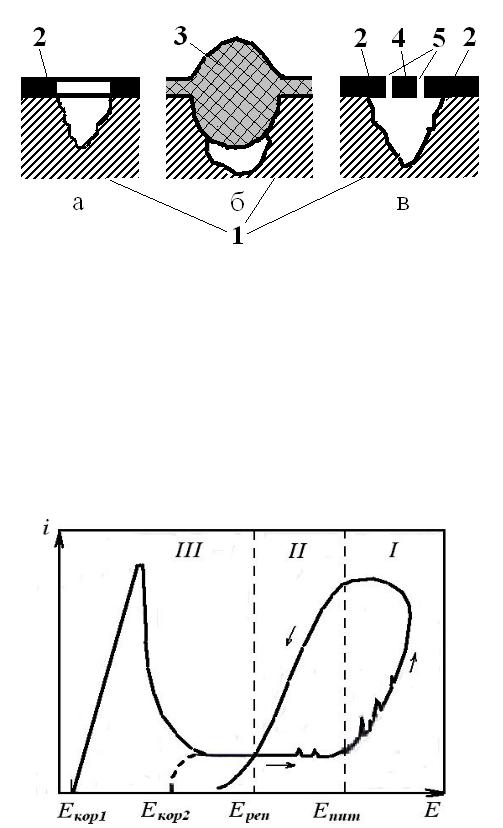
Рис. 6.4. Характерные виды питтингов: а – открытый, с защитным слоем на окружающей поверхности; б – закрытый, без окружающего защитного слоя; в – закрытый с окружающим защитным слоем; 1 – металл; 2 – защитный слой; 3 – пористые продукты коррозии и отложения; 4 – крышка над питтингом; 5 – отверстия в крышке.
Основные понятия и термины
Потенциал питтингообразования Епит (потенциал пробоя, критический потенциал
питтинговой коррозии, потенциал активирования) – минимальное значение потенциала,
при котором возникает ПК (устойчиво возрастает плотность тока на поляризационной
кривой при увеличении потенциала Е >Епит (рис. 6.5)
Рис.6.5. Потенциалы в области ПК на потенциодинамической кривой коррозионностойких сталей: Екор1 и Екор2 – потенциалы коррозии в кислых и нейтральных средах соответственно; Епит – потенциал питтингообразования; Ереп – потенциал репассивации; I – питтинг зарождается и развивается; II – новые питтинги не возникают, продолжают расти питтинги, возникшие в области I; III – полностью подавлен рост старых питтингов.
46
Потенциал репассивации Ереп (иногда защитный потенциал ПК Езащ) – потенциал прекращения работы питтингов, возникших при Е > Епит (плотность тока на поляризационной кривой обратного хода становится равной плотности тока пассивного состояния.
Потенциал ингибирования Еинг – потенциал (положительнее Епит), при котором подавляется ПК, возникшая при Е > Епит (плотность тока возвращается к плотности тока пассивного состояния). Наблюдается в средах, содержащих эффективные ингибиторы ПК
(нитрат-ионы).
Критическая плотность тока в гальваностатическом режиме iкр – минимальная плотность тока заряжения, вызывающая ПК.
Активирующие анионы – анионы, вызывающие при определенных условиях ПК
(анионы Cl¯, Br¯, I¯, CNS¯, ClO4¯)
Критическая (минимальная) концентрация аниона-активатора Скр в конкретных условиях, ниже которой ПК не возникает.
Ингибиторы ПК – анионы, присутствие которых в среде вызывает подавление и предотвращение ПК:
NO 3 , SO42 ,OH ,CO32 ,ClO 3 , PO 43
Защитная концентрация ингибитора – минимальная концентрация,
обеспечивающая предотвращение ПК.
Критическая температура питтингообразования (КТП) – температура, ниже которой ПК не проявляется.
Индукционный период (время) питтингообразования, τинд – временной интервал с момента обеспечения необходимых условий ПК до появления первого питтинга.
Коэффициент питтингообразования Кпит – отношение средней глубины всех питтингов к условной глубине коррозии, рассчитанной из потерь массы, при допущении,
что коррозия носит равномерный характер.
Эквивалент питтингостойкости ПК (ЭСП) – сумма содержания в стали хрома,
молибдена и азота с учетом их вклада в повышение стойкости против ПК; ЭСП= %Cr+3,3(% Mo)+16(%N).
Для возникновения и протекания ПК необходимы следующие условия:
47
пассивирующая среда, обеспечивающая нахождение металла в пассивном состоянии;
наличие в растворе аниона-активатора в количестве, превышающем
(минимальную) критическую концентрацию;
наличие в растворе окислителя, способного сместить потенциал коррозии положительнее потенциала питтингообразования Епит (или за счет внешней анодной поляризации)
наличие дефектов пассивирующей пленки, вызываемых структурными и фазовыми неоднородностями металла, сульфидными и оксисульфидными включениями,
сегрегациями примесей, скоплениями дислокаций и вакансий;
электрический контакт с более благородными металлами и наличие зазоров
ищелей повышают вероятность возникновения ПК:
- контакт с благородным металлом может сместить потенциал коррозии до значений, превышающих Епит;
- щели создают возможность накопления продуктов коррозии, повышает кислотность среды, затрудняет доступ пассиватора (кислорода), т.е. создают условия для понижения Епит.
6.2.2.Механизмы питтинговой коррозии
Внастоящее время не существует ни одной теории ПК, однозначно объясняющей влияние различных внешних и внутренних фактов (в основном роли легирующих элементов), а также стадийности возникновения и развития питтингов.
Выделяют следующие основные стадии распространения ПК:
1− процессы, вызывающие нарушение пассивности; наблюдаются изменения в пассивной пленке, но питтинги еще не обнаруживаются (ни по величине тока, ни металлографически);
2− начальный этап роста питтингов; наблюдается непрерывный рост тока,
появляются первые питтинги микрометрических размеров.
3 − поздний этап роста питтингов; обнаруживается осаждение солевых пленок и большое падение потенциала.
4 − репассивация питтингов; наступает (если она возможна) после стадии 2 и
характеризуется возвратом к пассивному состоянию и токам пассивности; бывший питтинг становится подобным остальной части пассивной поверхности.
5 − стабильный рост питтинга.
48

Нарушение пассивного состояния, как необходимая часть теории ПК, описывается
восновном тремя механизмами.
I. Проникновение аниона путем миграции через оксидную пленку к границе Ме/MemOn под действием электрического поля высокой напряженности до 108 В/м
(потенциал запассивированной поверхности составляет порядка 1 В, толщина пассивной пленки – порядка 10 нм).
II. Разрушение пленки происходит под влиянием электрострикции, вызванной адсорбцией хлорид-ионов. Механическое разрушение пассивной пленки приводит к обнажению поверхности, которая подвергается воздействию электролита.
III. Адсорбция аниона на поверхности пассивирующего оксида. Анионы образуют поверхностные комплексы с металлическими ионами. Облегчается переход ионов металла в электролит, толщина пассивной пленки уменьшается. Увеличивается напряженность электрического поля внутри оксидного слоя, что способствует увеличению скорости миграции металлических ионов.
Растворение металла в общем виде идет по реакции: Me → Men+ + ne. Далее гидролиз, вызывающий подкисление среды: Men+ + H2O → Me(OH)(n-1)+ + H+.
Поверхность питтинга в независимости от механизма развития ПК является анодом по отношению к остальной (запассивированной) части поверхности металла, являющейся по причине ее относительно большой площади практически неполяризуемым катодом, что обеспечивает высокую скорость растворения металла в питтинге. Считается, что в питтинге сохраняется электрохимический потенциал активной области и металл растворяется в активном состоянии. Однако предположение об активном анодном процессе в питтинге не позволяет объяснить возможность репассивации питтинга при смещении потенциала в область менее положительных значений, т.е. в области пассивности, что часто наблюдается на практике. Растворение в питтинге происходит в области потенциалов Епит, т.е. более положительных, чем критический потенциал пассивации и потенциал полной пассивности. Увеличение скорости растворения в питтинге по сравнению со скоростью растворения металла в пассивном состоянии связано со значительным повышением концентрации активирующих анионов и подкисления раствора. Активирующие анионы в области питтингообразования изменяют характер процесса анодного растворения по сравнению с обычной активной областью из-за изменения роли растворителя – воды. В активной области вода, наряду с активирующим действием, вследствие адсорбции ее молекул и анионов ОН¯ проявляет и пассивирующее действие. При потенциалах Е ≥Епит из-за адсорбции на поверхности питтинга большого
49
количества активирующих анионов (например, Cl¯) молекулы воды вытесняются ими и пассивация растущего питтинга становится невозможной.
При снятии поляризационных поляризационных кривых в пассивной области перед достижением Епит иногда наблюдаются колебания тока, которые можно рассматривать как результат конкурирующей адсорбции галогенид-ионов и ионов ОН¯ на запассивированной поверхности. Галогенид-ионы, адсорбируясь на поверхности, могут замещать ионы ОН¯ или связанную воду, образуя поверхностные комплексы Ме-галоген.
Такой комплекс может перейти в раствор, а образующаяся отрицательно заряженная катионная вакансия в структуре пассивной (оксидной) пленки вызывает перенос вещества и зарядов, что компенсирует нарушение пассивности. Именно переносом зарядов и обусловлено протекание тока при растворении пассивной пленки.
Установлено, что на стадии «предпиттингообразования» пассивная пленка очень чувствительна к малейшим изменениям ее состава, а ее стабильность зависит от степени разупорядоченности структуры. Таким образом, флуктуации тока в области пассивности вблизи потенциала питтингообразования могут быть вызваны степенью нестационарности пассивной пленки в присутствии галогенид-ионов. Локальное снижение стойкости пассивной пленки может быть также связано с понижением концентрации основного (Cr в
коррозионностойких сталях) или дополнительных легирующих компонентов (Si, Mo и
др.).
На стадии «предпиттинга» нет заметных изменений концентрации электролита и омических падений потенциала вблизи этих участков. Питтинг еще не имеет характерной полусферической формы, а представляет собой ямку растворившегося кристаллита.
После растворения дефектного участка запассивированной поверхности развитие питтинга переходит во вторую фазу, когда его устойчивое состояние поддерживается различием в составах коррозионной среды в питтинге и во внешней среде. Если концентрация ионов Cl¯ и Н+ в питтинге и объеме электролита отличаются незначительно,
то способность к пассивации этого участка еще сохраняется. По мере развития коррозионного процесса в питтинге концентрация ионов Cl¯ в нем возрастает, а гидролиз вызывает увеличение кислотности.
При отсутствии благоприятных условий для репассивации питтинга (уменьшение окислительной способности среды, внешняя катодная поляризация, переход в раствор ионов легирующих добавок (Mo, Si, W,V) в виде оксоанионов типа MeO42 ,
осаждающихся в объеме питтинга и вытесняющих галогенид-ионы) начинается его стабильный рост, сопровождающийся дальнейшим повышением агрессивности среды в питтинге.
50
