
Математическое моделирование / Arz_(2010)_Mathematical_&_Computer_Modelling
.pdfНа рис. 2.93−2.94 показаны зависимости концентраций биомассы и удельной продуктивности реактора от величины удельного разбавления при различных начальных концентрациях S0. При малых значениях удельного разбавления 0 < D < 0,175 ч−1 значения концентраций биомассы, рассчитанной по разным моделям, практически совпадают (рис. 2.93). Различия X становятся существенными, при значениях удельного разбавления 0,175 < D < 0,25 ч−1, соответствующих максимальной удельной продуктивности (рис. 2.93, 2.94). Отметим, что именно такие режимы, как правило, выбираются в качестве «рабочей точки» биохимического реактора. Зависимости, приведенные на рис. 2.93 не позволяют осуществлять прогноз «точки вымывания», т. е. такого удельного разбавления, при котором концентрация биомассы становится равной нулю. Так, в соответствие с рис. 2.93 a, b такое состояние в заданном диапазоне удельных разбавлений вообще не наблюдается при значениях начальных концентраций субстрата более 0,5 г/л, в то время как при использовании других моделей «точка вымывания» существует при значениях D от 0,21 до 0,226 ч−1. Графики удельных продуктивностей, построенные с помощью различных математических моделей, также несущественно различаются при малых удельных разбавлениях 0 < D < 0,175 ч−1 и существенно различаются при оптимальных D.
Таким образом, из расчетов и анализа данных этого и предыдущих разделов можно сделать следующие выводы:
−с одной стороны показано, что на основе экспериментальных данных не всегда удается осуществить правильный выбор кинетической модели, т. к. отклики полученные по различным уравнениям практически совпадают;
−с другой стороны, расчеты статических режимов работы биохимических реакторов, выполненные по этим моделям, различаются весьма существенно.
В результате расчетов выполненных в настоящем разделе на базе обширного экспериментального материала получены ответы на вопросы, сформулированные в начале.
Показано, что уравнения «типа Моно» удовлетворительно описывают результаты экспериментов лишь при неизменных
190
концентрациях субстратов и биомассы; в этих условиях практически невозможно сделать вывод о преимуществах какой-либо одной из них. Эти модели не позволяют проводить адекватное описание экспериментальных данных при различных начальных концентрациях биомассы и субстрата, изменяющихся в широких диапазонах. Расчеты статических режимов работы биохимических реакторов, выполненные по этим моделям, различаются весьма существенно.
Таким образом, тщательный анализ математических моделей, используемых в настоящее время для описания процессов биосинтеза, позволяет сделать вывод о существенных недостатках и ограниченности такого описания. По этой причине, было бы необходимо осуществлять поиск новой, более стационарной основы для разработки моделей биотехнологических и микробиологических процессов, одновременно учитывающей их стохастичность, различные виды гетерогенностей и фазовых сдвигов на популяционном уровне. Учитывая, что в действительности, базовую роль в большинстве биологических процессов, сопутствующих росту популяции имеют процессы чтения и трансляции информации, записанной в ДНК (РНК), по всей видимости, эти процессы и следует выбрать в качестве базы для построения модели биосинтеза.
2.7. Модели фазовой гетерогенности клеточного цикла1
191

Хорошо известно, что кинетика роста популяций микроорганизмов отличается недостаточной воспроизводимостью в эксперименте, а макрокинетические зависимости – математические модели – низкой адекватностью. Возможными причинами этого могут являться: наличие ненаблюдаемых в эксперименте факторов; недостаточно точное измерение начальных условий; неполное соответствие физико-химических механизмов, используемых в математических моделях, реальным явлениям, что приводит к зависимости их коэффициентов от различных параметров процесса.
По нашему мнению одной из важнейших причин, обуславливающих низкую воспроизводимость кинетических экспериментов является фазовая гетерогенность популяции в начальный момент времени. Этот фактор является практически ненаблюдаемым из-за сложной технологии определения распределений клеток по фазам клеточного цикла. По нашим предварительным
1 Арзамасцев А. А., Андреев А. А. Информационная модель фазовой гетерогенности роста клеток микроорганизмов и их популяций: I. Основные положения // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2001. – Т. 6, вып. 4. – С. 461-463; Арзамасцев А. А., Андреев А.А. Информационная модель фазовой гетерогенности роста клеток микроорганизмов и их популяций: II. Прокариоты // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2001. – Т. 6, вып. 4. – С. 464-466; Арзамасцев А. А., Андреев А. А. Информационная модель фазовой гетерогенности роста клеток микроорганизмов и их популяций: III. Эукариоты // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2001. – Т. 6, вып. 4. – С. 467-471; Арзамасцев А. А., Андреев А. А. Математические модели кинетики микробиологического синтеза: возможности использования и новые подходы к разработке // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2000. – Т. 5, вып. 1. – С. 111; Арзамасцев А. А., Андреев А. А. Математическое моделирование и оптимизация процесса роста микробной популяции на основе фазовой гетерогенности клеточного цикла // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2002. – Т. 7, вып. 2. – С. 303-307; Арзамасцев А. А. Принципы разработки объектно-ориентированной стохастической математической модели фазовой гетерогенности популяций микроорганизмов // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. – Тамбов, 2005. – Т. 10, вып. 1. С. 96; Арзамасцев А. А., Андреев А. А., Вязовова Е. В., Лисицина И. Н., Суспицина М. А. Влияние фазовой гетерогенности клеточного цикла прокариот на кинетику роста их популяции. Результаты вычислительного эксперимента // Вестн. Тамб. ун-та. Сер. Естеств. и техн. науки. –
Тамбов, 2005. – Т. 10, вып. 3. С. 292-301.
192
данным не принятие во внимание этого фактора может приводить к различиям кинетических зависимостей порядка 20–30 %.
Целью данного раздела является проведение вычислительных экспериментов, позволяющих выполнить оценки существенности влияния фазовой гетерогенности на кинетику роста популяций прокариот и проследить изменения распределений клеток по фазам их цикла в процессе роста популяции.
Математическая модель. Для решения указанной проблемы разработана математическая модель, учитывающая гетерогенность культуры по фазам клеточного цикла. Модель построена таким образом, что количество клеток, находящихся в каждой из фаз, описывается отдельным дифференциальным уравнением. Данная модель позволяет адекватно описывать различный характер кинетики роста как асинхронных, так и синхронизированных культур эукариотических и прокариотических микроорганизмов, оценивать количество клеток, находящихся в каждой из фаз клеточного цикла и среднее время генерации клеток.
Так, в процессе роста прокариот можно выделить либо три, либо две фазы клеточного цикла. Поэтому кинетику роста такой популяции можно описать одной из следующих систем уравнений:
a) для случая трех фаз:
dN |
1 |
|
|
|
|
|
|
|
|
|
~ |
|
(t) ; |
|
|
= 2k |
|
min |
N |
|
(τ) − k |
|
min |
N |
(τ) − k |
|
N |
||
dt |
|
|
|
|||||||||||
|
|
N3 |
t−tN3 ≤τ≤t |
|
3 |
|
N1 |
t−tN1 ≤τ≤t |
1 |
|
N1 |
1 |
|
|
dN |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|
(t) ; |
|||
|
= k |
|
|
|
min N |
|
(τ) −k |
|
|
|
min N |
|
(τ) −k |
|
N |
|
||||||||||||||||
dt |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
N1 |
t−tN1 ≤τ≤t |
1 |
|
|
|
|
N2 |
t−tN2 ≤τ≤t |
|
2 |
|
|
|
N |
2 |
|
|
|
2 |
|
|
|
||||||||
dN |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|
|
(t) ; |
|
|
= k |
N2 |
|
min |
N |
2 |
(τ) − k |
N3 |
min |
N |
3 |
(τ) − k |
N3 |
N |
3 |
|||||||||||||||||
dt |
|
|||||||||||||||||||||||||||||||
|
|
t |
−tN2 ≤τ≤t |
|
|
|
|
|
|
t −tN3 |
≤τ≤t |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
b) для случая двух фаз: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
dN |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
|
(t) ; |
||
|
= 2k |
|
|
min |
N |
|
(τ) −k |
|
min |
N |
(τ) −k |
|
N |
|||||||||||||||||||
dt |
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
N2 |
t−tN2 |
≤τ≤t |
|
|
2 |
|
|
|
|
N1 |
t−tN1 |
≤τ≤t |
|
|
1 |
|
|
|
N1 |
|
|
|
1 |
|
|
||||
dN |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
~ |
|
|
|
|
(t) ; |
|||||
|
= k |
N1 |
|
min |
N |
(τ) −k |
N2 |
|
|
min |
N |
|
(τ) −k |
N2 |
N |
|
||||||||||||||||
dt |
|
|
|
|
||||||||||||||||||||||||||||
|
|
t−tN1 ≤τ≤t |
1 |
|
|
|
|
|
t−tN 2 ≤τ≤t |
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|||||||||||
(2.160)
(2.161)
(2.162)
(2.163)
(2.164)
193
где kNi – коэффициенты пропорциональности при изменении
~
численности фазы Ni за счет развития, а kNi – коэффициенты
смертности в соответствующей фазе; T – продолжительность клеточного цикла (среднее время генерации). Длительности фаз
клеточного цикла tNi определяются для каждого случая отдель-
но. Функция min N (τ) (наименьшее значение функции Ni(t) на
t−tNi ≤τ≤t i
отрезке (t – tNi ; t)) показывает количество клеток, потенциально
готовых перейти в следующую фазу клеточного цикла.
Для решения полученных систем уравнений их необходимо дополнить соответствующими начальными условиями:
|
|
0, |
|
t < 0; |
|
|
|
|
|
|
|
|
|
f (t) |
1 |
, 0 < t <T; |
|
|
|
|
|
|
|
|
|||
= |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||||
|
T |
0, |
|
t > T. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
a. |
T – tN1 |
≤ 0: |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
tN |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
N1 (t −tN1 |
) = N0 ∫ f (t)dt ; |
|
|
(2.165) |
|||||||||
|
|
|
|
|
−(t−tN |
) |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
b. |
T – tN2 |
≤ 0: |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
tN +tN |
2 |
|
|
|
|||
|
|
|
|
|
|
|
1 |
∫ |
|
|
|
|
|
N2 (t −tN2 |
) = N0 |
|
|
f (t)dt ; |
(2.166) |
||||||||
|
|
|
|
|
|
tN |
−(t−tN |
) |
|
|
|||
|
|
|
|
|
|
1 |
|
|
|
2 |
|
|
|
c. |
T – tN3 |
≤ 0: |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
N3 (t −tN3 |
) = N0 |
|
|
|
∫ f (t)dt . |
(2.167) |
|||||||
|
|
|
|
|
|
tN |
+tN |
−(t−tN |
) |
|
|||
|
|
|
|
|
|
1 |
|
2 |
|
|
3 |
|
|
Для случая двух фаз начальные условия аналогичны. Общее количество клеток вычисляется как сумма чисел клеток, находящихся в каждой из фаз.
194

Объекты моделирования и программное обеспечение. В
качестве объектов моделирования и для идентификации параметров математической модели использовали принципиально отличающиеся кинетики роста прокариотических клеток, полученные различными авторами: Escherichia coli штамм М-17 (экспоненциальный рост), Anabaena sphaerica штамм TB-082 (отмирание микроорганизмов), Bacillus brevic var. G. – B. (синхронный рост). Для компьютерного моделирования роста микроорганизмов и последующей обработки полученных результатов использовался комплекс программ, написанных авторами на языке Turbo Pascal 7.0 и в среде Delphi 7 фирмы Borland.
Результаты вычислительных экспериментов. Первона-
чально была проведена идентификация параметров модели фазовой гетерогенности прокариот для различных объектов в предположении, что количество клеток, находящихся в каждой из фаз в начальный момент времени, пропорционально длительности соответствующей фазы. Результаты параметрической идентификации приведены в табл. 2.14, а на рис. 2.95 показано, что модель с указанными значениями параметров, хорошо соответствует экспериментальным данным, что указывает на ее адекватность.
На основе разработанной математической модели проводили исследование влияния начального распределения клеток по фазам на кинетику роста популяции. Важность такого исследования обусловлена необходимостью объяснения низкой воспроизводимости результатов реальных кинетических экспериментов.
|
|
|
Таблица 2.14 |
|
Параметры модели фазовой гетерогенности прокариот |
||
|
|
|
|
№ |
Объект исследования |
Модель фазовой |
|
п/п |
|
гетерогенности* |
|
|
|
~ |
= 1,41459; kC = 6,20372; |
1. |
Культура Escherichia |
kB = 6,32023; kB |
|
~ |
~ |
||
|
coli штамм М-17 |
kC = 0; kD = 5,96332; kD = 0,23422; |
|
|
|
T = 1,00551 ч; |
= 0,8 % |
|
|
~ |
~ |
2. |
Культура Anabaena |
kB = 2,00155; kB |
= 0; kC = 1,7652; kC = 0; |
sphaerica штамм TB-082 |
~ |
|
|
|
|
kD = 0,95204; kD = 2,62457; T = 3,86793 сут.; |
|
195
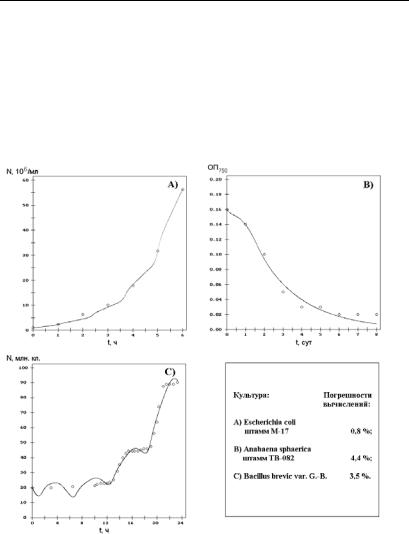
|
|
= 4,4 % |
|
|
|
~ |
|
|
|
kB = 0,95769; kB = 0,01348; kC = 2,74435; |
|
|
|
~ |
~ |
3. |
Культура Bacillus |
kC = 0,47406; kD = 1,3178; |
kD = 0; T = 5 ч; |
|
brevic var. G. – B. |
= 3,5 % |
|
|
|
|
|
|
|
(расчеты проведены с предположением, что |
|
|
|
все клетки находятся в фазе репликации ДНК) |
|
|
~ |
|
|
|
* − kNi , kNi , T − параметры модели (T − среднее время генерации (про- |
||
должительность клеточного цикла)); − относительная приведенная погрешность.
Рис. 2.95. Описание роста различных микроорганизмов моделью фазовой гетерогенности прокариот (° − экспериментальные данные, непрерывная линия − расчеты по модели)
196
Полученные значения параметров (табл. 2.14) использовали для моделирования кинетики роста популяций и отдельных фаз при случайном начальном распределении клеток по фазам клеточного цикла. Вычислительные эксперименты проводили используя параметры модели для двух культур – Escherichia coli (экспоненциальный рост) и Bacillus brevic var. G. – B. (синхронный рост). Для каждой из указанных культур проводили по десять тысяч вычислительных экспериментов при различных начальных распределениях, задаваемых случайным образом. На всем интервале времени роста популяции (при шаге 0,01 ч) определяли общее число клеток популяции, количество клеток в каждой из фаз и относительные доли каждой фазы. Кинетические
197
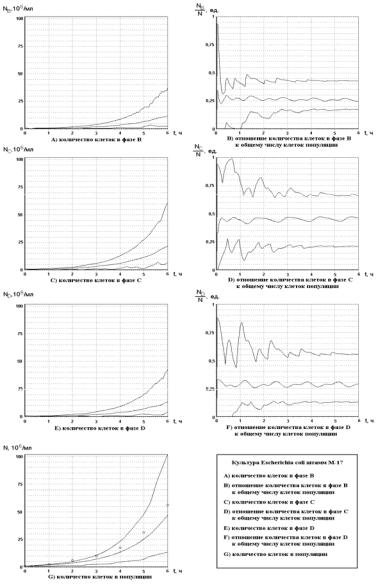
Рис. 2.96. Вычислительный эксперимент на основании модели фазовой гетерогенности прокариот для культуры Escherichia coli (° − экспериментальные данные, непрерывная линия − расчеты по модели)
198

Рис. 2.97. Вычислительный эксперимент на основании модели фазовой гетерогенности прокариот для культуры Bacillus brevic var. G. – B. (° − экспериментальные данные работы [11], непрерывная линия − расчеты по модели).
199
