
- •3.Вычислите э.Д.С. Гальванического элемента, образованного никелевым электродом с концентрацией ионов никеля(II) 0,1 моль/л, и хромовым электродом с концентрацией ионов хрома(III) 0,0001 моль/л.
- •2. Реакция с основаниями:
- •3. Определите направление перемещения электронов во внешней цепи следующих гальванических элементов:
- •3. Составьте уравнения возможных реакций:
- •Экзаменационный билет № 6
- •2. Влияние температуры на скорость химической реакции.
- •3. Увеличится или уменьшится масса цинковой пластины при взаимодействии: а) с раствором сульфата меди; б) с раствором нитрата свинца. Ответ обоснуйте, приведя уравнения соответствующих реакций.
- •Экзаменационный билет № 7
- •3. Из каких солей, перечисленных ниже, металл может быть вытеснен никелем: нитрат свинца, сульфат алюминия, сульфат меди, нитрат серебра, карбонат цинка, хлорид магния?
- •Экзаменационный билет № 8
- •3. Для восстановления 15,7 кг оксида хрома алюминотермическим способом было взято 5кг алюминия. Сколько хрома образовалось? Какое из исходных веществ оказалось в избытке? экзаменационный билет № 9
- •3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
- •Экзаменационный билет № 10
- •1. Законы кратных и объемных отношений.
- •2. Влияние концентрации, давления, температуры на состояние
- •3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
- •3. Подберите коэффициенты в уравнениях реакций, пользуясь методом полуреакций:
- •3. Вычислите степень окисления подчеркнутых элементов:
- •Экзаменационный билет № 14
- •3. Составьте математические выражения скорости прямой реакции для следующих реакций:
- •Экзаменационный билет № 15
- •3. Как изменится скорость прямой и обратной реакции
- •Экзаменационный билет № 16
- •3. Как изменится скорость прямой и обратной реакции
- •Экзаменационный билет № 17
- •2. Температура замерзания растворов. Криоскопическая постоянная.
- •Экзаменационный билет № 18
- •3. При 100 oC реакция заканчивается за 40 минут. Принимая температурный коэффициент реакции равным 3, определите время протекания этой же реакции при 200оС.
- •1. Экспериментальное обоснование Периодического закона
- •2. Сильные и слабые электролиты. Степень электролитической диссоциации.
- •3. Как изменится состояние равновесия в системах:
- •Экзаменационный билет № 21
- •1. Закон Мозли. Роль закона Мозли. Современная формулировка Периодического закона.
- •2. Особенности протекания химических реакций в растворах электролитов. Признаки протекания реакций в растворах электролитов.
- •3. Как можно увеличить процентное содержание аммиака в равновесной системе
- •Экзаменационный билет № 22
- •1. Причины периодичности свойств элементов.
- •2. Ионное произведение воды. Водородный показатель (рН).
- •3. Составьте формулы оксидов и гидроксидов следующих элементов:
- •Экзаменационный билет № 23
- •1. Связь свойств элементов, с зарядом ядра, электронным строением атомов и положением в Периодической системе.
- •3. Составьте формулы оксидов, соответствующие следующим гидроксидам: Mn(oh)4, NaOh, h3po4, hpo3. Составьте графические формулы всех соединений. Экзаменационный билет № 24
- •1. Радиус атома. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность. Изменение свойств элементов в зависимости от положения в Периодической системе.
- •2. Понятие окислительно-восстановительной реакции. Типы окислительно-восстановительных реакций.
- •3. Докажите амфотерные свойства оксида хрома(III) и гидроксида цинка, приведите уравнения соответствующих реакций.
- •Экзаменационный билет №25
- •1. Виды и особенности химической связи.
- •2. Степень окисления . Окислитель. Восстановитель. Процесс окисления. Процесс восстановления.
- •3. Составьте формулы
- •Экзаменационный билет № 26
- •1. Ковалентная связь. Метод валентных связей.
- •2. Метод электронного баланса.
- •3.Сколько сульфида железа должно получиться, если для проведения реакции взяли 8 г серы и 28 граммов железа? экзаменационный билет № 27
- •1. Метод молекулярных орбиталей.
- •2. Составление уравнений окислительно-восстановительных реакций методом полуреакций.
- •3. Определите простейшую формулу поташа, если массовый состав этого вещества: калия - 56,6%, углерода - 8,7%, кислорода - 34,8%.
- •2. Вытеснительный ряд н.Н.Бекетова. Взаимодействие металлов с растворами солей металлов.
- •3.Вычислите эквиваленты и эквивалентные массы Ag2o, CaHpo4, (CuOh)2co3, h3bo3.
- •2. Действие щелочей на металлы.
- •3. Из 1,4 г кальция получили 2,52 г его сульфида. Определите эквивалентную массу металла. Экзаменационный билет № 32
- •1. Возникновение двойного электрического слоя на границе металл-раствор. Электродный потенциал.
- •2. Сдвиг химического равновесия. Принцип Ле-Шателье.
- •3. Мышьяк образует два оксида, содержащих 65,2% и 75,7% мышьяка соответственно. Определите эквивалент и эквивалентную массу мышьяка в обоих оксидах. Экзаменационный билет № 33
- •1. Нормальный водородный электрод. Стандартный электродный потенциал. Ряд напряжений металлов.
- •2. Сильные и слабые электролиты. Степень электролитической диссоциации.
- •3.1 Литр кислорода весит 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния,эквивалент которого равен 12
- •1. Гальванические элементы. Э.Д.С. Гальванического элемента.
- •2. Ионное произведение воды. Водородный показатель (рН).
- •3. Какой объем при нормальных условиях занимают 1020 молекул газа. Экзаменационный билет № 35
- •1. Концентрационный гальванический элемент.
- •2. Гидролиз солей.
- •3. Определите количество вещества, содержащегося в:
- •Экзаменационный билет № 36
- •1. Электролиз расплавов электролитов.
- •2. Метод молекулярных орбиталей.
- •3. Вычислите молекулярную массу газа, если 300 мл его при нормальных условиях весят 0,857 г. Экзаменационный билет № 37
- •1. Электролиз водных растворов электролитов с инертным анодом.
- •2. Составьте полную электронную формулу элемента, расположенного в 6-ом периоде, 7-й группе, главной подгруппе.
- •Экзаменационный билет № 39
- •1. Коррозия металлов. Виды коррозии.
- •2. Направленность химической связи. Гибридизация атомных орбиталей. Строение простейших молекул.
- •3. Вычислите массовую долю, моляльную концентрацию и мольную долю хлорида бария в растворе, содержащем 50 г BaCl22h2o в 1000 г воды. Экзаменационный билет № 40
- •1. Контактная коррозия металлов.
- •2. Квантовые числа. Электронные спектроскопические формулы атомов.
- •3. Вычислите молярность и нормальность 20 %-ного раствора хлорида кальция с плотностью 1,178 г/см3. Экзаменационный билет № 41
- •1. Коррозия под действием блуждающих токов.
- •2. Причины периодичности свойств элементов.
- •3. Составьте уравнения реакций в молекулярном, полном и сокращенном ионном виде
- •Экзаменационный билет № 42
- •1. Методы защиты металлов от коррозии.
- •2. Гидролиз солей.
- •3. Cоставьте полные ионные и молекулярные уравнения, соответствующие приведенным кратким уравнениям реакций:
- •Экзаменационный билет № 43
- •1. Металлические покрытия.
- •2. Основные положения теории электролитической диссоциации с.Аррениуса.
- •3. Составьте уравнения гидролиза Be(no3)2, Rb2s, BaCl2 в молекулярном и ионном виде. Укажите рН среды. Экзаменационный билет № 44
- •2. Укажите, какие молекулы из перечисленных имеют угловую форму:
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 1
Основные классы неорганических соединений. Оксиды, основания, кислоты, соли.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Донорно-акцепторная связь. Механизм образования донорно-акцепторной связи.
Ковалентная связь, образующаяся за счет пары электронов одного из атомов, т.е. по донорно-акцепторному механизму, называется дoнорно-акцeпторной.
Например, такая связь образуется между атомом азота в молекуле метиламина CH3NH2 и протоном H+ кислоты HCl:
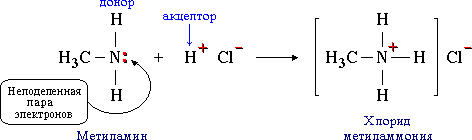
Атом азота отдает свою электронную пару для образования связи и выступает в роли донора, а протон предоставляет вакантную орбиталь, играя роль акцептора. Атом-донор при этом приобретает положительный заряд.
Донорно-акцeпторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями.
3. Железо покрыто медью. Какой из металлов будет коррозировать в случае нарушения покрытия? Составьте электронные уравнения реакций, протекающих при контактной коррозии железа и меди а) в соляной кислоте; б) в атмосферных условиях.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 2
Основные способы получения оксидов, оснований, кислот солей.
Получение оснований:
1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O ® 2NaOH + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O ® Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O ® 2NaOH + H2 + Cl2
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 ® 2MgO
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 –t°® CuO + H2O
Получение кислот
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O ® H2SO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 ® 2HCl
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 ® BaSO4¯ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl ® H2SiO3¯ + 2NaCl
Получение солей
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом:2Na + Cl2 ® 2NaCl
2) металла с кислотой: Zn + 2HCl ® ZnCl2 + H2
3) металла с раствором соли менее активного металла Fe + CuSO4 ® FeSO4 + Cu
4) основного оксида с кислотным оксидом: MgO + CO2 ® MgCO3
5) основного оксида с кислотой CuO + H2SO4 –t°® CuSO4 + H2O
6) основания с кислотным оксидом Ba(OH)2 + CO2 ® BaCO3¯ + H2O
7) основания с кислотой: Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
8) соли с кислотой: MgCO3 + 2HCl ® MgCl2 + H2O + CO2
9) раствора основания с раствором соли: Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
10) растворов двух солей 3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Металлическая связь.
В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку.
Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро.
Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий).
3. Определите массу веществ, выделившихся на золотых электродах в процессе электролиза сульфата меди при силе тока 2 А в течение 40 минут. Составьте уравнения электродных процессов.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 3
Валентность. Графические формулы, правила их составления.
ВАЛЕНТНОСТЬ - способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи.
Составление формул по валентностям.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого. Рассмотрим на примере образования молекулы, состоящей из фосфора и кислорода. Будем составлять в соответствии с алгоритмом: 1.Записываем рядом символы химических элементов: Р О
2.Ставим
над химическими элементами их валентности
римскими цифрами, у фосфора равна 5, у
кислорода-2.
![]()
3.
Находим наименьшее общее кратное, то
есть наименьшее число, которое делится
без остатка на 5 и на 2. Это число 10. Делим
его на валентности элементов 10:5=2, 10:2=5,
2 и 5 будут индексами, соответственно у
фосфора и кислорода. Подставляем индексы.
![]()
Можно по формуле, зная валентность одного химического элемента, определить валентность другого.
Скорость гомогенной и гетерогенной химической реакции.
Гомогенные реакции - реакций, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов. Скорость гомогенной химической реакции определяется по изменению концентрации любого из реагирующих веществ в единицу времени. Скорость простой гомогенной реакции при постоянном объеме подчиняется закону действующих масс.

Гетерогенные реакции - реакции, происходящие на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Скорость реакции определяется числом молей веществ, вступивших или образующихся в результате реакции в единицу времени на единице поверхности:

3.Вычислите э.Д.С. Гальванического элемента, образованного никелевым электродом с концентрацией ионов никеля(II) 0,1 моль/л, и хромовым электродом с концентрацией ионов хрома(III) 0,0001 моль/л.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 4
Виды оксидов: основные, кислотные, амфотерные оксиды. Особенности и свойства.
Основные оксиды – соответствуют основаниям (BaO, CuO) – твердые вещ-ва разного цвета, с различной растворимостью в воде.
Химические свойства на примерах:
1. Взаимодействие с водой:
- взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O = Ca(OH)2 (реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
- взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2=CaCO3 (Это вещество - обычный мел)
Кислотные оксиды – соответствуют кислотам (CO2, SiO2) – твердые или газообразные вещ-ва с различной растворимостью в воде.
Химические свойства на примерах:
химическая реакция с водой
CO2+H2O=H2CO3 - это вещество - угольная кислота
реакция с щелочами (основаниями):
CO2+NaOH=Na2CO3
реакция с основными оксидами:
CO2+MgO=MgCO3 –
Амфотерные оксиды – проявляют свойства кислотных и основных оксидов (MnO2, BeO) – твердые вещ-ва разного цвета, практические нерастворимые в воде.
Химические свойства на примерах:
реакция с кислотным оксидом:
ZnO+H2CO3 = ZnCO3 + H2O
2. Реакция с основаниями:
ZnO+2NaOH=Na2ZnO2+H2O
Факторы, влияющие на скорость химической реакции.
Концентрация – скорость прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении химической реакции (закон действующих масс).
Температура – при повышении температуры на каждый 10 градусов скорость реакции увеличивается в 2-4 раза (правило Вант-Гоффа).
Поверхность взаимодействия реагирующих веществ (для гетерогенных реакций). Для таких реакций часто применяют измельчение твердых веществ, их перемешивание.
Присутствие катализаторов и ингибиторов – скорость реакций зависит от катализаторов (веществ, увеличивающих скорость реакций) и ингибиторов (вещества, уменьшающие скорость теакций)
3. Определите направление перемещения электронов во внешней цепи следующих гальванических элементов:
FeFe(NO3)2 Pb(NO3)2Pb;
CuCu(NO3)2 AgNO3Ag;
ZnZnSO4 MgSO4Mg.
Составьте уравнения реакций, протекающих на электродах.
ЭКЗАМЕНАЦИОННЫЙ БИЛЕТ № 5
Виды гидратов оксидов. Кислоты, основания, амфотерные гидроксиды.
Амфотерные гидроксиды — неорганические соединения, гидроксиды амфотерных элементов, в зависимости от условий проявляющие свойства кислотных или основных гидроксидов. Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
Общие свойства
Все амфотерные гидроксиды являются твёрдыми веществами. Нерастворимы в воде, в основном являются слабыми электролитами.
При нагревании разлагаются с образованием соответствующего амфотерного оксида, например:
![]()
В ряде случаев промежуточным продуктом при разложении является метагидроксид, например:
![]()
При взаимодействии с кислотами образуют соли с амфотерным элементом в катионе, например:
![]()
При взаимодействии со щёлочью образуют соли с амфотерным элементом в анионе, например:
![]()
Получение
Общим способом получения амфотерных гидроксидов является осаждение разбавленной щёлочью из растворов солей соответствующего амфотерного элемента, например:
![]()
В ряде случаев при осаждении образуется не гидроксид, а гидрат оксида соответствующего элемента (например, гидраты оксидов железа(III), хрома(III), олова(II) и др.).
Влияние концентрации на скорость химической реакции.
Основной постулат химической кинетики, называемый также законом действующих масс:
|
Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в некоторые степени: v = k[A]n[B]m, для реакции aA + bB = ... |
Числа n, m в выражении закона действующих масс называются порядками реакции по соответствующим веществам. Это экспериментально определяемые величины. Сумма показателей степеней n, m называется общим порядком реакции.
