
методичка_по_молекулярке V1.0-А5
.pdfВопросы тестового контроля самоподготовки
1. Апоптоз - это:
1)запрограммированная смерть организма
2)гибель клеток после ожога
3)гибель клеток после травмы органов
4)результат гибели клеток при переломах кости
5)запрограммированная гибель клеток
2. Активация белка р53 приводит к:
1)активации процесса деления клетки
2)активации генов иммунного ответа
3)активации генов, подавляющих процесс деления клеток
4)активации генов, усиливающих транскрипцию
5)активации гена (белка) р55
3. Возможная причина апоптоза:
1)ускорение процесса деления клетки
2)кровотечение
3)замедление процесса деления клетки
4)некроз клетки
5)воздействие повреждающих факторов среды
4. В процессе жизнедеятельности человека апоптоз проявляется в виде:
1) заживления раневой поверхности
2)гибели лактоцитов после окончания грудного вскармливания
3)зарастания просвета кишечной трубки
4)гибели клеток межпальцевых промежутков в процессе родов
5)развития злокачественных опухолевых клеток
5. К апоптозу относятся следующие клеточные процессы:
1)пролиферация клеток, некроз клеток, патологическая гибель клеток
2)слущивание эпидермальных клеток почек, печени, легких
3)слущивание нервных клеток головного мозга, гибель органов, эмбриона
4)гибель фолликулярных клеток яичника, поврежденных гамет, слущивание эпидермальных клеток кожи
5)гибель гамет в момент оплодотворения, самопроизвольные выкидыши, мертворождение
6. Ключевые ферменты апоптоза:
1)цистеиновые каспазы
2)киназы
3)серийные лигазы
4)сериновые протеазы
5)липазы
7. В постмитотическом периоде митотического цикла последовательно функционируют комплексы ферментов:

1) |
ДНК-полимеразы +РНК-поли- |
действием регуляторных белко- |
|
меразы |
вых молекул: |
||
2) |
циклин Д + циклинзависимой |
1) |
цепарин А + цепарин зависи- |
киназы 1 (ЦЗК-1) и ЦЗК-2 |
мая киназа 1 (ЦЗК-1) |
||
3) |
циклин А + ЦЗК-4 и ЦЗК-6 |
2) |
циклин В + циклинзависимая |
4) |
циклин Е + ЦЗК-2 |
киназа 3 (ЦЗК-3) |
|
5) |
циклин Е + ЦЗК-4 |
3) |
циклин М + ЦЗК-2 |
|
|
4) |
митозстимулирующий фактор |
8. В синтетическом периоде ми- |
(МСФ) |
||
тотического цикла регулирующая |
5) |
митозконтролирующий фактор |
|
роль принадлежит ферментам: |
(МКФ) |
||
1) |
ДНК-лигаза + РНК-полимераза |
|
|
2) |
циклин А + циклинзависимая |
10. Внеклеточный регулятор про- |
|
киназа 5 |
цесса деления клетки: |
||
3) |
циклин В + ЦЗК-2 |
1) |
эпинефральный фактор роста |
4) |
циклин С + ЦЗК-2 |
2) |
эпидермальный фактор роста |
5) |
циклин R+ ЦЗК-2 |
3) |
антагонист-представляющие |
|
|
клетки |
|
9. Постсинтетический период |
4) |
антиген-представляющие орга- |
|
(G2) характеризуется активным |
ноиды |
||
|
|
5) |
эпидуральный фактор роста |
Контроль результатов усвоения.
1.Тестовый контроль. (Раздаётся на листах по вариантам).
2.Обсуждение докладов УИРС.
Литература:
1.Лекционные записи.
2.Мушкамбаров Н.Н., Кузнецов С.Л. Молекулярная биология. МИА
2007 – 536 с.
Занятие №10.
Тема: Синтез и секвенирование ДНК.
Цель занятия: Изучить методы химического синтеза и анализа нуклеотидной последовательности ДНК.
Задачи: Рассмотреть современные подходы к химическому синтезу ДНК. Изучить этапы фосфорамидитного метода. Изучить методы секвенирования ДНК.

Основные вопросы темы:
(Основа ориентировочного действия при самостоятельной подготовке)
1.Общее представление о химическом синтезе ДНК.
2.Фосфорамидитный метод. Возможности. Ограничения. Этапы.
3.Применение синтезированных олигонуклеотидов. Синтез генов.
4.Методы секвенирования ДНК: химический, ферментативный.
5.Секвенирование по Сэнгеру. Преимущества и недостатки. Этапы. Методы визуализации результатов.
6.Пиросеквенирование.
Дополнительный материал для подготовки к занятию.
Схема фосфорамидитного метода синтеза ДНК
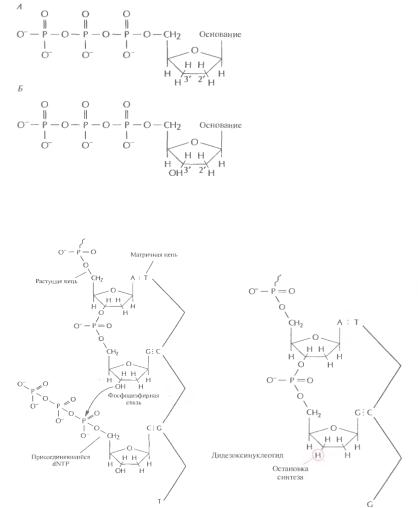
Формулы дидезоксирибонуклеотида (А) и дезоксирибонуклеотида (Б).
Механизм обрыва цепи при встраивании дидезоксирибонуклеотида.
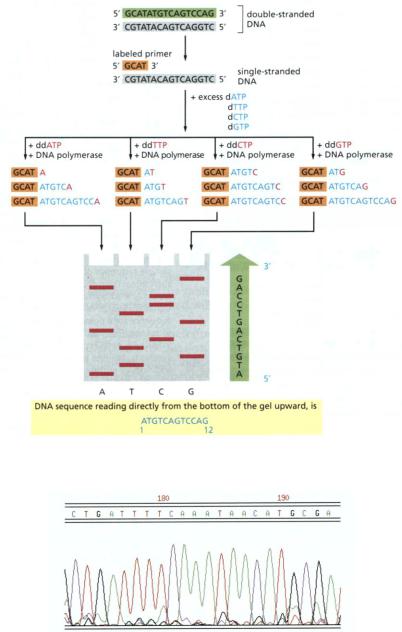
Этапы секвенирования по Сэнгеру и интерпретация результатов.
Результат секвенирования с использованием капиллярного электрофореза
Вопросы тестового контроля самоподготовки
1. Эффективность каждого цикла |
6. |
Химическое секвенирование |
|
при химическом синтезе ДНК |
ДНК предложили: |
||
должна быть не ниже (%) |
1) |
Уотсон и Крик |
|
1) |
92 |
2) |
Сэвидж и Максам |
2) |
94 |
3) |
Максам и Гилберт |
3) |
96 |
4) |
Крик и Гилберт |
4) |
98 |
5) |
Сэнгер и Гилберт |
5) |
100 |
|
|
|
|
7. |
Химическое секвенирование |
2. Кэппирование в цикле синтеза |
ДНК основано на: |
||
ДНК необходимо для: |
1. |
синтезе комплементарного |
|
1) |
активации 5’-ОН |
участка ДНК |
|
2) |
инактивации 5’-ОН |
2. |
разрушении 1 нуклеотида |
3) |
активации 3’-ОН |
3. |
синтезе диэфирных связей |
4) |
инактивации 3’-ОН |
4. |
разрушении одного/двух из 4 |
5) |
верно 1 и 4 |
нуклеотидов в каждой аликвоте |
|
|
|
5. |
разрушении пептидных связей |
3. На этапе окисления при син- |
|
|
|
тезе ДНК происходит: |
8. |
Ферментативное секвенирова- |
|
1) |
переход N5+ в N3+ |
ние ДНК предложил: |
|
2) |
переход Р5+ в Р3+ |
1. |
Сэнгер |
3) |
переход S2+ в S4+ |
2. |
Гилберт |
4) |
переход Р3+ в Р5+ |
3. |
Максам |
5) |
переход N3+ в N5+ |
4. |
Сэвидж |
|
|
5. |
Крик |
4. Синтез гена из коротких цепей |
|
|
|
происходит с участием фермента: |
9. |
Анализ полученных при секве- |
|
1) |
лигазы |
нировании олигонуклеотидов |
|
2) |
хеликазы |
проводится с помощью: |
|
3) |
эндонуклеаза |
1) |
электронного микроскопа |
4) |
ревертазы |
2) |
рентгеноструктурного анализа |
5) |
топоизомеразы |
3) |
FISH |
|
|
4) |
центрифугирования |
5. Секвенирование ДНК – это |
5) |
электрофореза |
|
определение: |
|
|
|
1) |
количества пуриновых основа- |
10. Синтез дочерней цепи при |
|
ний |
ферментативном секвенировании |
||
2) |
структуры |
начинается с: |
|
3) |
нуклеотидной последователь- |
1) |
линкера |
ности |
2) |
энхансера |
|
4) |
количества генов |
3) |
промотора |
5) |
видовой принадлежности |
4) |
праймера |
|
|
5) |
инсулятора |

Контроль результатов усвоения.
1.Тестовый контроль. (Раздаётся на листах по вариантам).
2.Обсуждение докладов УИРС.
Литература:
1. Лекционные записи.
Дополнительная литература:
1.Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. М.: Мир, 2002. – 589с.
2.Браун Т.А. Геномы. Руководство по молекулярной генетике. М.- Ижевск: ИКИ, 2011. – 944 с.
Занятие №11.
Тема: Молекулярно-генетическая диагностика.
Цель занятия: Разобрать принципы современных методов моле- кулярно-генетической диагностики.
Задачи: Изучить возможности и ограничения полимеразной цепной реакции, этапы её проведения. Изучить ПЦР в реальном времени (RT-PCR). Изучить флуоресцентную гибридизацию in situ (FISH). Рассмотреть молекулярно-генетические методы идентификации личности.
Основные вопросы темы:
(Основа ориентировочного действия при самостоятельной подготовке)
1.Использование достижений молекулярной биологии в медицине.
2.Полимеразная цепная реакция. Возможности и ограничения. Основные этапы, условия проведения.
3.ПЦР в реальном времени (RT-PCR). Виды зондов. Возможности и использование в медицине.
4.Флуоресцентная гибридизация in situ (FISH). Возможности и ограничения. Основные этапы, условия проведения. Использование в медицине.
5.Молекулярно-генетические методы в криминалистике. Методы идентификации личности. Установление родства.

Дополнительный материал для подготовки к занятию.
Типичная ПЦР-амплификация состоит в многократном (около 30 раз) повторении следующих трех реакций.
1. Денатурация. Проводится тепловая денатурация образца ДНК выдерживанием его при температуре 950С в течение по крайней мере 1 мин.
3. Синтез. Температуру повы-
шают до ~750С — величины, оптимальной для ДНК-поли- меразы Taq. Начинается синтез комплементарной цепи ДНК, инициируемый 3'-гид- роксильной группой праймера
2. Ренатурация. Температуру смеси медленно понижают до
~550С, при этом праймеры спариваются с комплементарными последовательностями ДНК.
Принцип FISH-реакции |
Схема FISH-реакции |

Схема «Геномной дактилоскопии»
Вопросы тестового контроля самоподготовки
1. Для визуализации результатов |
1) |
в анализе родословных |
|
амплификации ДНК используется |
2) |
в клиникогенеалогическом |
|
1) |
электрофорез |
методе |
|
2) |
микроскопия |
3) |
для размножения в большом |
3) |
центрифугирование |
количестве участка ДНК |
|
4) |
хроматография |
4) |
для размножения в большом |
5) |
FISH |
количестве участка РНК |
|
|
|
5) |
для размножения клеток и ор- |
2. Полимеразная цепная реакция |
ганов |
||
используется: |
|
|
|
3. Синонимом термина «отжиг |
7. Свечение при исследовании по |
||
праймера» при ПЦР является: |
методу FISH возникает под воз- |
||
1) |
плавление |
действием излучения: |
|
2) |
амплификация |
1) |
ультрафиолетового |
3) |
гидролиз |
2) |
инфракрасного |
4) |
денатурация |
3) |
теплового |
5) |
гибридизация |
4) |
рентгеновского |
|
|
5) |
гамма |
4. Прибор для автоматизирован- |
|
|
|
ного проведения ПЦР называется: |
8. Для учета результатов FISH- |
||
1) |
анализатор |
реакции необходим микроскоп: |
|
2) |
амплификатор |
1) |
электронный |
3) |
циклотрон |
2) |
световой |
4) |
термостат |
3) |
фазово-контрастный |
5) |
гидролизатор |
4) |
флюоресцентный |
|
|
5) |
бинокулярный |
5. Ионы, необходимые для ра- |
|
|
|
боты ДНК-полимеразы: |
9. Для идентификации личности |
||
1) K+ |
наиболее часто исследуются: |
||
2) |
Na+ |
1) |
длинные диспергированные |
3) Mg2+ |
повторы |
||
4) |
Ca2+ |
2) |
короткие тандемные повторы |
5) |
Cl- |
3) |
ретротранспозоны |
|
|
4) |
транспозоны |
6. К концу 30-го цикла количе- |
5) |
теломеры |
|
ство продуктов ПЦР увеличива- |
|
|
|
ется в (раз): |
10. Для установления родства |
||
1) |
30 |
«Родитель-ребенок» наиболее ча- |
|
2) |
300 |
сто исследуется ДНК, выделенная |
|
3) |
103 |
из: |
|
4) |
106 |
1) |
буккального эпителия |
5) |
1030 |
2) |
половых кленок |
|
|
3) |
эритроцитов |
|
|
4) |
кожного эпителия |
|
|
5) |
стволовых клеток |
Контроль результатов усвоения.
1.Тестовый контроль. (Раздаётся на листах по вариантам).
2.Обсуждение докладов УИРС.
