
- •Мгупи Кафедра мт-6 «Физико-химического материаловедения и композиционных материалов»
- •Москва, 2013
- •Технические параметры материалов
- •1.Объемно-структурные параметры.
- •2.1. Прочность
- •2.1.1.Кратковременная прочность при растяжении
- •2.1.2. Динамическая прочность
- •2.2.Жесткость
- •2.3. Твердость
- •2.5.3. Характер разрушения адгезионного соединения
- •3.Теплофизические свойства
- •3.6. Температура фазовых переходов
- •4. Электрические свойства
- •5. Магнитные свойства
- •6. Химическая стойкость Универсальный параметр
- •8. Оптические параметры.
- •10. Энергетические параметры
- •11. Диффузионные параметры
- •Структура материалов Химические связи.
- •Кристаллы.
- •Аморфная фаза.
- •Фазовое состояние материалов
- •Состояния воды
- •Элементы зонной теории твердого тела.
- •Проводимости.
- •Полимеры
- •Получение полимеров.
- •Физические и фазовые состояния полимеров
- •Физические свойства полимеров
- •Металлы и сплавы
- •Fe3c- карбид железа
- •Цветные металлы.
- •Сплавы высокого электрического сопротивления
- •Техническая керамика.
- •Применение технической керамики.
- •Стекла и ситаллы Неорганические стекла.
- •Ситаллы
- •Композиционные материалы
- •Диэлектрики.
- •Сегнетоэлектрики.
- •Пьезоэлектрики
- •Электреты.
- •Жидкие кристаллы.
- •Полупроводники.
- •Получение.
- •Полупроводниковые химические элементы.
- •Полупроводниковые соединения
- •Магнитные материалы.
- •Литература
Кристаллы.
Как известно, все вещества могут находиться в трех агрегатных состояниях; газообразном, жидком и твердом. Твердые тела обладают весьма высокой степенью упорядоченности образующих их частиц. При этом может оказаться, что каждый атом окружен ближайшими соседними атомами, а также соседями второго и третьего порядков, расположенными по строго определенным направлениям, на строго определенных расстояниях друг от друга. Например, в алюминии каждый атом окружен двенадцатью соседями на расстоянии 0,28 нм; в NaCIкаждый ионNaокружен шестью ближайшими ионами С1, а каждый ион хлора — шестью ионами натрия. Если такое положение сохраняется для всех ионов, то говорят о структуре дальнего порядка. Твердое тело, обладающее дальним порядком, называют кристаллическим. Наличие дальнего порядка определяет строго повторяющуюся картину расположения структурных частиц в пределах всего кристалла. Твердая фаза может быть получена в виде монокристалла или поликристалла, представляющего совокупность отдельных зерен или кристаллитов, сросшихся друг с другом. При этом отдельные зерна имеют различную пространственную ориентацию. В общем случае эта ориентация случайна, с равной степенью вероятности может встретиться любая ориентация. Некоторые способы обработки материалов в холодном состоянии (прокатка, волочение и т. д.) приводят к преимущественной ориентации зерен (текстура). Степень преимущественной ориентации может быть различной, вплоть до такой, когда все зерна ориентированы одинаково.
Однако не все твердые тела обладают дальним порядком. Например, в кварцевом стекле положение соседей второго и третьего порядка не является строго определенным, хотя каждый атом кремния соседствует с четырьмя атомами кислорода, находящимися на расстоянии 0,16 нм, а каждый атом кислорода — с двумя атомами кремния. В этом случае говорят о ближнем порядке, т. е. указывают на существование правильной ориентации только ближайших соседей. Твердые тела, обладающие только ближним порядком, называют аморфными.
Кристаллическая решетка.Иногда говорят, что кристалл — это твердое тело, имеющее естественную форму многогранника. Однако внешняя форма материала может меняться. Внутренняя же структура остается неизменной. В положении термодинамического равновесия атомы, ионы или молекулы, образующие кристалл, располагаются в узлах кристаллической решетки. Соответственно можно говорить об атомных, ионных или молекулярных кристаллах. К первому типу кристаллов относятся простейшие кристаллы, состоящие только из атомов одного элемента —Al,Fe,Siи т. п., ко второму —MgO,PbSи т. п. Кристаллы третьего типа образует, например, метанCH4при затвердевании.
Поскольку кристаллы обладают дальним порядком, то, следовательно, можно выбрать некоторый объем (ячейку), транслируя который, можно полностью воспроизвести структуру кристалла. Наименьший такой объем называют элементарной ячейкой. Элементарная ячейка характеризуется ребрами а, b, с и углами,имежду ними. Простейшим типом решетки является кубическая, у которой а =b= с,===90°. Необходимо отметить, что частицы, образующие кристалл, в общем случае могут располагаться не только в вершинах элементарных ячеек, но и в других точках. Например, объемноцентрированные решетки содержат дополнительную частицу в точке пересечения пространственных диагоналей; гранецентрированные — в точках пересечения диагоналей граней.
В соответствии с внутренней структурой кристаллы объединяются в семь кристаллических систем (или сингоний), отличающихся соотношением длины ребер элементарных ячеек и углов между ними. Длина ребра элементарной ячейки называется постоянной решетки. Следует отметить, что межатомное расстояние не обязательно равно постоянной решетки. Это — действительное расстояние между атомами, в то время как постоянная решетки некоторая усредненная величина.
Рис. 2.4. Элементарная
ячейка и индексы направлений и плоскостей.
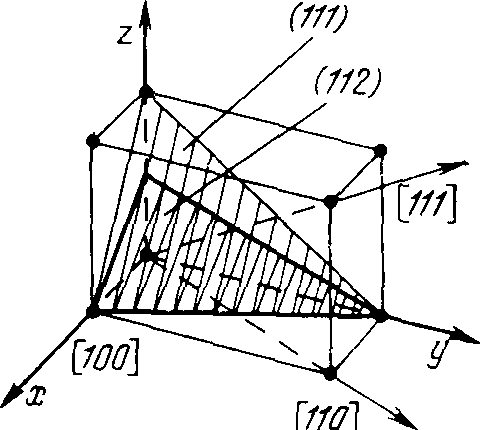
Ясно, что любой узел кристаллической решетки может быть выбран за начало координат для элементарной ячейки. Тогда любую другую точку можно задать ее координатами х = аu, у =bv,z=cw. Если же за единицу масштаба взять постоянную решетки, то координатами любой точки будут числаu,v,w. Их называют индексами узла и записывают так: [[uvw]]. Для отрицательного индекса ставится черта над индексом . Например, положение центра элементарной ячейки определяется индексом [[½ ½ ½ ]] положение центра грани, лежащей в плоскости хоу, — индексом [[½ ½ 0]].
Кристаллы обладают анизотропией, однородностью и симметрией. Анизотропия является наиболее характерным и общим признаком кристаллов — все векторные свойства в любых точках внутри кристалла одинаковы в параллельных и симметричных направлениях и различны в разных направлениях. Например, наибольшая магнитная проницаемость железа наблюдается в направлениях, параллельных кристаллографическим осям (т. е. совпадающих с ребрами элементарной ячейки). Анизотропией обладают модуль упругости, проводимость и некоторые другие характеристики. Из этого следует, что необходимо отмечать индексом направления, вдоль которых проводятся измерения.
Индекс направления, обозначаемый [uvw], определяется координатами вектора, выходящего из начала координат и параллельного заданному направлению. Его положение точно определяется индексом первого узла, через который он проходит. Например, индекс направления, параллельного пространственной диагонали, запишется так: [111]. Ясно, что индексы [½ ½ 1], [112], [2 2 4] и т. д. обозначают одно и то же направление. Поэтому индекс уменьшают до минимальных целых чисел. В качестве примера на рис. 2.4 показаны направления для ромбической решетки.
Кроме углов и направлений решетка содержит множество идентичных кристаллических плоскостей (рис. 2.4), также определяющих свойства кристаллов. Например, пластическая деформация, рост и скол кристаллов проходят легче по определенным плоскостям. Плоскость может быть задана либо направлением нормали [uvw], либо отрезками, отсекаемыми на координатных осях. В последнем случае уравнение плоскости имеет вид х/u+ у/v+z/w= 1, где координатные оси х, у,zпересекаются в точкахu,v,w. Это уравнение можно переписать в видеhx+ky+lz= 1, гдеh,k,l— обратные величины отсекаемых отрезков.
Рис.2.5.
Точечные
дефекты
Дефекты кристаллических структур. Кристаллов, которые обладали бы идеальной симметрией, идеально точным расположением атомов в узлах кристаллической решетки, полным отсутствием чужеродных внедрений в природе не существует. Более того, кристаллы всегда имеют какие-либо дефекты, наличие которых во многом определяет их механические, оптические, электрические и магнитные свойства.
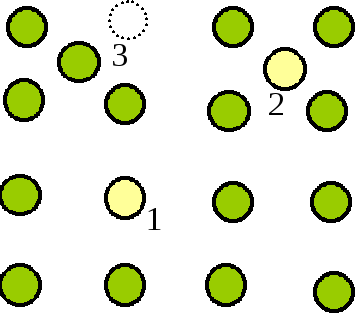
Дефекты в кристаллах классифицируют по их размерам — точечные (или атомные, нульмерные), линейные (одномерные) и поверхностные (двумерные). Точечные дефекты (рис. 2.5)—это атомы примесей, замещающие атомы основного вещества в узлах решетки (1) или располагающиеся в междуузлиях (2), или атомы основного вещества, отсутствующие или смещенные из нормальных узлов (3). Узел решетки, в котором отсутствует атом, называется вакансией или дефектом по Шоттки. Совокупность вакансии и междуузлия называется дефектом по Френкелю. Вакансии и междуузельные атомы могут перемещаться в кристалле. Появление вакансии в новом месте происходит в результате переноса соседнего атома в свободный узел. Движение междуузельных атомов носит более сложный характер, в некоторых случаях их перемещение осуществляется целиком по междуузлиям.
Рис.2.6. Краевая
дислокация
Подобные деформированные области возникают и у поверхности кристаллов вблизи точек выхода дислокаций. Поэтому скорость растворения кристаллов в различных травителях изменяется в пространстве, прилегающем к этим точкам. На этом основан метод обнаружения дислокаций по «ямкам травления». Поскольку вокруг дислокаций возникают механические напряжения, то потенциальная энергия примесных атомов вблизи дислокаций меньше, чем вдали от них. Поэтому легко диффундирующие примеси могут накапливаться вокруг дислокаций, образуя примесную «атмосферу Коттрелла» вокруг них.
 Необходимо
отметить, что количество примесных
атомов, концентрирующихся у дислокации,
зависит от температуры: при повышении
температуры атмосферы Коттрелла
рассеиваются, при понижении — образуются
вновь. Образование примесных атмосфер
приводит к микронеоднородности
распределения легирующей примеси.
Необходимо
отметить, что количество примесных
атомов, концентрирующихся у дислокации,
зависит от температуры: при повышении
температуры атмосферы Коттрелла
рассеиваются, при понижении — образуются
вновь. Образование примесных атмосфер
приводит к микронеоднородности
распределения легирующей примеси.
Дислокации могут возникать самопроизвольно в процессе роста кристаллов. Это объясняется возникновением деформаций при неравномерном охлаждении кристалла, из-за неравномерности скорости его роста и т. п. Вдоль границы сросшихся монокристаллических блоков, разориентированных на малый угол, возникают так называемые дислокационные стенки.
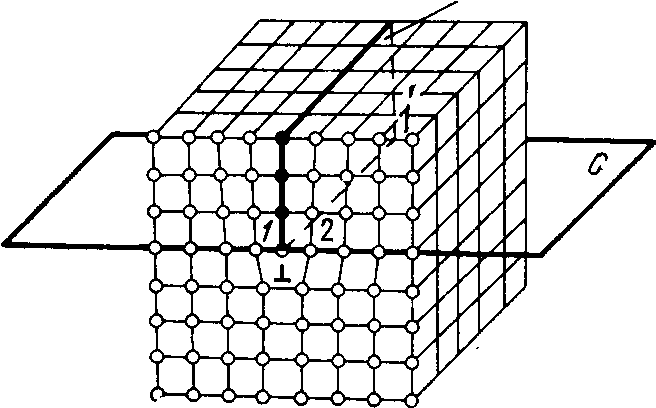
Под воздействием механических напряжений краевая дислокация 1 11будет перемещаться вдоль плоскости С, пока не достигнет границы зерна или блока. Такое движение консервативно — без переноса вещества. Дислокации могут взаимодействовать и друг с другом, и с другими дефектами. Если противоположные по знаку дислокации движутся в одной плоскости, то при встрече они взаимно уничтожаются (в кристалле образуется полная плоскость). Как уже отмечалось, точечные дефекты притягиваются к краевым дислокациям. Поэтому они могут поглощаться ими (аннигилировать на дислокациях). Механизм поглощения заключается в том, что, когда, например, вакансия подходит к ступеньке, последняя смещается на одно межатомное расстояние, а сама вакансия исчезает. При поглощении междуузельных атомов ступенька смещается в направлении, противоположном смещению при захвате вакансии. Таким образом, ступеньки на дислокации являются местом стока для точечных дефектов. В кристалле дислокации располагаются в виде сеток. Однако при сложном взаимодействии точечных дефектов и дислокаций могут возникать и отдельные дислокации, и дислокационные сплетения (клубки).
Винтовые дислокации (рис.2.7) могут быть получены при частичном сдвиге, например по плоскости Qвокруг линииEF. На поверхности при этом образуется ступенька, проходящая не по всей поверхности кристалла. Такой сдвиг нарушает параллельность атомных слоев, кристалл как бы закручивается. Линия EF представляет границу, отделяющую ту часть плоскости скольжения, где сдвиг уже произошел, от той части, где сдвиг еще не начинался, — это и есть дислокация. Вдоль этой линии области несовершенства имеют макроскопический характер, в других направлениях размеры дислокации не превышают нескольких периодов решетки. Винтовую дислокацию называют правой, если она образована вращением по часовой стрелке, и левой — в противном случае. Движение винтовой дислокации также консервативное, однако, оно не связано с какой-либо плоскостью скольжения: дислокация может перемещаться в любой плоскости, проходящей через линию EF. Точечные дефекты не группируются вокруг винтовых дислокаций.
Характеристикой дислокационной структуры является плотность дислокаций—число дислокаций, пересекающих единицу площади. В монокристаллах она составляет величину 103...106 см-2, в отожженных поликристаллических образцах 107...108 см-2, после холодной деформации 1011...I012см-2.
Наконец, к поверхностным дефектам относят границы зерен в монокристаллах, границы двойников, мозаики, поверхности раздела между твердыми фазами и свободные (внешние) поверхности кристаллов.
Основное отличие точечных дефектов от линейных и поверхностных заключается в том, что они всегда существуют в кристалле при конечной температуре. Линейные же и поверхностные дефекты возникают при росте, механической деформации или при термической обработке кристаллов. Это означает, что можно получить кристалл, не имеющий линейных и поверхностных дефектов (за исключением, конечно, внешних поверхностей), но он всегда будет содержать точечные дефекты, перечисленные выше (при этом их концентрация оказывается экспоненциальной функцией температуры).
Наличие дефектов оказывает существенное влияние на свойства кристаллов. Например, точечные дефекты наиболее сильно изменяют электрофизические и физико-химические свойства, линейные и поверхностные дефекты — механические.
Механизм кристаллизации. Фазовые превращения не происходят одновременно во всем объеме материала: любой фазовый переход заключается в зарождении мельчайших частиц новой фазы (зародышей) в локальных областях исходного вещества и последующего их роста. Возникновение центров кристаллизации, их рост и срастание и составляет процесс кристаллизации. По мере развития процесса в нем участвует все большее количество кристаллов. Поэтому сначала процесс ускоряется, но это продолжается до тех пор, пока столкновения растущих кристаллов не начнут препятствовать их росту. С этого момента рост кристаллов замедляется (это происходит, когда около 50% жидкой фазы закристаллизовано).
Если общий объем системы V, а объем исходной -фазы, перешедшей за времяtв-фазу,V, то доля превращенного за времяtобъема составит=V/V. С учетом возникновения центров кристаллизации, их роста и столкновений, уменьшающих скорость кристаллизации, процесс может быть описан уравнением:= 1 exp (-afb), где 1b4; а - постоянная.
Количественно скорость процесса кристаллизации характеризуется двумя параметрами: скоростью зародышеобразования и скоростью роста зародышей. Обе эти величины сильно зависят от степени переохлаждения. Зависимости имеют вид кривых с максимумом, при этом скорость роста кристаллов достигает максимума при меньших переохлаждениях, чем скорость зародышеобразования.
Пока кристалл окружен жидкой фазой, он имеет правильную форму. Однако при срастании или столкновении кристаллов их форма оказывается зависящей от условий соприкосновения растущих кристаллов.
Рис. 2.8. Изменение
свободной энергии (F)
от температуры (Т)
жидкость кристалл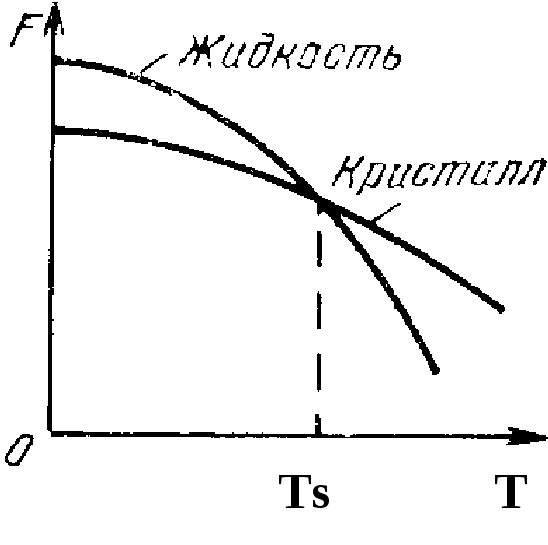

Однако поскольку при Т = Tsсостояние равновесное, то кристаллизация происходить не может. Кристаллизация начнется лишь тогда, когда свободная энергия твердого состояния окажется меньше свободной энергии жидкого, т. е. процесс будет термодинамически выгодным. Но для этого жидкость нужно охладить до температуры нижеTs. Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением. Степень переохлаждения определяется разностью теоретической и фактической температур кристаллизации.
 Рис.
2.9. Кристаллическая решетка алмаза.
Рис.
2.9. Кристаллическая решетка алмаза.
Обычно модификации обозначают греческими буквами ,,и т. д., начиная с модификаций, устойчивых при низких температурах. Например, известно несколько модификаций олова. При температуре ниже 13,3°С устойчива модификация-Sn— серое олово, хрупкое и легко разрушаемое в порошок. При температуре выше 13,3°С-Snпереходит в-Sn— белое металлическое олово, обладающее значительной пластичностью.
Некоторые твердые тела могут иметь не одну, а две и даже более кристаллических структур, устойчивых при разных температурах и давлениях. Например, кристаллы золота при высокой и низкой температурах имеют разную структуру; резко отличаются структуры кристаллов углерода при обычных условиях (графит) и при высоких давлениях и температурах (алмаз). В решетке алмаза каждый атом окружен четырьмя ближайшими соседями, расположенными в вершинах тетраэдра, с которыми он связан прочными ковалентными связями (рис.2.9). Длина связи 0,154 нм, энергия связи до 106Дж/моль. На рисунке выделена элементарная ячейка алмаза. В решетке же графита (рис.2.10) атомы углерода образуют двумерные слои. Расположение атомов в слоях таково, что каждый оказывается окруженным тремя ближайшими соседями, связанными с ним ковалентной связью. Длина связиr01= 0,142 нм, расстояние же между слоямиr02= 0,34 нм. На таком большом расстоянии действуют лишь силы Ван дер Ваальса. Поэтому энергия связи между слоями — порядка 103Дж/моль.
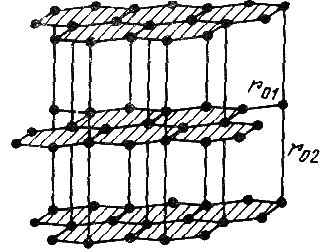 Рис.
2.10. Кристаллическая решетка графита.
Рис.
2.10. Кристаллическая решетка графита.
