
- •3. Состав системы белой крови. Разновидности лейкоцитов. Отличия гранулоцитов и агранулоцитов.
- •4.Общие свойства и функции лейкоцитов.
- •6. Лейкоцитозы. Состояния при которых они х-ны
- •7. Лейкопении, состояния, для которых они характерны
- •8.Лейкоцитарна формула та лейкоцитарний профіль , значення їх визначення у діагностиці.
- •9 Снр, клеточная и гуморальная подсистемы, объекты эффекторы, факторы, функции, механизмы действия
- •10. Иммунная система,клеточная и гуморальная подсистемы,объекты, эффекторы, функции, механизм действия.
- •11. Общая характеристика лейкопоэза, стадии, значение лейкопоэтинов.
- •14.Современные научные данные, которые дополняют фагоцитарную теорию Мечникова.
- •15. Стадии и механизмы эмиграции сквозь сосуды лейкоцитами, во время движения по крови.
- •20. О2 -независимая система бактерицидности, синтез ее компонентов.
- •21. Взаимодействие о2-зависимой и о2-независимой систем бактерицидности (бактериостатичности) в совершении киллинг эффекта фагоцитов
- •24. Возрастные особенности в количестве лейкоцитов. Двойной перекрест в соотношении нейтрофилов и лимфоцитов у детей.
- •25. Генез, структура, общие и спец. Свойства и функции нейтофилов
- •26. Генез,структура основные и специф ф-ии св-ва эозинофилов
- •28.Генез ,особенности структуры , свойства и функции тканевых базофилов
- •31. Иммунные реакции с участием в-системы.
- •32. Генез, строение, особенности и функции т-лимфоцитов
- •35.Генез,структурные особенности,виды ,свойства и функции Мкф.
- •36. Тромбоцитопоэз. Стадии, факторы и механизм регуляции. Причины и последствия тромбоцитопинии.
- •37. Структурные особенности, св-ва и ф-и тромбоцитов
- •39. Синтез та секреція тромбоцитами біологічно активних речовин-тромоцитарних факторів ,їх функціональна роль (структура та властивості)
- •40. Функциональная роль тромбоцитов в первичном и вторичном гомеостазе
- •43.Система сосудисто –тромбоцитарного гемостаза, его составляяющие, стадии, факторы и механизмы регуляции, функциональное значение
- •44. Система вторичного (гемокоагуляционного) гемостаза, стадии, механизмы действия плазменных факторов.
- •46. Внешний путь системы гемокоагуляции, каскадно-комплексная схема вторичного (гемокоагулятивного) гемостаза.
- •47.Внутренний путь системы гемокоагуляции, каскадно-комплексная схема вторичного(гемокоагуляционного) гемостаза.
- •48. Взаимосвязь первичного и вторичного гемостаза, функциональное значение.
- •1. Вазоконстрикция
- •2. Формирование временного тромбоцитарного гвоздя (гемостатической пробки)
- •52.Система фибринолиза (плазминовая ), стадии, факторы та механизмы регуляции, функциональное значение
- •53. Антикоагуляционнная система, ее функциональное значение. Отличие первичных и вторичных антикоагулянтов.
- •56.Фибринолитическая система. Механизмы ее функционирования.
- •58. Отличие гранулоцитов от агранулоцитов.
- •59. Разновидности лимфоцитов,генез,структура,св-ва
15. Стадии и механизмы эмиграции сквозь сосуды лейкоцитами, во время движения по крови.
Эмиграция лейкоцитов — активный процесс их выхода из просвета микрососудов в межклеточное пространство.
Хронологическая упорядоченность эмиграции разных видов лейкоцитов в очаг острого воспаления обусловлена стадийностью образования и экспрессии на их поверхности молекул адгезии, а также стадийностью появления факторов хемотаксиса. К последним относят факторы комплемента С5а, фактор 4 тромбоцитов, метаболиты арахидоновой кислоты, лимфокины и другие.
Процесс эмиграции последовательно проходит стадии краевого стояния лейкоцитов, их адгезии к эндотелию и проникновения через сосудистую стенку, а также направленного движения лейкоцитов в очаге воспаления (в том числе хемокинез).
На стадии краевого стояния (маргинации) условно выделено четыре последовательных этапа.
1. Выход лейкоцитов из осевого цилиндра кровяного потока и приближение к стенке микрососуда, обращенной в сторону очага воспаления.
Причины: высокая концентрация хемотаксинов (а также других агентов, в том числе токсических) у стенки микрососуда, расположенного в очаге воспаления; замедление тока крови, особенно в венулах.
2. Медленное движение лейкоцитов вдоль стенки микрососуда по поверхности клеток эндотелия («качение», rolling — роллинг).
Причины: высокое содержание медиаторов воспаления (включая хемотаксины) в очаге воспаления и выделение селектинов клетками эндотелия и тромбоцитами.
3. Активация лейкоцитов и секреция из них разнообразных соединений, среди которых особое значение имеют молекулы межклеточной адгезии — селектины. Селектины экспрессируются на поверхности клеток уже через 10—15 мин после их стимуляции. Причина экспрессии: эффекты клеточных и плазменных медиаторов воспаления.
4. Обратимая («мягкая») адгезия лейкоцитов к стенкам микрососудов.
Причина: опосредованное селектинами взаимодействие лейкоцитов и эндотелиоцитов.

Адгезия и выход лейкоцитов.
Причина плотной адгезии лейкоцитов к эндотелию: экспрессия на поверхности лейкоцитов молекул LFA1, МАС1, VLA4, других интегринов и их взаимодействие с компонентами межклеточного матрикса, комплемента и разными молекулами адгезии (например, комплекс LFA1/ICAM1 обеспечивает плотную адгезию лейкоцита к эндотелию и создаёт условия для его последующей миграции через стенку микрососуда).
Прохождение лейкоцитов через стенку микрососуда
Существенные препятствия на пути лейкоцитов: пласт клеток эндотелия, межклеточный матрикс стенки сосудов и особенно базальная мембрана эндотелия.
При прохождении лейкоцитов между клетками эндотелия происходит взаимодействие молекул LFA1, МАС1, VLA4 и других интегринов с молекулами адгезии ICAM, VCAM, CD31. –
Прохождение лейкоцитов через базальную мембрану микрососудов существенно облегчается в результате высвобождения лейкоцитами гидролитических ферментов (например, коллагеназ и эластаз). Это обеспечивает гидролиз волокон и основного вещества базальной мембраны.
Различные типы лейкоцитов (нейтрофилы, моноциты, эозинофилы, лимфоциты) используют в ходе экстравазации разный спектр молекул адгезии.
Время прохождения лейкоцитов через стенки микрососудов в очаге воспаления с момента «мягкой» адгезии лейкоцита и клетки эндотелия составляет около 3—6 мин. При значительном повышении проницаемости стенок сосудов в ткань очага воспаления пассивно выходят эритроциты и тромбоциты, что часто приводит к интоксикации организма (при сибирской язве, чуме), при поражении тканей проникающими лучами.

16. ХЕМОТАКСИС ЛЕЙКОЦИТОВ. ОСНОВНЫЕ ЭКЗОГЕННЫЕ И ЭНДОГЕННЫЕ ХЕМОКИНЫ, МЕХАНИЗМЫ ИХ ДЕЙСТВИЯ Хемотаксис — процесс активного движения лейкоцитов к химическим раздражителям (например, к продуктам протеолиза тканей). Одним из главных "пусковых" механизмов хемотаксиса считают перемещение лейкоцитов по градиенту концентрации веществ, по-явлющихся в очаге воспаления. В результате биохимических исследований были получены новые данные о том, что этот процесс существенно регулируется веществами, находящимися в плазме и экссудате и оказывающими на передвижение клеток, в частности нейтрофилов, как стимулирующее, так и ингибирующее действие. В процессе выработки этих веществ анаэробы продуцируют ингибитор хемотаксиса, что и обусловливает тяжелое течение инфекционных болезней. Различают хемотаксис положительный (движение к объекту фагоцитоза) и отрицательный (движение фагоцита от объекта фагоцитоза). Положительный хемотаксис вызывается микробами, микробными продуктами и другими хемотропными веществами (лейкотаксин, адениловые нуклеотиды). Отрицательный хемотаксис вызывают вещества, подобные хинину.
Хемокины — это специальная разновидность цитокинов, контролирующих процессы миграции и активации клеток иммунной системы. Хемокины играют важную роль в различных патофизиологических процессах — хроническом и остром воспалении, инфекционных заболеваниях, модуляции ангио-генеза, росте опухолей, пролиферации гемопоэтических стволовых клеток и др. Одно из наиболее интересных открытий состоит в демонстрации того, что некоторые хемокиновые рецепторы функционируют в качестве ко-рецепторов для вируса иммунодефицита человека (ВИЧ-1). Известно, что молекула CD4 недостаточно. Необходимо дополнительное связывание ВИЧ-1 с так называемыми ко-рецепторами, которые, как оказалось, являются рецепторами к хемокинам. Так, на макрофагах таким дополнительным ко-рецептором служит рецептор к хемокинам MIP-lalfa, MIP-l beta и RANTES. На Т-лимфоцитах дополнительным ко-рецептором служит рецептор (его назвали фузин) к хемокину SDF-1. Обнаружено, что в тех случаях, когда на поверхности макрофагов или Т-лимфоцитов у человека не экспрессировались указанные выше ко-рецепторы, такие лица были резистентны к ВИЧ-инфекции, а также к прогрессировать заболевания. Это открытие имеет очень важную практическую перспективу: искусственная блокада хемокиновых рецепторов тем или иным способом может быть использована для профилактики заражения ВИЧ-инфекцией или лечения больных СПИДом.
МЕХАНИЗМЫ ДЕЙСТВИЯ Структура и механизм передачи сигнала в этих рецепторах очень древний и реализуется как в системах движения микроорганизмов, так и при фотосинтезе. Это — так называемые родопсинподобные рецепторы, 7 раз пронизывающие клеточную мембрану и сигналящие через G-белки, которые рекрутируются и активируются цитоплазматическими доменами рецепторов после конформационых изменений, вызванных связыванием лиганда. В отличие от большинства рассмотренных выше семейств рецепторов, рецепторы хемокинов не передают транскрипционного сигнала, а через ГТФазы сигналят на систему цитоскелета, перестройки которого и ответственны за поляризацию клетки и за появление способности «ползти» в направлении градиента концентрации хемокина. Другие сигнальные каскады от этих рецепторов задействуют фосфолипазу С (PLC), которая в итоге активирует МАР-киназы и РКС. Хсмокиновых рецепторов очень много (около 20), а хемокинов — еще больше (более 100). С помощью переключения экспрессии хемокиновых рецепторов осуществляются такие важнейшие процессы врожденного иммунитета, как привлечение нейтрофилов и моноцитов в очаг первичной инфекции или миграция дендритных клеток во вторичные лимфодные органы для встречи с Т-клетками, причем вероятность этого события многократно усиливается тем, что и Т-клетки, и дендритные клетки на определенном этапе экспрессируют один и тот же вид рецепторов. КРАТКАЯ ХАРАКТЕРИСТИКА НАИБОЛЕЕ ВАЖНЫХ ХЕМОКИНОВ
Интерлейкин-8 IL-8 Моноциты, макрофаги, Т-лимфоциты, нейтрофилы, фибробласты, кератиноциты, гепатоциты, клетки эндотелия, клетки эпителия, хондроциты Стимулирует хемотаксис нейтрофилов, субпопуляций Т-лимфоцитов и базофилов; активирует нейтрофилы к выбросу ферментов лизосом, "дыхательному взрыву" и дегрануляции; повышает сродство нейтрофилов к эндотелиальным клеткам; индуцирует выход LTB4 из нейтрофилов; повышает сродство моноцитов к клеткам эндотелия Интерферон-индуцируемый протеин-10 IP-10 Т-лимфоциты, моноциты, клетки эндотелия, кератиноциты Хемоаттрактант для моноцитов и Т-лимфоцитов; повышает сродство Т-лимфоцитов к эндотелиальным клеткам Лимфотактин Т-лимфоциты Стимулятор хемотаксиса Т-лимфоцитов Макрофагальный воспалительный протеин - 1альфа MIP-1a Т-лимфоциты, В-лимфоциты, моноциты, стволовые клетки, фибробласты Стимулятор хемотаксиса моноцитов, Т-лимфоцитов и эозинофилов; подавляет пролиферацию ранних гемопоэтических стволовых клеток, эндогенный пироген Макрофагальный воспалительный протеин - 1бета MIP-1в Т-лимфоциты, В-лимфоциты, моноциты, стволовые клетки, фибробласты Стимулятор хемотаксиса моноцитов и Т-лимфоцитов; стимулирует сродство Т-лимфоцитов к клеткам эндотелия Моноцитарный хемотаксический протеин-1/Моноцитарный хемотаксический и активирующий фактор MCP-1/MCAF Моноциты, макрофаги, фибробласты, В-лимфоциты, эндотелиальные клетки, кератиноциты, гладкомышечные клетки Стимулятор хемотаксиса моноцитов; стимулирует высвобождение гистамина из базофилов; регулирует продукцию цитокинов моноцитами РАНТЕС (RANTES) Т-лимфоциты, тромбоциты Стимулятор хемотаксиса моноцитов, Т-лимфоцитов, эозинофилов и базофилов; стимулирует высвобождение гистамина из базофилов Фактор роста меланомы GROa/MGSA Фибробласты, хондроциты, эпителиальные клетки, моноциты, макрофаги, нейтрофилы, тромбоциты Стимулятор хемотаксиса нейтрофилов, активирует нейтрофилы; стимулирует пролиферацию клеток меланомы
17.Значение опсонизации в поглощении фагоцитами обьектов фагоцитоза.
Способность фагоцитов различать элементы организма-хозяина («свое») от чужеродных и потенциально опасных инфекционных агентов обеспечивается системой рецепторов, которые получили название паттерн-распознающие рецепторы или рецепторы, распознающие образцы (в частности, образцы патогенности) – PRRs (pattern recognition receptors). Эти рецепторы распознают консервативные структуры и последовательности, характерные исключительно для чужеродных, внедрившихся в организм агентов. Они закодированы в геноме и имеют ограниченное разнообразие. Такие консервативные паттерны называются образцами патогенности (PAMPs – pathogen-associated molecular patterns). Однако параллельно с запустившимся фагоцитозом происходит ряд иных иммунных реакций врожденного иммунитета, обеспечивающих защиту от повреждающего патогенна. Сюда относится и активация системы комплемента, с последующей опсонизацией его продуктами (о них будет упомянуто несколько позже), и развитие реакции воспаления с параллельным протеканием хемотаксических реакций (в частности, главными хемотаксическими факторами являются IL-8, TNF-, анафилатоксины C3а, С4а и С5а; IL-1, LTB4 (лейкотриен В4), дегрануляция макрофагов (это событие они осуществляют не так часто, как нейтрофилы) и нейтрофилов при задействовании TLRs (Toll-like receptors) (в том числе и выброс провоспалительных и хемотаксических факторов), опсонизация антителами (преимущественно IgA и IgG), белками SP-A и SP-D (surfactant proteins, представленные обильно в дыхательном тракте), CRP (C-reactive protein) MBL (mannose binding lectin) и другие важные в защите организма процессы.
Несмотря на то, что фагоцитоз может активироваться непосредственно PAMPs, многие инфекционные агенты научились варьировать своими антигенными характеристиками, таким образом избегая фагоцитоза и дальнейшего киллинга. Однако для того, чтобы повысить эффективность фагоцитоза, ускорить его и избежать «обмана» инфекционных агентов иммунной системой предусмотрен процесс, называющийся опсонизация (от греч. языка opsonin - «делать вкуснее»). Все эти растворимые белки, ускоряющие фагоцитоз, т.е. опосредующие опсонизацию, называются опсонинами. Мишенями опсонинов являются оглеводные структуры, липополисахариды, вирусные белки. Следовательно, они иногда обозначаются как растворимые паттерн-распознающие белки.
Рецепторы, способные запускать фагоцитоз, делятся на 2 типа:
1) рецепторы PAMPs;
2) рецепторы опсонинов.
Рассмотрим рецепторы опсонинов и все, что относится к процессу опсонизации.
Рецепторы опсонинов (а также основные опсонины, которые улавливаются соответствующими рецепторами):
а)collagen-domain receptor CD91/кальретикулин (кальретикулин необходим для встраивания олигосахаридных участков с терминальными остатками глюкозы для дальнейшего процессинга рецептора; постоянно обновляющийся рецептор), распознающий коллагеноподобные участки белков семейства коллектинов (MBL, SP-A, SP-D), семейства фиколинов (L-ficolin; название семейства происходит от Fi-Col-Lin = Fibrinogen (fibronectin domain)-containing (содержащий фибронектиновые домены), Collagen-like stalk containing (содержащий коллагеноподобный ствол/столб), possess Lectin activiti (обладает активностью лектинов) и C1q-белка системы комплемента;
б) рецепторы комплемента: CR1 (C3b/C4b рецептор), CR3 (рецептор для C4b и iC3b), CR4 (iC3b) и некоторые другие;
в) Fc-рецепторы: FcR (рецептор к константным регионам (Fc-фрагментам) тяжелых -цепей IgA), FcR (рецептор к Fc-фрагментам тяжелых -цепей IgG, а также к CRP (C-reactive protein).
В результате связывания лиганда с рецептором возникают так называемые DS (danger signals). Передача таких сигналов с участием ядерного фактора транскрипции B инициирует процесс фагоцитоза (путем каскада биохимических реакций), а также последующий синтез высокореактивных соединений для киллинга бактерий, провоспалительные цитокины и др.
Рассмотрим характеристику некоторых опсонинов. Достаточно специфическим являются белки-коллектины сурфактанта, упомянутые выше, - SP-A и SP-D. Они обнаруживаются в крови, а также в слизистых секретах в легких и других серкетирующих слизь сайтах, где функционируют как опсонины. Разница между ними заключается в том, что SP-A может связываться только с обильной мукополисахаридной оболочкой (капсулой) бактерий (например, Klebsiella pneumonia), в то время как SP-D связывается только непосредственно с липополисахаридной оболочкой неинкапсулированных форм бактерий. Связывает данные коллектины рецептор CD91, что ускоряет фагоцитарную активность альвеолярной популяции макрофагов, а также других, где присутствуют данные опсонины. Также белки сурфактанта способствуют устранению грибкового респираторного патогена Pneumocystis carinii, главному возбудителю пневмонии у больных СПИДом.
Mannose-binding lectin (MBL) (маннан (маннозо)-связывающий лектин) также является коллектином и обнаруживается в крови и респираторных жидкостях. На фагоцитах имеются соответвующие рецепторы к MBL (CD91), связывающие его коллагено-подобные стволовые домены и активирующие фагоцитоз.
Фиколины (M-, L- и H-) представляют собой отдельное семейство опсонинов, родственных MBL и другим коллектинам. Обнаруживаются в крови, где и связывают ацетилированные сахара на поверхности микроорганизмов. Компонент системы комплемента C1q (С1) также функционирует в качестве опсонина, связывая компоненты клеточных стенок бактерий, такие как липополисахариды, а также связывает вирусные белки (через уже связанный с ними IgG, либо непосредственно). Все вышеперечисленные опсонины имеют структурное сходство и обладают сериновыми протеазами, т.е. участвуют в активации системы комплемента как по классическому, так и по лектиновому пути.
С-реактивный белок (C-reactive protein – CRP) распознает фосфорилхолин и углеводы на бактериях, грибах и паразитах и затем связывается посредством FcRs, находящихся на большинстве фагоцитов, с IgG (IgG4 не участвует в активации СК, а также не проявляет достаточной опсонирующей активности). Также имеются FcRs к IgA, который также обладает опсонирующей активностью.
Таким образом, фагоцитарная активность значительно ускоряется и ее эффективность повышается при протекании процессов опсонизации. Можно провести параллель с катализаторами химических реакций, что если бы их не было, то и такой динамики биохимических процессов можно было бы и не ожижать.
18.
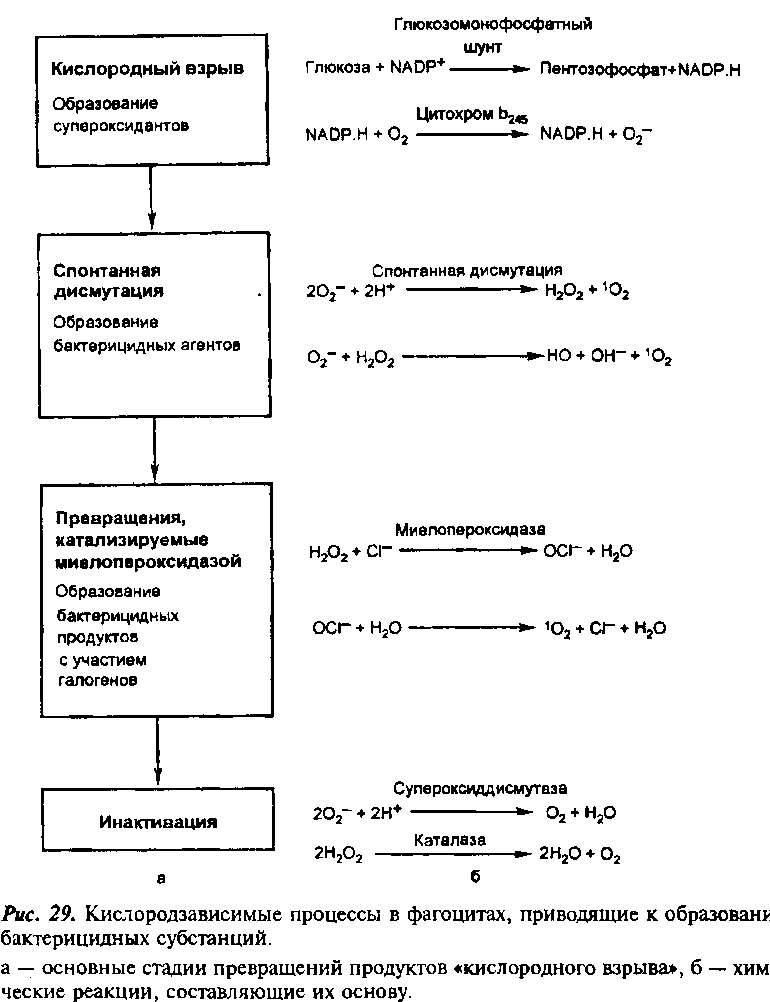
Кислородзависимые факторы бактерицидности
В обеспечении киллинга фагоцитированных микроорганизмов наиболее важна роль производных кислорода. Главное событие в образовании кислородзависимых бактерицидных факторов — кислородный взрыв — быстрое (реализуемое за секунды) и высокопродуктивное осуществление цепи реакций, приводящих к образованию активных форм кислорода. Активные формы кислорода включают высокореактивные свободные радикалы, ионы кислорода и кислородсодержащих химических групп. Образование активных форм кислорода катализируется ферментом NADPH-оксидазой (NADPH — восстановленная форма
никотинамиддинуклеотидфосфата), называемой также оксидазой фагоцитов (Phоx).(подробнее о NADPH-оксидазе в 62-м вопросе)
Образование активных форм кислорода.Конформационные изменения, происходящие при сборке NADPH-оксидазы, приводят к тому, что ее основной компонент gp91phox приобретает способность взаимодействовать с окисленной формой кофактора, образующегося при гликолизе, — NADPH. Это взаимодействие происходит при участии простетической группы FAD (флавин адениндинуклеотид)
и двух молекул гема. FAD получает электрон (е-) от NADPH и передает его ≪наружной≫ молекуле гема, обращенной к цитозолю, от которой он переходит к ≪внутренней≫ молекуле гема, обращенной к содержимому фагосомы. Внутренняя молекула гема передает электрон молекуле кислорода, что приводит к образованию супероксида , объединяющего в себе свойства аниона и радикала, и потому называемого супероксидрадикалом,или супероксиданионом (*О2Ї). Супероксидрадикал — короткоживущий родоначальник активных форм кислорода (рис. 2.29). В начальную фазу фагоцитоза супероксиданион, образующийся на участке клеточной мемб-
раны, находится во внутриклеточном пространстве; после формирования фагосомы и фаголизосомы он поступает внутрь этих гранул. На следующем этапе реализуется цепь реакций, приводящих к образованию радикалов, ионов кислорода и содержащих их молекул, обладающих более высокой бактерицидной активностью чем супероксианион, —активных форм кислорода. Под действием фермента супероксиддисмутазы из двух молекул супероксидного аниона образуется перекись водорода. В присутствии ионов Fe2+ супероксид взаимодействует с перекисью водорода
с образованием гидроксил-радикала (*ОН) (см. рис. 2.29) — сильного окислителя. Перекись водорода и особенно гидрокисл-радикал обладают очень сильной бактерицидной активностью. При их совместном действии происходит перекисное окисление липидов, разрыв пептидных связей, окисление сульфгидрильных групп и другие глубокие химические изменения макромолекул в клеточных стенках патогенов, приводящие к их гибели. При мутациях генов, кодирующих субъединицы NADPH-оксидазы, нарушается активность этого фермента и, как следствие, развивается хроническая гранулематозная болезнь.
Кислородзависимые факторы бактерицидности, индуцируемые миелопероксидазой
Миелопероксидаза — маркерный фермент азурофильных гранул нейтрофилов. Она составляет 1–5% общего белка этих клеток. Зрелая молекула миелопероксидазы — гетеродимер, образованный тяжелой α- и легкой β-цепями. С α-цепью связана железосодержащая группа — гем.Миелопероксидазная микробицидная система включает, помимо собственно миелопероксидазы, перекись водорода и кофакторы, в том числе ионы галогенов (Cl-, I-, Br-).Миелопероксидаза катализирует в фаголизосомах окислительные реакции. Превращение йодида (I-) в молекулярный йод (при участии миелопероксидазы и перекиси водорода) обеспечивает его связывание с сульфгидрильными группами белков, приводящее к нарушению жизнеспособности микроорганизмов. При катализируемом миелопероксидазой взаимодействии ионов Cl- с перекисью водорода образуется сильный микробицидный
агент — хлорноватистая (гипохлорная) кислота HOCl. При ее взаимодействии с аминокислотами образуются хлорамины, обладающие бактерицидным действием. При окислении хлорноватистой кислоты супероксидом образуется гидроксильный радикал *ОН, а при ее оксилении перекисью водорода —синглетный кислород ‘О2 (см. рис. 2.29) Эти метаболиты обладают сильной микробицидной активностью. Синглетный кислород особенно активно взаимодействует с полиненасыщенными жирными кислотами, вызывая их перекисное окисление, нарушающее целостность мембраны бактерий. Синглетный кислород участвует в образовании еще одного микробицидного вещества — озона (О3). Нейтрофилы — наиболее эффективные продуценты активных форм кислорода. К этим агентам чувствительны разные типы микроорганизмов, в первую очередь — внеклеточные патогены.
19.
О2-зависимая система исходно не предсуществует, а образуется в результате РВ.
Респираторный взрыв- процесс, характеризующийся:
Поглощением О2 из крови и тканей
Использованием О2 на продукцию оксидантов
Интенсификация ПФП в ходк которого продуцируется NADPH+
Последовательность этих трех процессов приводит к образованию О2-зависимой системы.
Он может происходить на двух стадиях:
Стадия опсонизации дляться чуть меньше минуты
В фагосоме
NADOH-оксидазный комплекс находится или в плазмолемме фагоцита или в мембране фагосомы.Он состоит из НАДФН оксидазы, флавоноидов, убихинона и цитохрома b(обычно это450) по эелементам этой цепи движется е-, котрый присоединяется к О2 и образует супероксидный анион.



В ходе этих реакций образуются первичные оксиданты : супероксид, синглетный кислород ОН-,Н2О2.
Глутатион легко окисляется (S-H) , чем обезврежиает оксиданты,но каждыйц раз должен восстанавливаться с помощью глутатионредуктазы, Ко-фактор которой НАФН.
Оксиданты могут действовать в фагосоме, в цитоплазме фагоцита и в мало м радиусе за его пределами. Они могут повреждать структуры собственного организма.
Вторичные оксиданты образуются в ходе реакций с первичными оксидантами
Это гипохлорная кислота,хлорамины и продукты перекисного окисления( в основном липидов – метаболиты арахидоновой кислоты, но перекисному окислению также могут подвергаться белки и НК).
К кислород зависимым системам бактерицидности относят миелопероксидазную систему: фермент миелопероксидаза,Н2О2, и галогены :Хлор,Йод, Бром и Фтор.(имеется наследственный дефект – качественная недостаточность этого фермента) – этой системы чувствительны Г+ и Г- бактерии, вирусы грибки, простейшие гельминты.
Также в ходе РВ выделяетсяNO. Оказывает бактерицидный эффект в комплексе с супероксидом, образуя при этом пероксинитрит. Наиболее чувствительны к этому грибки, простейшие и микобактерии, обладает туморицидным эффектом, убивает опухолевые клетки
