
- •3. Состав системы белой крови. Разновидности лейкоцитов. Отличия гранулоцитов и агранулоцитов.
- •4.Общие свойства и функции лейкоцитов.
- •6. Лейкоцитозы. Состояния при которых они х-ны
- •7. Лейкопении, состояния, для которых они характерны
- •8.Лейкоцитарна формула та лейкоцитарний профіль , значення їх визначення у діагностиці.
- •9 Снр, клеточная и гуморальная подсистемы, объекты эффекторы, факторы, функции, механизмы действия
- •10. Иммунная система,клеточная и гуморальная подсистемы,объекты, эффекторы, функции, механизм действия.
- •11. Общая характеристика лейкопоэза, стадии, значение лейкопоэтинов.
- •14.Современные научные данные, которые дополняют фагоцитарную теорию Мечникова.
- •15. Стадии и механизмы эмиграции сквозь сосуды лейкоцитами, во время движения по крови.
- •20. О2 -независимая система бактерицидности, синтез ее компонентов.
- •21. Взаимодействие о2-зависимой и о2-независимой систем бактерицидности (бактериостатичности) в совершении киллинг эффекта фагоцитов
- •24. Возрастные особенности в количестве лейкоцитов. Двойной перекрест в соотношении нейтрофилов и лимфоцитов у детей.
- •25. Генез, структура, общие и спец. Свойства и функции нейтофилов
- •26. Генез,структура основные и специф ф-ии св-ва эозинофилов
- •28.Генез ,особенности структуры , свойства и функции тканевых базофилов
- •31. Иммунные реакции с участием в-системы.
- •32. Генез, строение, особенности и функции т-лимфоцитов
- •35.Генез,структурные особенности,виды ,свойства и функции Мкф.
- •36. Тромбоцитопоэз. Стадии, факторы и механизм регуляции. Причины и последствия тромбоцитопинии.
- •37. Структурные особенности, св-ва и ф-и тромбоцитов
- •39. Синтез та секреція тромбоцитами біологічно активних речовин-тромоцитарних факторів ,їх функціональна роль (структура та властивості)
- •40. Функциональная роль тромбоцитов в первичном и вторичном гомеостазе
- •43.Система сосудисто –тромбоцитарного гемостаза, его составляяющие, стадии, факторы и механизмы регуляции, функциональное значение
- •44. Система вторичного (гемокоагуляционного) гемостаза, стадии, механизмы действия плазменных факторов.
- •46. Внешний путь системы гемокоагуляции, каскадно-комплексная схема вторичного (гемокоагулятивного) гемостаза.
- •47.Внутренний путь системы гемокоагуляции, каскадно-комплексная схема вторичного(гемокоагуляционного) гемостаза.
- •48. Взаимосвязь первичного и вторичного гемостаза, функциональное значение.
- •1. Вазоконстрикция
- •2. Формирование временного тромбоцитарного гвоздя (гемостатической пробки)
- •52.Система фибринолиза (плазминовая ), стадии, факторы та механизмы регуляции, функциональное значение
- •53. Антикоагуляционнная система, ее функциональное значение. Отличие первичных и вторичных антикоагулянтов.
- •56.Фибринолитическая система. Механизмы ее функционирования.
- •58. Отличие гранулоцитов от агранулоцитов.
- •59. Разновидности лимфоцитов,генез,структура,св-ва
48. Взаимосвязь первичного и вторичного гемостаза, функциональное значение.
Сосудисто-тромбоцитарный (первичный) гемостаз.
Благодаря этому механизму происходит остановка кровотечения из мелких сосудов с низким артериальным давлением. При травме наблюдается рефлекторный спазм поврежденных кровеносных сосудов, который в дальнейшем поддерживается сосудосуживающими веществами (серотонин, норадреналин, адреналин), освобождающимися из тромбоцитов и поврежденных клеток тканей.
Внутренняя стенка сосудов в месте повреждения изменяет свой заряд с отрицательного на положительный. Благодаря способности к адгезии под влиянием фактора Виллебранда, содержащегося в субэндотелии и кровяных пластинках, отрицательно заряженные тромбоциты прилипают к положительно заряженной раневой поверхности. Практически одновременно происходит агрегация – скучиванье и склеивание тромбоцитов с образованием тромбоцитарной пробки, или тромба. Сначала под влиянием АТФ, АДФ и адреналина тромбоцитов и эритроцитов образуется рыхлая тромбоцитарная пробка, через которую проходит плазма (обратимая агрегация). Затем тромбоциты теряют свою структурность и сливаются в однообразную массу, образуя пробку, непроницаемую для плазмы (необратимая агрегация). Эта реакция протекает под действием тромбина, образующегося в небольших количествах под действием тканевого тромбопластина.
Тромбин разрушает мембрану тромбоцитов, что ведет к выходу из них серотонина, гистамина, ферментов, факторов свертывания крови. Пластинчатый фактор 3 дает начало образованию тромбоцитарной протромбиназы, что приводит к образованию на агрегатах тромбоцитов небольшого количества нитей фибрина, среди которых задерживаются эритроциты и лейкоциты. После образования тромбоцитарного тромба происходит его уплотнение и закрепление в поврежденном сосуде за счет ретракции кровяного сгустка. Ретракция осуществляется под влиянием тромбостенина тромбоцитов за счет сокращения актин-миозинового комплекса тромбоцитов. Тромбоцитарная пробка образуется в целом в течение 1 – 3 минут с момента повреждения, и кровотечение из мелких сосудов останавливается.
В крупных сосудах тромбоцитарный тромб не выдерживает высокого давления и вымывается. Поэтому в крупных сосудах гемостаз может быть осуществлен путем формирования более прочного фибринового тромба, для образования которого необходим ферментативный коагуляционный механизм.
Коагуляционный (вторичный) гемостаз.
Свертывание крови – это цепной ферментативный процесс, в котором последовательно происходит активация факторов свертывания и образование их комплексов. Сущность свертывания крови заключается в переходе растворимого белка крови фибриногена в нерастворимый фибрин, в результате чего образуется прочный фибриновый тромб.
Процесс свертывания крови осуществляется в 3 последовательные фазы.
Первая фаза является самой сложной и продолжительной. Во время этой фазы происходит образование активного ферментативного комплекса – протромбиназы, являющейся активатором протромбина. В образовании этого комплекса принимают участие тканевые и кровяные факторы. В результате формируются тканевая и кровяная протромбиназы. Образование тканевой протромбиназы начинается с активации тканевого тромбопластина, образующегося при повреждении стенок сосуда и окружающих тканей. Вместе с VII фактором и ионами кальция он активирует X фактор. В результате взаимодействия активированного X фактора с V фактором и с фосфолипидами тканей или плазмы образуется тканевая протромбиназа. Этот процесс длится 5 – 10 секунд.
Образование кровяной протромбиназы начинается с активации XII фактора при его контакте с волокнами коллагена поврежденных сосудов. В активации и действии XII фактора участвуют также высокомолекулярный кининоген (ф XV) и калликреин (ф XIV). Затем XII фактор активирует XI фактор, образуя с ним комплекс. Активный XI фактор совместно с IV фактором активирует IX фактор, который, в свою очередь, активирует VIII фактор, Затем происходит активация X фактора, который образует комплекс с V фактором и ионами кальция, чем и заканчивается образование кровяной протромбиназы. В этом также участвует тромбоцитарный фактор 3. Этот процесс длится 5-10 минут.
Вторая фаза. Во время этой фазы под влиянием протромбиназы происходит переход протромбина в активный фермент тромбин. В этом процессе принимают участие факторы IV, V, X.
Третья фаза. В эту фазу растворимый белок крови фибриноген превращается в нерастворимый фибрин, образующий основу тромба. Вначале под влиянием тромбина происходит образование фибрин-мономера. Затем с участием ионов кальция образуется растворимый фибрин-полимер (фибрин “S”, soluble). Под влиянием фибринстабилизирующего фактора XIII происходит образование нерастворимого фибрин-полимера (фибрин “I”, insoluble), устойчивого к фибринолизу. В фибриновых нитях оседают форменные элементы крови, в частности эритроциты, и формируется кровяной сгусток, или тромб, который закупоривает рану.
После образования сгустка начинается процесс ретракции, т.е. уплотнения и закрепления тромба в поврежденном сосуде. Это происходит с помощью сократительного белка тромбоцитов тромбостенина и ионов кальция. Через 2 – 3 часа сгусток сжимается до 25 – 50% от своего первоначального объема и идет отжатие сыворотки, т.е. плазмы, лишенной фибриногена. За счет ретракции тромб становится более плотным и стягивает края раны.
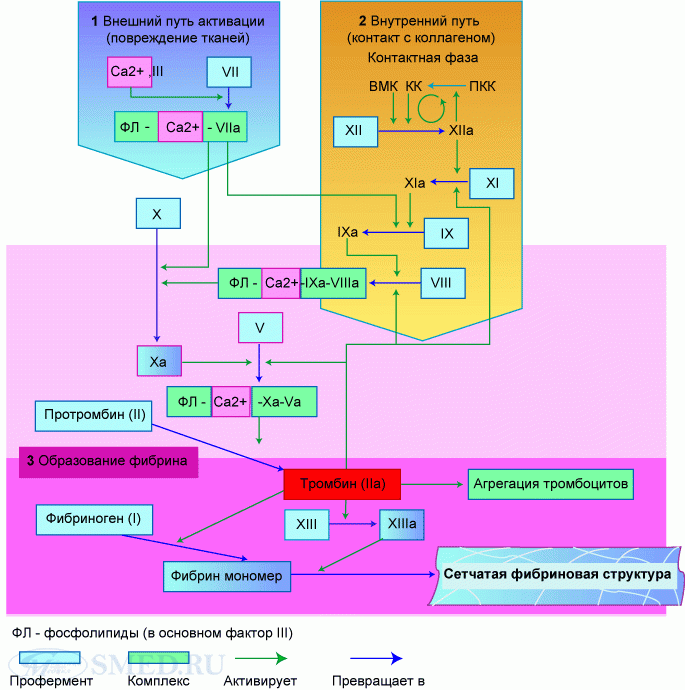
Рисунок 10. Схема свёртывания крови согласно модели коагуляционного каскада. 1 – внешний путь активации свёртывания крови, 2 – внутренний путь активации свёртывания крови, 3 – образование фибрина (общий путь свёртывания крови). ФЛ – фосфолипиды (в основном тромбоцитарный фактор 3); ВМК – высокомолекулярный кининоген; КК – калликреин; ПКК – прекалликреин.
49
Различают два механизма гемостаза:
Сосудисто-тромбоцитарный (микроциркуляторный, первичный).
Коагуляционный (вторичный, свёртывание крови).
Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах (в сосудах микроциркуляторного русла), где имеются низкое кровяное давление и малый просвет сосудов (до 100 мкм). В них остановка кровотечения может произойти за счёт:
Сокращения стенок сосудов.
Образования тромбоцитарной пробки.
Сочетания того и другого.
Коагуляционный гемостаз обеспечивает остановку кровотечения в более крупных сосудах (артериях и венах). В них остановка кровотечения осуществляется за счёт свёртывания крови (гемокоагуляции).
Полноценная гемостатическая функция возможна только при условии тесного взаимодействия сосудисто-тромбоцитарного и гемокоагуляционного механизмов гемостаза. Тромбоцитарные факторы принимают активное участие в коагуляционном гемостазе, обеспечивают конечный этап формирования полноценной гемостатической пробки – ретракцию кровяного сгустка. В то же время плазменные факторы непосредственно влияют на агрегацию тромбоцитов. При ранениях как мелких, так и крупных сосудов происходит образование тромбоцитарной пробки с последующим свёртыванием крови, организацией фибринового сгустка, а затем – восстановление просвета сосудов (реканализация путём фибринолиза).
Реакция на повреждение сосуда зависит от разнообразных процессов взаимодействия между сосудистой стенкой, циркулирующими тромбоцитами, факторами свёртывания крови, их ингибиторами и фибринолитической системой. Гемостатический процесс модифицируется посредством положительной и отрицательной обратной связи, которая поддерживает стимуляцию констрикции сосудистой стенки и образование комплексов тромбоциты-фибрин, а также растворение фибрина и релаксацию сосудов, что позволяет вернуться к нормальному состоянию.
Для того чтобы кровоток в обычном состоянии не нарушался, а при необходимости наступало эффективное свёртывание крови, необходимо поддержание равновесия между факторами плазмы, тромбоцитов и тканей, способствующими свёртыванию и тормозящими его. Если это равновесие нарушается, возникает либо кровотечение (геморрагические диатезы), либо повышенное тромбообразование (тромбозы).
здорового человека кровотечение из мелких сосудов при их ранении останавливается за 1-3 минуты (так называемое время кровотечения). Этот первичный гемостаз почти целиком обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов – «белым тромбом». В крови тромбоциты пребывают в неактивированном состоянии. Их активация наступает в результате контакта с активирующей поверхностью и действия некоторых факторов свёртывания. Активированные тромбоциты выделяют ряд веществ, необходимых для гемостаза.
Адгезия тромбоцитов и спазм сосудов
Нормальный эндотелий действует как мощная антикоагулянтная поверхность, которая не активирует белки свёртывания крови и не привлекает к себе клеточные компоненты крови. Но после стимуляции или травмы эндотелий трансформируется в мощную прокоагулянтную поверхность. При повреждении эндотели происходит прилипание (адгезия) тромбоцитов к субэндотелиально расположенным волокнам коллагена. Этот процесс опосредован олигмерным гликопротеином, содержащимся в субэндотелии и кровяных пластинках – фактором фон Виллебранда (ФВ). Фактор Виллебранда содержится также в плазме, где с ним связан фактор свёртывания VIII (поэтому фактор Виллебранда раньше называли антигеном, связанным с фактором VIII). Фактор Виллебранда образует мостики между субэндотелиальными структурами и специфическими рецепторами (гликопротеином Ib) в мембране тромбоцитов (рис. 5). У больных с наследственным дефицитом гликопротеина Ib процесс адгезии тромбоцитов нарушается (болезнь Бернара-Сулье). При дефиците фактора Виллебранда (болезнь Виллебранда) адгезия также страдает.
В процессе адгезии происходит активация тромбоцитов. Изменяется их форма – они становятся округлыми клетками с шиповидными отростками, с помощью которых связываются с другими тромбоцитами – начинается их агрегация. Коллаген субэндотелия и образующийся локально тромбин (см. раздел коагуляционный гемостаз) заставляют прилипшие тромбоциты секретировать содержимое гранул: фактор Виллебранда усиливает адгезию, сосудосуживающие вещества (серотонин, катехоламины, тромбоцитарный фактор роста - ТФР) уменьшают просвет сосудов, который перекрывается массой тромбоцитов, прилипших к коллагеновым волокнам. Кровоток замедляется.
Агрегация тромбоцитов
Коллаген и тромбин также стимулируют фосфолипазы тромбоцитарной мембраны, освобождая арахидоновую кислоту из её фосфолипидного слоя. Арахидоновая кислота посредством тромбоцитарной циклооксигеназы (ЦОГ-1) превращается в простагландины, из которых образуются тромбоксаны . Указанные простагландины, TxA 2 вместе с выделяемыми из гранул тромбоцитов аденозиндифосфатом (АДФ) и фактором активации тромбоцитов (ФАТ) инициируют необратимую агрегацию циркулирующих тромбоцитов (из которых, в свою очередь, также выделяются биологически активные вещества) и закрытие участка поражения тромбоцитарной «пробкой» . Тромбоксан А 2 , кроме того, усиливает суживание сосудов. При распаде тромбоцитов в среду выходят фосфолипопротеины их мембраны – тромбоцитарный фактор 3, участвующий в коагуляционном гемостазе (служит матрицей, на поверхности которой происходит формирование теназного и протромбиназного комплексов).
Для необратимой агрегации тромбоцитов необходим также фибриноген. Это вещество не только служит предшественником фибрина, образующего сеть, в которой запутываются тромбоциты в ходе образования сгустка (коагуляционный гемостаз), но также вступает в специфическую реакцию с рецепторами активированных кровяных пластинок (гликопротеинами IIb и IIIa). Эти гликопротеины также обеспечивают взаимодействие тромбоцитов с субэндотелиально расположенным фибронектином, способствуя адгезии. У больных с недостатком гликопротеинов IIb/IIIa наблюдается повышенная кровоточивость, хотя количество тромбоцитов у них не снижено (тромбастения Гланцмана-Негели). Полагают, что подобно фибриногену действуют гликопротеины фибронектин и тромбоспондин, содержащиеся в альфа-гранулах кровяных пластинок.
На периферии тромбоцитарной пробки происходит дезагрегация тромбоцитов из-за выделения антиагрегантов, в частности простациклина (PGI2), окиси азота (NO), аденозиндифосфотазы (АДФазы) и других ферментов, синтезируемых интактными соседними эндотелиальными клетками.
Такой первичной тромбоцитарной пробки достаточно для того, чтобы начался гемостаз, и незамедлительно остановилось развившееся кровотечение, но сама по себе она не в состоянии длительное время поддерживать целостность сосуда.
Точная последовательность событий, происходящих при активации тромбоцитов, пока не выяснена. Это связано, в частности, с тем, что на некоторых этапах существует положительная обратная связь – активированные тромбоциты выделяют вещества, которые в свою очередь вызывают активацию тромбоцитов. В качестве примеров можно привести действие АДФ и петлю обратной связи, включающую активацию тромбоцитарного фактора 3 и эффект тромбина (рис. 8). Эти взаимодействия приводят к лавинообразному усилению процесса, т.е. тромбоциты всё быстрее вовлекаются в реакцию
Коагуляционный гемостаз
После того как образуется тромбоцитарный сгусток, степень сужения поверхностных сосудов уменьшается, что могло бы привести к вымыванию сгустка и возобновлению кровотечения. Однако к этому времени уже набирают достаточную силу процессы коагуляции фибрина в ходе вторичного гемостаза, обеспечивающего плотную закупорку повреждённых сосудов тромбом («красным тромбом»), содержащим не только тромбоциты, но и другие клетки крови, в частности эритроциты.
Постоянная гемостатическая пробка формируется при образовании тромбина посредством активации свёртывания крови. Тромбин играет важную роль в возникновении, росте и локализации гемостатической пробки. Он вызывает необратимую агрегацию тромбоцитов (неразрывная связь коагуляционного и сосудисто-тромбоцитарного звеньев гемостаза) и отложение фибрина на тромбоцитарных агрегатах, образующихся в месте сосудистой травмы. Фибрино-тромбоцитарная сеточка является структурным барьером, предотвращающим дальнейшее вытекание крови из сосуда, и инициирует процесс репарации ткани.
Свёртывающая система крови – это фактически несколько взаимосвязанных реакции, протекающих при участии протеолитических ферментов. На каждой стадии данного биологического процесса профермент (неактивная форма фермента, предшественник, зимоген) превращается в соответствующую сериновую протеазу. Сериновые протеазы гидролизуют пептидные связи в активном центре, основу которого составляет аминокислота серин. Тринадцать таких белков (факторы свёртывания крови) составляют систему свёртывания их принято обозначать римскими цифрами, активированную форму обозначают прибавлением индекса «а» (ФVIIа – активированный фактор VIII). Фибриноген (фактор I) является субстратом для образования фибрина, конечного продукта реакций свёртывания крови.
Для осуществления многих реакций коагуляционного гемостаза необходимы ионы кальция.
50.
Сосудисто-тромбоцитарный гемостаз представляет собой спонтанную задержку или предотвращение кровотечения в поврежденных сосудах, диаметр которых не превышает 100 мкн. Данный физиологический процесс делится на 3 основных этапа:
вазоконстрикция
формирование временного тромбоцитарного (гемостатического) гвоздя;
формирование окончательного кровяного сгустка.
