
- •10.Диссоциация воды, ионное произведение воды. РН растворов. Водно-электролитный баланс в организме человека. РН биологических жидкостей.
- •11.Буферные растворы, классификация буферных растворов. Механизм буферного действия. РН буферных растворов. Уравнение Хендериксона-Хоссельбаха для буферных растворов кислотного и основного типов.
- •12.Буферные растворы. Буферная емкость. Буферные системы в организме человека, их роль в поддержании гомеостаза рН. Буферные системы крови.
- •17.Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. Температурный коэффициент химических и биохимических процессов. Понятие об энергии активации
- •18.Обратимые и необратимые реакции. Константа равновесия. Принцип Ле-Шателье.
- •19.Поверхностные явления. Поверхностное натяжение жидкостей. Поверхностно-активные и поверхностно-неактивные вещества. Правило Дюкло-Траубе. Сорбционные процессы: адсорбция, абсорбция, хемосорбция.
- •20.Адсорбция на поверхности раздела жидкость-газ и жидкость-жидкость. Уравнение Гиббса. Ориентация молекул в поверхностном слое. Представления о структуре биологических мембран.
- •21.Адсорбция на поверхности раздела твердое вещество-газ. Факторы, определяющие адсорбцию на поверхности твердого тела. Уравнение Ленгмюра. Физическая и химическая адсорбция.
- •23.Дисперсные системы. Классификация дисперсных систем по степени дисперсности. Коллоидное состояние. Лиофильные и лиофобные коллоидные системы.
- •26.Понятие о лиофобных золях. Мицелярная теория строения лиофобных золей.
- •27.Устойчивость коллоидных систем. Агрегационная и седиментационная устойчивость. Коагуляция. Коагуляция под действием сильных электролитов. Порог коагуляции. Правила Шульца-Гарди. Коллоидная защита.
- •29.Факторы термодинамической устойчивости растворов вмс. Методы осаждения белков. Особенности высаливания биополимеров из растворов. Коацервация и денатурация белков.
27.Устойчивость коллоидных систем. Агрегационная и седиментационная устойчивость. Коагуляция. Коагуляция под действием сильных электролитов. Порог коагуляции. Правила Шульца-Гарди. Коллоидная защита.
Устойчивость коллоидных систем-это способности системы сохранять неизменные размеры частиц дисперсной фазы и их равномерное распределение в дисперсионной среде.
Коллоидные системы могут существовать длительное время, устойчивы с дисперсных систем делятся на 2 вида: кинетическую(седиментационная-осаждение) и агрегатную.
Кинетическая определяется способностью системы противодействовать оседанию.
Агрегативность-это способность сохранять неизменную первоначальный размер частиц.
КОАГУЛЯЦИЯ (от лат. coagulatio—створаживание), характерный для коллоидных растворов (золей) процесс, заключающийся либо в выпадении дисперсной фазы в осадок либо в застывании всего коллоидного раствора в студень— гель. В обоих случаях имеет место слияние отдельных мельчайших частиц дисперсной фазы, их укрупнение, или агрегация.
Коагуляция под действием сильных электролитов.
Коллоидные растворы очень чувствительны к присутствию посторонних электролитов и коагуляция может быть вызвана даже присутствием малых их количеств. Например, коагуляция наступает очень быстро, практически сразу же после образования золя, если он был получен в плохо вымытой посуде, сохранившей следы солей, содержащихся в водопроводной воде. Однако в присутствии каких-то определённых очень малых количеств электролита-ко-а-гулятора коллоидные растворы способны сохранять агрегативную устойчивость. Наименьшая концентрация электролита, вызывающая явную коагуляцию коллоидного раствора, называется порогом коагуляции . Экспериментально порог коагуляции может быть определён постепенным (например, из бюретки) добавлением к исследуемому золю раствора электролита-коагу-ля-то-ра. Другой способ определения - приготовление серии растворов электролита с равномерно увеличивающейся концентрацией с последующим добавлением к ним одинаковых объёмов золя. Наступление коагуляции может отмечаться визуально или с помощью приборов. Чаще всего для этих целей используются оптические методы. В любом случае порог коагуляции может быть вычислен по формуле
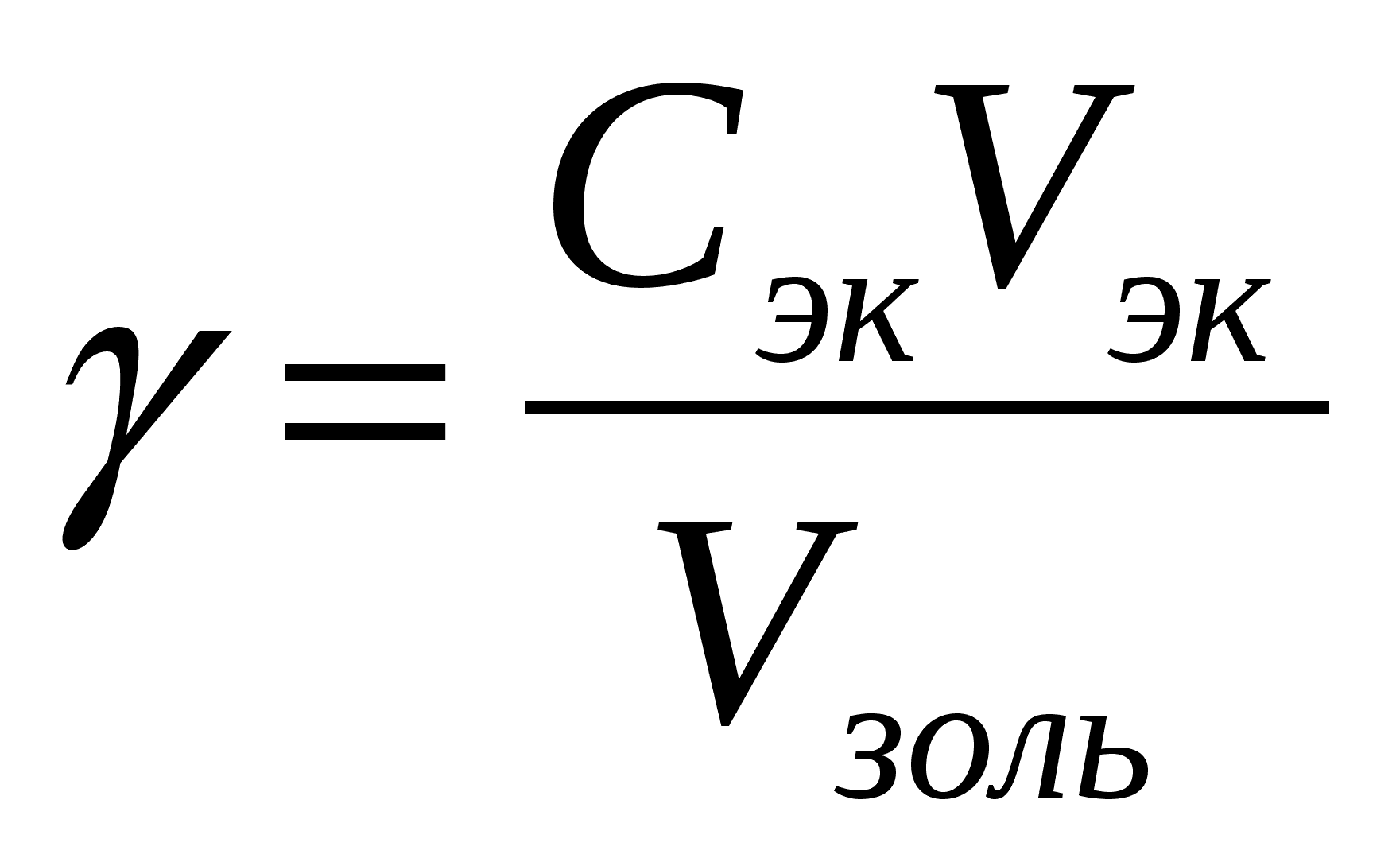
Порог коагуляции обычно измеряется в моль/л или в ммоль/л. При этом следует помнить, что физический смысл этой размерности – количество электролита (моль или ммоль), способное вызвать коагуляцию 1 литра коллоидного раствора.
Кроме порога коагуляции в коллоидной химии используется и обратная ему величина – коагулирующая способность Р:
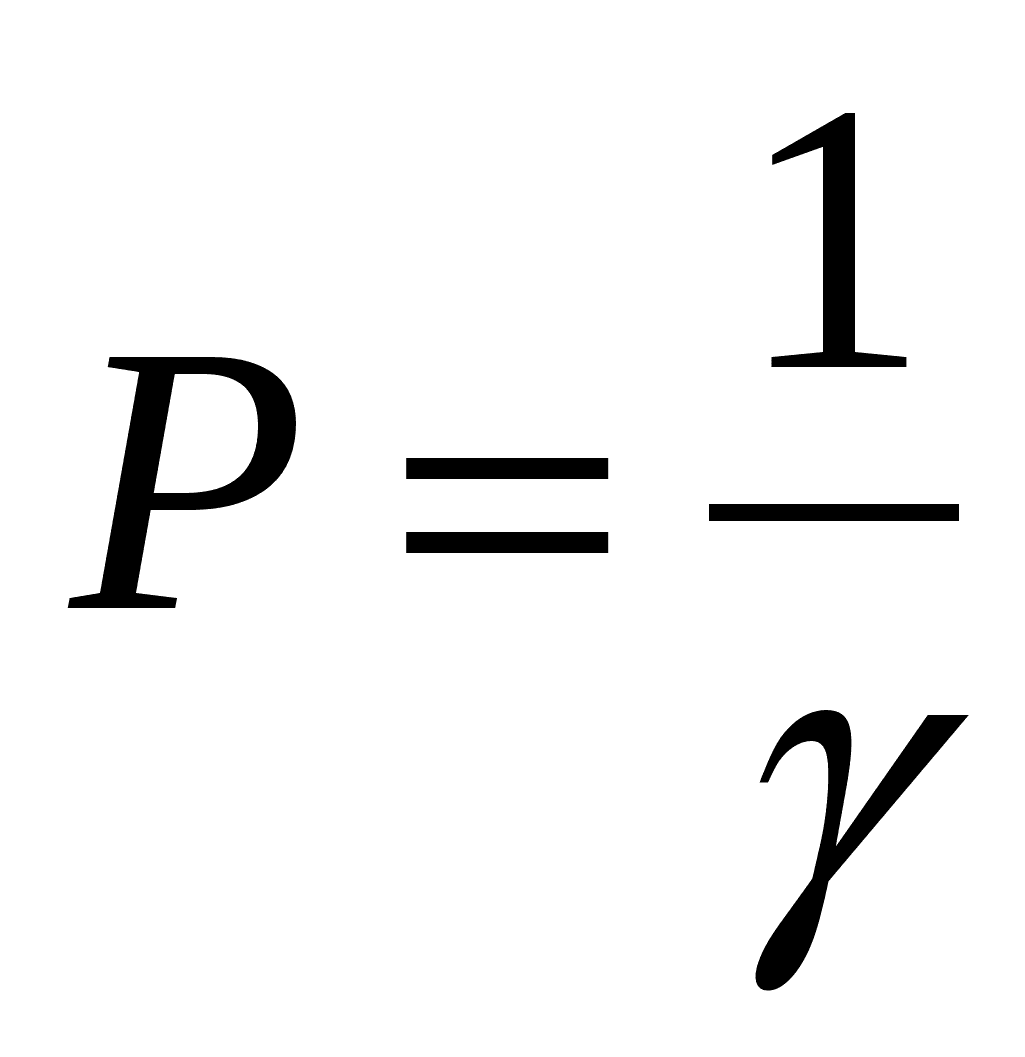
Размерность Р – л/моль или л/ммоль, что по физическому смыслу соответствует объёму золя, который может быть скоагулирован 1 молем (или миллимолем) электролита.
Порог коагуляции, а значит, и коагулирующая способность являются приблизительными характеристиками, так как зависят от очень многих факторов – от скорости прибавления электролита-коагулятора, от способа приготовления золя, от метода регистрации, от времени между добавлением электролита и моментом фиксирования явной коагуляции, от температуры и др.
Правило шульце-гарди. Коагулирующий ион имеет заряд, протиоположный коллоидной частицы, и чем он больше, тем больше его коагулирующее действие.
28)Классификация высокомолекулярных соединений. Сравнительная характеристика растворов ВМС, коллоидных и истинных растворов. Основные классы биополимеров: белки, нуклеиновые кислоты, полисахариды. Глобулярная и фибриллярная структура белков. Изоэлектрическое состояние. Изоэлектрическая точка белка. Электрофорез.
ВМС-это соединение молекулярной массы, которая преваешт 1000 углеродные единиц массы или а.е.м. и макромолекулы, которые построены из большого числа повторяющихся мономерных звеньев или молекулярных группировок.
ВМС обладают свойствами не только истинных растворов (само-произвольность образования раствора, его термодинамиче-ская устойчивость, молекулярная дисперсность, гомоген-ность), но и свойствами коллоидных растворов (неспособ-ность молекул полимера проникать через полупроницаемую мембрану, низкое осмотическое давление, малые скорости диффузии молекул, светорассеяние).
Коллоидные растворы
Как уже отмечалось, нерастворимых веществ нет. Даже твёрдые вещества, которые, вроде бы, являются нерастворимыми, - тоже частично растворяются, при этом образуя мельчайшие частицы в растворителе мицеллы. Эти частицы проходят через фильтр. Они настолько мелкие и лёгкие, что не выпадают в осадок. Такие частицы (мицеллы) называют коллоидными. А растворы - коллоидные растворы.
Коллоидные частицы можно рассмотреть в растворе с помощью пучка света - лучи отражаются и преломляются, и тогда коллоидные частицы становятся видны невооружённым глазом. (Такое явление называют эффектом Тиндаля).
В коллоидных растворах частицы имеют размер от 0,1...0,001 мкм (микрон).
Ещё одно распространённое название коллоидных растворов - золи. При длительном хранении золи переходят в гель (структура геля отличается от золи положением частиц (мицелл) - в гелях они сгруппированы).
Но если гель нагреть, то он снова перейдёт в золь.
Суспензия
Золи, которые переходят в гель, но при этом обратное превращение исключается - называют суспензиями. Если из геля снова получается золь - то это уже эмульсия.
Примерами коллоидного раствора могут быть молоко, клей, чернила, майонез, эмульсия фотоплёнок (раствор серебра). Облака - это тоже коллоидные растворы, где воздух - растворитель, а капли воды - коллоидные частицы.
Если насыпать в воду песок и взболтать, то песок очень быстро отделится от воды и окажется на дне ёмкости. Если перемешать пыль с водой, то тоже выпадет осадок, но гораздо медленнее. В таких случаях нельзя говорить о растворе, так как частицырастворяемого вещества видны невооруженным глазом или с помощью лупы, или микроскопа. Эта смесь является гетерогенной. Смеси такого типа, в которых компоненты можно отделить друг от друга путём простой фильтрации, также называют суспензиями.
Истинные растворы – это однофазные дисперсные системы, они характеризуются большой прочностью связи между дисперсной фазой и дисперсионной средой. Истинный раствор сохраняет гомогенность неопределенно долгое время. Истинные растворы всегда прозрачны. Частицы истинного раствора не видны даже в электронный микроскоп. Истинные растворы хорошо диффундируют.
Компонент, агрегатное состояние которого не изменяется при образовании раствора, называют растворителем (дисперсионная среда), а другой компонент – растворенным веществом (дисперсная фаза).
При одинаковом агрегатном состоянии компонентов растворителем считается компонент, количество которого в растворе преобладает.
В растворах электролитов вне зависимости от соотношения компонентов электролиты рассматриваются как растворенные вещества.
Истинные растворы подразделяются:
· по типу растворителя: водные и неводные
· по типу растворенного вещества: растворы солей, кислот, щелочей, газов и т.д.
· по отношению к электрическому току: электролиты и неэлектролиты
· по концентрации: концентрированные и разбавленные
· по степени достижения предела растворимости: насыщенные и ненасыщенные
· с термодинамической точки зрения: идеальные и реальные
· по агрегатному состоянию: газообразные, жидкие, твердые.
Основные классы биополимеров: белки, нуклеиновые кислоты, полисахариды.
Белки-высокомолекулярные биополимеры мономерами, которых явлются аминокислоты.
Аминокислоты-органические к-ты, содержащие амминогруппу (-NH2), еоторой присущи щёлочные св-ва, и карбоксильную группы (-COOH) с кислотными остатками (основ, к-т).
Ренатурация-процесс восстановления природной структуры белка.
Денаурация-процесс нарушения природной структуры белка под влиянием различных физико-химических факторов(температура, давление, кислоты, и др.) без разрушения пептидной связи(первичной структуры).
Функции белков: строительная, энергетическкая, защитная, сократительная или двигательная, резервная, транспортная, регуляторная, каталитическая.
Нуклеиновые кислоты-сложные высокомолекулярные биополимеры, мономерами которых являются нуклеотиды. Молекула нуклеотидов состоит из остатков азотистого основания, пятиуглеродного моносахарида (пентозы) и фосфорной кислоты.
Нуклеиновые кислоты-это продукты конденсации фосфатной к-ты, моносахаридов(рибоза, дезоксирибоза) и гетероциклических оснований.
Углеводы.
Полисахариды (С6Н10О5)n - полимеры, содержащие больше 10-ти моносахаридных звеньев(глюкоза, амилоза, ацетилглюкозамин и др.), соединённых между собой О-гликозидными связями. Они входят в состав мембран клеток и их органелл, а так же являются поставщиками энергии.(Крахмал, гликоген, целлюлоза).
Комплексные соединения: углеводов с белками-гликопротеиды, углеводов с липидами-гликолипиды, сложный гликопептид-муреин, хитин-в отличие от целлюлозы в молекулах остатки глюкозы связаны с азотсодержащими группами и др.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную). К глобулярным белкам относятся:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином оббладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Глобулярная (сферическая) – компактные шаровидные. Образования: гемоглобин, гликоген, пепсин, трипсин, панкреатин и др.
Ограниченно набухающие:процесс перехода от набухания к растворению происходит при определенных факторах (повышение температуры и др.)
Фибриллярная (линейная,слаборазветвленная) –ассиметричные пачки молекул:желатин,целлюлоза и ее производные, коллаген, полиакрилат натрия и др.
Фибриллярные белки - имеют нитевидную форму (фибриллы) , образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей.
Электрофорез-движение частиц дисперсной фазы во внешнем электрическом поле.
рН при которой белок находится в изоэлектрическом состоянии называется изоэлектрической точкой (ИЭТ).
