
- •Электронное оглавление
- •ПРЕДИСЛОВИЕ
- •Глава 1. ГЕНЕТИКА: ПРОШЛОЕ, НАСТОЯЩЕЕ И БУДУЩЕЕ
- •Поиски порядка и смысла
- •Современный образ науки
- •Перспективы современной генетики
- •Глава 2. ОТ МИФА К СОВРЕМЕННОЙ НАУКЕ
- •Примитивный интерес к наследственности
- •Одомашнивание растений и животных в зеркале мифа
- •Научные теории наследственности
- •Откуда берутся дети?
- •Глава 3. ЧТО ЖЕ ИМЕННО ПЕРЕДАЕТСЯ ПО НАСЛЕДСТВУ?
- •Строение клеток
- •Рис. 3.1. На тонких срезах под микроскопом видно, что сложные организмы состоят из многочисленных клеток:
- •Рис. 3.2. Строение клетки эукариотических организмов (растений и животных)
- •Молекулярная структура
- •Рис. 3.3. Разнообразие органических молекул, основным элементом которых служат атомы углерода, как правило, соединенные в цепи.
- •Таблица 3.1. МОНОМЕРЫ БЕЛКОВ, АМИНОКИСЛОТЫ
- •Рост и биосинтез
- •Ферменты
- •Рис. 3.4. Структура фермента карбоксипептидазы.
- •Рис. 3.5: а — клеточная мембрана представляет собой тонкий двойной слой молекул липидов с вкраплениями разного рода белков.
- •Синтез полимеров
- •Клетки как фабрики по самовоспроизводству и самообновлению
- •Глава 4. РЕВОЛЮЦИОННОЕ ОТКРЫТИЕ: ЗАКОНЫ МЕНДЕЛЯ
- •Открытия Менделя
- •Рис. 4.1. Объяснение результатов, полученных Менделем.
- •Родословные
- •Другой пример: тестеры и нетестеры
- •Группы крови
- •Множественные аллели и доминантность
- •Тестовые скрещивания
- •Вероятность
- •Два гена и более
- •Рис. 4.2. Решетка Пеннета, показывающая возможные генотипы потомства от скрещивания двух индивидов, гетерозиготных по двум независимым признакам.
- •Первый закон Менделя и определение отцовства
- •Глава 5. ХРОМОСОМЫ, РАЗМНОЖЕНИЕ И ПОЛ
- •Клетки и размножение
- •Рис. 5.1. Микрофотография яйцеклетки, окруженной многочисленными сперматозоидами в момент оплодотворения
- •Митоз и клеточный цикл
- •Рис. 5.2. Стадии митоза: профаза—хромосомы становятся видимыми, а оболочка ядра распадается
- •Кариотип
- •Рис. 5.3. Для составления кариотипа делящиеся клетки распределяют на пластине
- •Мейоз
- •Рис. 5.4. Процесс мейоза (в общих чертах) в клетке с двумя парами хромосом
- •Рис. 5.5. При сперматогенезе из начальной клетки образуются четыре сперматозоида, а при оогенезе только одна клетка.
- •Мейоз и законы Менделя
- •Местонахождение генов
- •Половые хромосомы
- •Нерасхождение хромосом
- •Мужчины XYY: «хромосома преступности»
- •Попытки определения пола
- •Глава 6. ФУНКЦИЯ ГЕНОВ
- •Гены и нарушения метаболизма
- •Рис. 6.1. Метаболические пути тирозина и фенилаланина в организме человека.
- •Гены и ферменты
- •Белки и информация
- •Рис. 6.2. Трехмерная структура белка миоглобина.
- •Рис. 6.3. Трехмерная структура гемоглобина.
- •Рис. 6.4. Электронная микрофотография красных кровяных клеток человека, больного серповидноклеточной анемией.
- •Рис. 6.5. Последовательность первых 28 аминокислот нормальной бета-цепи гемоглобина человека
- •Исправление наследственных нарушений
- •Диетическое питание при фенилкетонурии
- •Химическая коррекция серповидноклеточной анемии
- •Перспективы эвфеники
- •Глава 7. НАСЛЕДСТВЕННЫЙ МАТЕРИАЛ, ДНК
- •Бактерии
- •Рис. 7.1. Большая бактерия Clostridium welchii имеет приблизительные размеры 4 х 1 мкм (микрометров).
- •Рис. 7.2. Если раствор с бактериями нанести на поверхность питательной среды в чашке Петр
- •Первые шаги
- •Вирусы
- •Бактериофаги
- •Рис. 7.3. Общее строение вирусных частиц, или вирионов, вирусов бактерий и вирусов животных
- •Рис. 7.4. Фаги выращивают в чашках Петри, смешивая их образец с бактериями, в которых они могут размножаться, и с агаром.
- •Эксперимент Херши—Чейз
- •Рис. 7.5. Схема протекания фаговой инфекции
- •Строение ДНК
- •Рис. 7.6. Форма двойной спирали ДНК, по Уотсону и Крику
- •Модель ДНК и генетика
- •Рис. 7.7. При репликации ДНК комплекс ферментов разъединяет цепи двойной молекулы
- •Проверка модели
- •Глава 8. СТРОЕНИЕ ГЕНА
- •Распределение генов
- •Рис. 8.1. Генетическая карта плодовой мушки Drosophila melanogaster
- •Кроссинговер внутри генов
- •Генетика фагов
- •Тонкая структура гена
- •Комплементация и определение границ гена
- •Рис. 8.2. С помощью комплемвнтационного теста можно определить, происходят ли две мутации внутри одного гена или нет.
- •Что же такое ген?
- •Рестрикционные ферменты и палиндромы
- •Рис. 8.3. Молекулы ДНК можно легко разделить
- •Рис. 8.4. Один из методов определения последовательности молекулы ДНК
- •Рестрикционное картирование
- •Глава 9. РАСШИФРОВКА КОДА ЖИЗНИ
- •Как строятся белки!
- •Рис. 9.1. Эндоплазматическая сеть клеток эукариот состоит из мембран, обычно расположенных параллельно друг другу и покрытых крохотными частицами — рибосомами, которые служат фабриками по производству белка
- •Молекулы РНК: инструменты для синтеза белка
- •РНК-транскрипция
- •Рис. 9.2. В процессе транскрипции на одной из цепей ДНК образуется комплементарная ей цепь РНК.
- •Рис. 9.3. Электронная микрофотография транскрипции РНК. ДНК имеет вид тонкой нити, проходящей через центр каждого участка, похожего по форме на перо.
- •Трансляция
- •Рис. 9.4. Общая структура молекулы транспортной РНК.
- •Сложные гены эукариот
- •Рис. 9.5. Общие принципы синтеза белка.
- •Генетический словарь
- •Таблица 9.1. Генетический код
- •Колинеарность генов и белков
- •Рис. 9.6. Колинеарность гена и синтезируемого им белка.
- •Терминирующие кодоны
- •Универсальность кода
- •Глава 10. НАСЛЕДСТВЕННОСТЬ В МИРЕ БАКТЕРИЙ
- •Бактерии-мутанты
- •Пол у E.coli
- •Рис. 10.1. Перенос ДНК при скрещивании Hfr х F.
- •Рис. 10.2. Карта хромосомы Е. coli.
- •Факторы резистентности и устойчивость к антибиотикам
- •Лизогения
- •Гены, переносимые вирусом
- •Трансдукция и геном человека
- •Отбор мутантов
- •Глава 11. РЕГУЛЯЦИЯ ГЕНОВ И РАЗВИТИЕ ОРГАНИЗМА
- •Регуляция генов у бактерий
- •Белки, которые связываются
- •Регуляция генов эукариот
- •Эмбриональное развитие в общих чертах
- •Рис. 11.1. Формирование глаза эмбриона цыпленка начинается с чашечковидного отростка мозга.
- •Регуляция по времени и развитие крыла цыпленка
- •Регуляция по положению и развитие тела мухи
- •Рис. 11.3. Начальные взаимодействия генов, определяющих пространственную ориентацию эмбриона плодовой мушки.
- •Формирование глаза мухи
- •Рис. 11.4. Восемь клеток, которые становятся фоторецепторами в омматидии глаза дрозофилы, специализируются в определенном порядке, который зависит от взаимодействия нескольких генов и кодируемых ими белков
- •Глава 12. ВМЕШАТЕЛЬСТВО В СТРОЕНИЕ ДНК: ВОЗВРАЩЕНИЕ ЭПИМЕТЕЯ?
- •Рекомбинантная ДНК и рестриктазы
- •Изучение отдельных клонированных фрагментов
- •Рис. 12.1. Для запуска полимеразной цепной реакции отрезок ДНК нагревают до разделения его на две цепи.
- •Трансгенные организмы
- •Рис. 12.2. Метод ДНК-отпечатков использован для установления невиновности одного из двух обвиняемых в изнасиловании.
- •Генная терапия
- •Геномика — изучение всего генома
- •Функциональная геномика
- •Глава 13. ГЕНЕТИК В РОЛИ ДОКТОРА ФРАНКЕНШТЕЙНА
- •Контроль над исследованиями рекомбинантных ДНК
- •Генетически модифицированные организмы
- •Технологии в контексте
- •Аргументы против генетически модифицированных продуктов
- •Непредсказуемость генетических изменений
- •Влияние генетически модифицированных продуктов на здоровье
- •Возможный экологический урон
- •Неестественность ДНК-технологий (ученые в роли «богов»)
- •Этические аспекты клонирования
- •Клонирование ДНК
- •Ответственность ученых
- •Геномика и здравоохранение
- •Глава 14. ИСТОЧНИК ПЕРЕМЕН: МУТАЦИИ
- •Частота мутаций
- •Мутации у людей
- •Излучение
- •Корпускулярное излучение, или радиация,
- •Таблица 14.1 Примерные дозы излучений
- •Что представляют собой мутации?
- •Мутация — это изменение в ДНК.
- •Аналоги оснований
- •Рис. 14.1. Дезаминирующий агент, такой как азотистая кислота (NH02), удаляет аминогруппу двух оснований, превращая их в основания, образующие неправильные пары
- •Система восстановления ДНК
- •Генетические последствия радиации
- •Хромосомные аберрации
- •Хромосомы человека
- •Анеуплоидия
- •Дупликация и делеция
- •Инверсии
- •Транслокации
- •Глава 15. ЭВОЛЮЦИОННАЯ ГЕНЕТИКА
- •Доказательства эволюции
- •Эволюция как процесс
- •Популяционная генетика
- •Эволюция человека
- •Миграция и разнообразие Homo sapiens
- •Цвет кожи
- •Форма тела
- •Сопротивляемость малярии
- •Приспособленность к высоте
- •Евгеника
- •ПРИМЕЧАНИЯ
- •Глава первая
- •Глава вторая
- •Глава третья
- •Глава четвертая
- •Глава пятая
- •Глава шестая
- •Глава седьмая
- •Глава восьмая
- •Глава десятая
- •Глава тринадцатая
- •Глава четырнадцатая
- •СЛОВАРЬ
- •ОГЛАВЛЕНИЕ
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
83 |
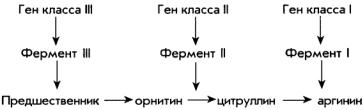
веществами вместо аргинина. Таким образом, они разделили ауксотрофы по аргинину на несколько классов. Мутанты класса I могли расти только в среде с аргинином; мутанты класса II — в среде с аргинином или цитруллином; мутанты класса III — в среде с аргинином, цитруллином или орнитином. На основании этих результатов Билл и Тэйтем сделали вывод, что: 1) отдельный ген передает информацию о синтезе отдельного фермента; 2) каждый мутант, дефективный по одному гену, не может вырабатывать один фермент; 3) биосинтетический путь, ведущий к образованию аргинина, имеет следующий вид:
Каждую реакцию контролирует особый фермент, и у каждого мутанта соответствующим образом блокируется производство этого фермента. Мутанты не могут расти в среде, в которой присутствуют вещества, производимые до блокировки: например, мутанты класса II не могут расти в среде с орнитином. Если в среде присутствуют вещества, производи-
152
мые после блокировки, то организм получает все необходимые вещества для производства аргинина и может расти. Так, мутанты класса III не могут преобразовывать вещества-предшественники в орнитин, но если в их питательную среду добавить орнитин, они перерабатывают орнитин в цитруллин, а цитруллин — в аргинин. Позднее биохимические эксперименты доказали, что эти реакции происходят именно в таком порядке.
На основании полученных результатов Бидл и Тэйтем высказали гипотезу «один ген — один фермент», согласно которой каждый ген контролирует производство отдельного фермента. Фактически они вплотную подошли к представлению о том, что гены переносят информацию о производстве белков, так как ферменты являются очень важным типом белков (но, как мы сказали в гл. 3, существуют и другие белки). Согласно более современной версии принципа Билла и Тэйтема каждый ген кодирует производство отдельной полипептидной цепи (напомним, что полипептид — это цепь аминокислот). Некоторые белки состоят из одного полипептида, другие — из двух и более.
Белки и информация
Поскольку гены контролируют производство и синтез белков, то еще раз рассмотрим структуру белков. Как было сказано в гл. 3, белки — наиболее разнообразные молекулы организма. Они являются составной частью всех мембран; образуют большую часть рибосом («фабрик» по производству белков); входят в состав многих структурных частей клетки,
153
определяющих ее форму и строение; белки — активные компоненты мышечных волокон, позволяющих нам выполнять движения. Из белков состоят такие образования, как волосы, кожа, сухожилия и (в сочетании с кристаллами фосфата кальция и магния) кости. Белками являются некоторые гормоны, такие как инсулин, которые переносят химические
Генетика / Бартон Гуттман, Энтони Гриффитс, Дэвид Сузуки, Тара Куллис. — М.: ФАИР-
ПРЕСС, 2004. — 448 с: ил.
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
84 |
послания от одного типа клеток к другим. И что самое важное, белки выполняют также функцию ферментов.
Вспомним, что белки представляют собой длинные цепи полимеров, состоящих из 20 видов аминокислот, соединенных друг с другом полипептидной связью. Связь образуется в ходе химических реакций, идущих с выделением воды в качестве побочного продукта. Полипептид может состоять из очень большого количества аминокислот. В наше время с помощью особых приборов можно быстро определить состав аминокислот в белке. Анализ белков показал, что каждый из них характеризуется уникальной последовательностью аминокислот, называемой первичной структурой. Все молекулы белков одного вида имеют одинаковую последовательность. Например, если обозначить аминокислоты по трем буквам их названия (латинского), то полипептид Glu—Gly—Pro—Trp— Leu—Glu—Ala— —Туг—Gly—Trp—Met—Asp—Phe — это гормон гастрин,
способствующий пищеварению, а полипептид Tyr—Gly—Gly—Phe—Met — энкефалин, обладающий опиатным действием в нервной системе. Эти последовательности всегда записываются начиная с аминного конца, то есть со свободной аминогруппы, и заканчиваются карбоксильным концом, то есть свободной карбоксильной группой. Однако большин-
154
ство других белков — очень большие молекулы, состоящие из нескольких сотен аминокислот; замена всего лишь одной кислоты может иногда привести к образованию совсем другого белка с другой структурой; чаще всего такая замена приводит к утрате функций белка.
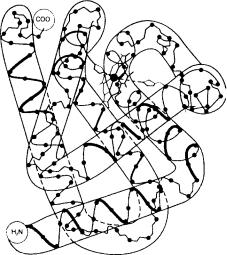
Первичная структура, как правило, определяет свойства любого белка, включая то, как эти длинные цепи принимают особую форму в пространстве (рис. 6.2). Сила притяжения между атомами в каждой молекуле белка заставляет полипептидную цепь принимать специфическое положение, и так полу-
Рис. 6.2. Трехмерная структура белка миоглобина.
Показаны не все атомы; жирной линией обозначен «каркас» пептидной цепи, который образуют несколько спиральных сегментов, соединенных цепями с менее регулярной формой
155
чается структура, способная выполнять ту или иную функцию — например, небольшой «карман» или активный центр, с помощью которого фермент катализирует химическую реакцию. Многие функциональные
Генетика / Бартон Гуттман, Энтони Гриффитс, Дэвид Сузуки, Тара Куллис. — М.: ФАИР-
ПРЕСС, 2004. — 448 с: ил.

Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
85 |
белки, кроме того, состоят из двух полипептидов и более.
Когда говорят о генах, часто используют термин информация, особенно генетическая информация. Вспомним (гл. 3), что информация позволяет сделать выбор из нескольких возможных вариантов, что особенно важно для структуры белка. Так, упомянутая последовательность гастрита — это одна из 2013 возможных последовательностей из 20 видов аминокислот по 13 в ряд. Понятно, что для постройки этого белка требуется много информации, хотя не так много, как для более типичных белков, состоящих из 300 аминокислот. Где-то в геноме человека должен присутствовать ген, определяющий последовательность гастрина: он переносит информацию о том, какие аминокислоты должны следовать друг за другом. Структурную перестройку в этом гене, приводящую к замене информации, называют мутацией. (Позже мы узнаем, что некоторые мутации затрагивают синтез белка или контроль над ним.)
Нарушение связи между геном и белком иллюстрирует такое наследственное заболевание, как серповидноклеточная анемия. Почти половина объема крови у нормального человека состоит из округлых, дискообразных красных кровяных клеток — эритроцитов, которые содержат гемоглобин, придающих им цвет. Гемоглобин переносит кислород, необходимый для нормального метаболизма клеток; красные кровяные тельца проникают по тонким капиллярам в самые удаленные уголки тканей
и
156
доставляют им кислород. Преобладает тип гемоглобина А (Hb А), который состоит из четырех полипептидных цепей: двух цепей альфа (по 141 аминокислоте в каждой) и двух цепей бета (по 146 аминокислот) (рис. 6.3). Это так называемые глобиновые части молекулы; каждая из них переносит небелковую группу гем — большую кольцевидную молекулу с атомом железа посередине. Именно благодаря атому железа эта часть присоединяет кислород. Отсюда понятна необходимость железа в составе нашей пищи.
Серповидноклеточная анемия характеризуется ненормальным строением гемоглобина, Hb S, который кодируется мутантным аллелем HbS. Kpac-
Рис. 6.3. Трехмерная структура гемоглобина.
Каждая молекула состоит из четырех полипептидных цепей — двух альфацепей и двух бета-цепей. Эти цепи, комплементарные друг другу, образуют четвертичную структуру белка. В каждой цепи имеется по большому гему с атомом железа в центре; именно к нему присоединяется кислород
157
ные кровяные тельца с ненормальным гемоглобином имеют необычную форму, и некоторые из них похожи на серп (рис. 6.4). Такие кровяные
Генетика / Бартон Гуттман, Энтони Гриффитс, Дэвид Сузуки, Тара Куллис. — М.: ФАИР-
ПРЕСС, 2004. — 448 с: ил.
Янко Слава (Библиотека Fort/Da) || http://yanko.lib.ru |
86 |
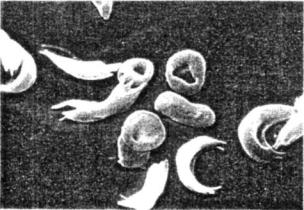
клетки с трудом передвигаются по сосудам и иногда закупоривают их, вызывая сильную боль, повреждения органов и тканей, а в некоторых случаях даже служат причиной смерти. Анемия возникает в результате того, что серповидные клетки разрушаются обычно в три раза быстрее нормальных. У гетерозигот HbAHbS проявляются некоторые черты этого заболевания, но клеток с гемоглобином НbА у них достаточно для нормального функционирования, поэтому они, как правило, здоровы. Анемия возникает только в 1 % случаев. Серповидноклеточная анемия широко распространена в Африке и других регионах, где распространена малярия. Поскольку
Рис. 6.4. Электронная микрофотография красных кровяных клеток человека, больного серповидноклеточной анемией.
Ясно видна необычная форма этих клеток, отличающихся от нормальных — округлых. Публикуется с разрешения фотобиблиотеки Omikron/'Science
158
лица, в крови которых присутствует гемоглобин Hb S, более устойчивы к малярии, то у гетерозигот имеется некоторое преимущество, и эти черты закрепились в некоторых популяциях (в других странах серповидноклеточная анемия чаще наблюдается также среди выходцев из Африки).
В1956 году Вернон Инграм доказал, что гемоглобины Hb А и Hb S различаются только по одной аминокислоте в бета-цепи (шестая от аминного конца). Обычно это глутаминовая кислота, но в Hb S она заменена на валин:
Hb А: Val-His-Leu-Thr-Pro-Glu-Glu-Lys; Hb S: Val-His-Leu-Thr-Pro-Val-Glu-Lys.
Таким образом, во всей последовательности 146 аминокислот замена всего лишь одной из них приводит к опасному заболеванию.
Вдальнейшем была определена последовательность обеих полипептидных цепей гемоглобина и обнаружены другие возможные нарушения (рис. 6.5). В каждом случае дефектный аллель приводит к образованию гемоглобина, идентичного нормальному за исключением одной аминокислоты или (иногда) короткой последовательности аминокислот. Соответствие «одна мутация — одна аминокислота» подтверждает мысль о том, что каждый отдельный ген определяет последовательность отдельного белка и что ген состоит из единиц, кодирующих отдельные аминокислоты, причем мутации может подвергаться каждая единица. Обычно мутация затрагивает одну аминокислоту, и образующийся белок лишь слегка отличается от нормального по форме и функциям. Другие мутации стирают одну или
Генетика / Бартон Гуттман, Энтони Гриффитс, Дэвид Сузуки, Тара Куллис. — М.: ФАИР-
ПРЕСС, 2004. — 448 с: ил.
