
Химический минимум
.pdf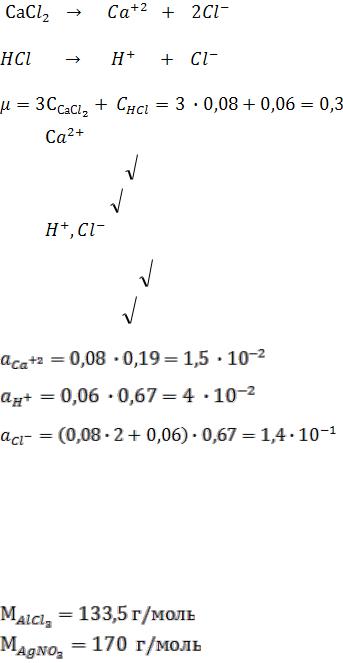
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
При одной и той же ионной силе раствора коэффициент активности ионов зависит также от его заряда. Ионы с более высоким зарядом обладают повышенной способностью к образованию ионных пар или ионных ассоциатов и поэтому их коэффициенты снижаются. При расчѐтах можно воспользоваться приближенными значениями средних коэффициентов активности f для ионов с различным зарядом в зависимости от ионной силы раствора.
ПРИМЕР 3:
Определить чему равна ионная сила раствора и активность ионов в 0,08М растворе СаCl2 , содержащем кроме того 0,06М HCl.
Решение:
0,08М 0,08М 2×0,08М
0,06М 0,06М 0,06М
.
Для
lg г |
0,5 22 |
|
0,3 |
|
|
|
|
|
|
|
|
= - 0,71 ; γ= 0,19 |
|
1 |
|
|
|
|
||
0,3 |
|
|
||||
|
|
|
||||
|
|
|
|
|||
Для
lg г |
0,5 22 |
|
0,3 |
|
|
|
|
|
|
|
|
= - 0,18; γ=0,67 |
|
1 |
|
|
|
|
||
0,3 |
|
|
||||
|
|
|
||||
|
|
|
|
|||
моль/л
моль/л
моль/л
ПРИМЕР 4:
Чему равна активная концентрация ионов Ag+, Al+3 и 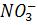 в растворе, содержащем 0,5 г AlCl3 и 0,2 г AgNO3 и 500 г Н2О.
в растворе, содержащем 0,5 г AlCl3 и 0,2 г AgNO3 и 500 г Н2О.
Решение: Рассчитаем моляльную концентрацию (Сm = моль/1000г Н2О) ионов и Ag+
72

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
моль/1000 г Н2О
моль/1000 г Н2О
γ Al+3= 0,15; γС1-, Ag+,NO3- = 0,81
моль/1000 г Н2О моль/1000 г Н2О
моль/1000 г Н2О моль/1000 г Н2О
ПРИМЕР 5:
Определить ионную силу и активность ионов в 0,1 % -м (по массе) растворе Na3PО4. Плотность раствора принять за единицу.
Решение: Определим молярную концентрацию См = моль/л 0,1 %-го раствора Na3PO4
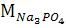 = 174 г/моль
= 174 г/моль
;
См(Na3PO4) = 0,0056 моль/л
γ Al+3 = 0,24; γNa+ = 0,81
моль/л моль/л
Задания к разделу 6.2
1.Рассчитать активную концентрацию хлорида кальция в водном растворе, содержащем 0,925 г СаСl2 в 500 г воды.
2.Определить средний коэффициент активности ионов серебра в водном растворе, в котором в 1000 г воды растворено 0,01 моля АgNO3.
3.Рассчитать ионную силу раствора и активность ионов H2SO4, моляльная концентрация которого равна 0,03 моль/1000 г Н2О.
73
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
4.Определить ионную силу раствора, содержащего 1,5 г
Mg(NO3)2 в 250 г воды.
5.Вычислить значение активности ионов К+ и РО43– в 0,01 М растворе K3РО4.
6.Найти приближенные значения коэффициентов активности ионов Сl–, HРО42–, РО43– в растворе c ионной силой 0,0001.
7.Вычислить активность ионов Са2+ и NO3– в 0,05 М растворе Сa(NO3)2, содержащем, кроме того, 0,05 моль/л НNO3.
8.Вычислить ионную силу и активность ионов в 1 %-м раство-
ре Na2SO4.
9.Вычислить ионную силу и активность ионов в 0,12 Н растворе Fe2(SO4)3, содержащем, кроме того, 0,01 моль/л H2SO4.
10.Вычислить ионную силу и активность ионов в 0,1 %-м (по мас-
се) растворе Fe2(SO4)3. Плотность раствора принять равной единице.
11.Вычислить ионную силу и активность ионов в растворе, содержащем 0,01 моль/л MgSO4 и 0,01 моль/л BaCl2.
12.Рассчитать активность иона водорода в 0,005 Н растворе HCl, содержащем, кроме того, 0,2 моль/л NaCl.
13.Рассчитать активную концентрацию фосфата натрия в водном растворе, содержащем 0,4 г Na3PO4 и 200 г Н2О.
14.Вычислить активные концентрации ионов Fe3+, Са2+ и NO3– в растворе, содержащем 0,02 моля Fe(NO3)3 и 0,02 моля
Ca(NO3)2 в 1000 г воды.
15.Вычислить значения a и μ ОН–- в 0,01 Н NaOH, считая γон– = 0,8.
16.Определить средний коэффициент активности ионов OH– в растворе, содержащем 1,0 г NaOH в 150 г Н2О.
17.Определить средний коэффициент активности ионов сульфата хрома в водном растворе, моляльная концентрация которого 0,01 моль/1000 г Н20.
18.Вычислить активные концентрации сульфата меди и сульфата калия в растворе, содержащем 1,3 г CuSO4 и 0,5 г К2SO4 в 500 г
воды.
19. Вычислить ионную силу растворов и активность ионов;
а) 0,05 М AgNO3; б) 1,3·10–2 М BaCl2; в) 2,5·10–2 М MgSO4.
20.В 1 л раствора содержится по 0,01 моля AlCl3 и Na3PO4. Вычиcлить ионнyю силу раствора и активность ионов. Как
74
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
изменятся μ и активность ионов после добавления к раствору 1 л воды?
21.Чему ровна активность ионов Ag+, Al3+ и NO3– в растворе, содержащем 0,5 г Al(NO3)3 и 0,2 г AgNO3 в 500 г Н2О?
22.Раствор содержит Pb(NO3)2, НCl, СН3СООNa, соответственно, в количестве 0,005, 0,001 и 0,0005 моля в 500 г воды. Рассчитать активную концентрацию каждого из электролитов в этом растворе.
23.Определить средний коэффициент активности ионов сульфата хрома в водном растворе, СМ которого 0,3 моль/л.
24.Рассчитать активную концентрацию хлорида магния в водном растворе, содержащем 0,3 г MgSO4 в 1000 г Н2О.
25.Рассчитать активность иона водорода в 0,005 Н растворе HNO3, содержащем, кроме того, 0,1 моль/л NaNO3.
26.Определить ионную силу раствора, содержащего 0,4 моль/л
AlCl3, 0,3 моль/л CuCl2, 0,2 моль/л ZnSO4, 0,1 моль/л CuCl2.
27.Найти приближенные значения коэффициентов активности ионов Сl–, Са2+ и NO3– в растворе c ионной силой 0,0001.
28.Вычислить ионную силу и активность ионов в 2 %-м K2SO3.
29.Вычислить ионную силу и активность ионов в 0,10 Н растворе Al2(SO4)3, содержащем, кроме того, 0,02 моль/л H2SO4.
30.Вычислить ионную силу и активность ионов в 0,1 %-м (по
массе) растворе Fe2S3. Плотность раствора принять равной единице.
31.Вычислить ионную силу и активность ионов в растворе, содержащем 0,02 моль/л MgSO4 и 0,03 моль/л BaCl2.
32.Рассчитать активность иона водорода в 0,005Н растворе HCl, содержащем, кроме того, 0,2 моль/л NaCl.
33.Рассчитать активную концентрацию фосфата натрия в водном растворе, содержащем 0,3 г Na3PO4 и 200 г Н2О.
34.Вычислить активные концентрации ионов Fe3+ , Са2+ и NO3– в растворе, содержащем 0,02 моля Fe(NO3)3 и 0,02 моля
Ca(NO3)2 в 3000 г воды.
35.Вычислить значения a и μ ОН–- в 0,02 Н NaOH, считая γон– = 0,8.
36.Определить средний коэффициент активности ионов OH– в растворе, содержащем 4,0 г NaOH в 350 г Н2О.
75
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
37.Определить средний коэффициент активности ионов сульфата хрома в водном растворе, моляльная концентрация которого 0,04 моль/1000 г Н2О.
38.Вычислить активность ионов CuSO4 и сульфата калия в растворе, содержащем 1,3 г CuSO4 и 0,5 г H2SO4 в 500 г воды.
39.Вычислить активность ионов Сd2+ и NO3– в 0,07 М растворе Сd(NO3)2, содержащем, кроме того, 0,05 моль/л НNO3.
40.Раствор содержит Sn(NO3)2, Нl, СН3СООNa, соответственно, в количестве 0,005, 0,001 и 0,0005 моля в 500 г воды. Рассчитать активную концентрацию каждого из электролитов в этом рас-
творе.
41. Вычислить ионную силу растворов и активность ионов:
а) 0,02 М AgNO3; б) 1,8·10–2 М СaCl2; в) 4,0·10–2 М MgSO4.
42.Рассчитать активную концентрацию фосфата натрия в водном растворе, содержащем 0,4 г Na3PO4 и 300 г Н2О.
6.3. Слабые электролиты
Степень диссоциации ( ) слабого электролита много меньше единицы, поэтому в растворе устанавливается равновесие между ионами и молекулами растворенного вещества.
К слабым электролитам можно отнести некоторые кислоты: уксусную – СН3СООН, угольную – Н2СО3, сероводородную – Н2S, сернистую – Н2SO3, азотистую – HNO2, ортофосфорную – H3PO4 и др.; основания, образованные р- и d-элементами, а также гидроксид аммония и воду.
Так, диссоциация уксусной кислоты соответствует уравнению:
СН3СООН ↔ СН3СОО– + Н+.
Равновесные концентрации ее частиц можно записать в ви-
де: [CН3СООН], [СН3СОО–], [Н+] и выразить их через величину : [CН3СООН] = СИСХ – СИСХ. [СН3СОО–] = [Н+] = СИСХ, то есть это доля прореагировавшего вещества С.
Подставив эти значения в выражение для расчета константы равновесия или диссоциации, получим (см. Приложение 4):
76

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
|
|
[CH |
3COO ] [H ] |
|
C |
ИСХ |
C |
ИСХ |
|
2 C2 |
||||
К Д |
|
|
|
|
|
|
ИСХ |
|
||||||
[CH 3COOH] |
|
|
|
|
|
|
CИСХ (1 ) , |
|||||||
|
|
|
CИСХ CИСХ |
|||||||||||
|
|
|
К Д |
|
2 C |
ИСХ |
. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
||
Если электролит очень слабый, то есть его константа диссоциации < 0,001, то отношение его исходной концентрации к величине константы СИСХ / КД будет больше, либо равно 100, тогда величиной степени диссоциации в знаменателе можно пренебречь, и зависимость степени диссоциации от концентрации растворенного электролита примет вид
|
|
|
|
|
КД . |
||
CИСХ |
|
||
|
|||
Данное выражение носит название «Закон разбавления Остваль-
да»: При разбавлении раствора слабого электролита в 100 раз степень диссоциации возрастает в 10 раз.
Если же отношение СИСХ /КД < 100, то есть электролит сред-
ней силы, то упростить выражение КД = 2 СИСХ / (1 – )
нельзя, а рассчитывать величину необходимо по квадратному
уравнению
2 СИСХ + КД – КД = 0.
Учитывая вышеизложенные преобразования концентраций, можно вывести формулу зависимости концентрации ионов в растворе слабого электролита от исходной концентрации растворен-
ного вещества:
[СН3СОО–] = [Н+] = СИСХ, а
[CН3СООН] = СИСХ – СИСХ = СИСХ – [Н+], следовательно КД = [Н+]2 / (СИСХ – [Н+]).
(Для слабого основания вместо концентрации ионов водорода в формуле будет стоять концентрация гидроксильных групп). Аналогично предыдущему случаю, если СИСХ / КД > 100 (очень слабый электролит), выражение можно упростить, так как концентрация ионов водорода окажется малой по сравнению с единицей:
КД = [Н+]2 / СИСХ, откуда [H ] 
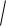 КД СИСХ .
КД СИСХ .
Для электролита средней силы, рассчитать концентрацию [Н+] можно по квадратному уравнению:
77

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
[Н+]2 + КД [Н+] – КД СИСХ = 0.
ПРИМЕР 1: Вычислить концентрацию ионов [Н+], α в 0,1М растворе цианистоводородной кислоты константа диссоциации которой Kд =
4,93·10-10 (при 25ºС)
Решение: Напишем уравнение электролитической диссоциации и выражение константы диссоциации.
В этом разделе убрать индексы «р» из ур-ний
В выражении константы диссоциации все величины представлены через концентрации [Н+] и СHCN. В растворе цианистоводородная кислота присутствует частично в форме недиссоциированных молекул HCN, частично она продиссоциировала и существует в виде ионов
Отсюда: |
, где |
Из уравнения диссоциации видно, что [Н+] = [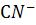 ]р, подставим эти выражения в уравнение константы диссоциации
]р, подставим эти выражения в уравнение константы диссоциации
, т.к.
то выражение константы диссоциации
можно упростить
, а
моль/л
.
ПРИМЕР 2: Вычислить концентрацию водородных ионов [Н+], α в 0,001М растворе фтороводородной кислоты, константа диссоциации которой
|
Kд = 6,6·10-4 |
Решение: |
HF = H+ + |
В данном случае |
поэтому |
78

НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
ПРИМЕР 3: Вычислить концентрацию ионов |
, α 0,1М растворе гид- |
роксида серебра, константа диссоциации которого |
при |
(25ºС) |
|
Решение: |
|
Из уравнения диссоциации следует:
,
Задания к разделу 6.3
1.Найти степень диссоциации сероводородной кислоты по первой ступени в 0,1 М растворе.
2.Вычислить степень диссоциации гидроксида аммония в 1 Н растворе, если в 1 л этого раствора содержится 6,045 1023 растворенных частиц.
3.Степень диссоциации уксусной кислоты в 1 Н, 0,1 Н, 0,01 Н растворах соответственно равна 0,42; 1,34; 4,25 %. Вычис-
79
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
лить КД уксусной кислоты для растворов указанных концентраций. Зависит ли КД от концентрации СН3СООН?
4.Степень диссоциации слабой одноосновной кислоты в 0,1 Н растворе равна 0,05. Вычислить значения КД и [H+] для этого раствора.
5.Какова концентрация водородных ионов Н+ в 1 Н НСN? Сколько моль ионов СN– содержится в 1,5 л указанного раствора?
6.Определить степень диссоциации и концентрацию ионов ОН– в 0,1 Н NH4OH.
7.Вычислить степень диссоциации азотистой кислоты в ее 0,01 М растворе и концентрацию ионов водорода.
8.В растворе бензойной кислоты С6Н5СООН концентрация ионов водорода 3·10–3 моль/л. Вычислить концентрацию этого раствора (моль/л; г/л), если КД. = 6,1·10–5 .
9.Вычислить степень диссоциации уксусной кислоты в 0,01 Н
растворе, если известно, что в 500 мл этого раствора содержится 3,13·1021 частиц (молекул и ионов).
10.Вычислить концентрацию нитрит-ионов и ионов Н+ в 0,47 %- м растворе азотистой кислоты ( = 1,0 г/см3).
11.Концентрация ионов водорода в 0,1 М растворе борной кислоты составляет 7,6·10–6. Вычислить константу первой стадии диссоциации кислоты.
12.Какой объем воды необходимо добавить к 500 мл 0,1 Н раствора уксусной кислоты, чтобы степень диссоциации ее увеличилась в 2 раза?
13.Имеются 0,1-молярные растворы муравьиной и уксусной кислот. В каком растворе концентрация ионов водорода больше и во сколько раз?
14.Константа диссоциации масляной кислоты С3Н7СООН 1,5·10–5. Вычислить степень ее диссоциации в 0,005 М растворе.
15.Найти степень диссоциации хлорноватистой кислоты в 0,2 Н растворе.
16.Степень диссоциации муравьиной кислоты НСООН в 0,2 Н растворе равна 0,03. Определить константу диccоциации кислоты и значение рК.
17.Степень диссоциации угольной кислоты Н2СО3 по первой ступени в 0,1 Н растворе равна 2,11·10–3. Вычислить К1.
80
НАУЧНО-ИНФОРМАЦИОННЫЙ ЦЕНТР САНКТ-ПЕТЕРБУРГСКОГО ГОСУДАРСТВЕННОГО ТЕХНОЛОГИЧЕСКОГО УНИВЕРСИТЕТА РАСТИТЕЛЬНЫХ ПОЛИМЕРОВ
18.Чему равна концентрация ионов водорода в водном растворе муравьиной кислоты, если = 0,03 ?
19.Вычислить [H+] в 0,02 М растворе сернистой кислоты. Диссоциацией кислоты во второй ступени пренебречь.
20.Степень первичной диссоциации ортофосфорной кислоты в 0,1 М растворе равна 27 %. Вычислить [H2PO4-] в моль/л и г/л.
21.Вычислить концентрацию ОН– ионов в моль/л и г/л в 0,5 Н
растворе NH4ОН; концентрацию раствора NH4ОН в моль/л, при которой = 4 %.
22.Вычислить степень электролитической диссоциации растворов уксусной кислоты: а) 0,5 М; б) 0,2 Н; в) 0,001 Н.
23.В 0,1 М растворе HNO2 [H+] = 0,0068 моль/л. Вычислить константу диссоциации азотистой кислоты.
24. |
В растворе бензойной кислоты С6Н5СООН |
[H+] = 5·10–3 |
|
моль/л. Вычислить концентрацию раствора в моль/л и г/л (КД. |
|
|
= 6,1·10–5). |
|
25. |
Определить степень диссоциации и концентрацию ионов ОН– |
|
|
в 10–6 Н Mg(OH)2. |
|
26. |
Определить величины КД и [H+] для 0,01 М раствора слабой |
|
|
одноосновной кислоты, степень диссоциации которой равна |
|
|
0,01. Как изменятся вышеперечисленные параметры после раз- |
|
|
бавления раствора в десять раз? |
|
27. |
Определить степень диссоциации и концентрацию ионов ОН– |
|
|
в 10–6 Н Pb(OH) . |
|
|
2 |
|
28. |
Найти степень диссоциации угольной кислоты по первой |
|
|
ступени в 0,01 М растворе. |
|
29. |
Степень диссоциации слабой одноосновной кислоты в 0,01 Н |
|
|
растворе равна 0,01. Вычислить значения К |
и [H+] для этого |
|
Д |
|
|
раствора. |
|
30. |
Какова концентрация водородных ионов Н+ в 0,1 Н НSСN? |
|
|
Сколько моль ионов SСN– содержится в 2 л указанного рас- |
|
|
твора? |
|
31. |
Вычислить степень диссоциации и концентрацию ионов во- |
|
|
дорода в 0,01 М растворе метаборной кислоты. |
|
32. |
Вычислить концентрацию формиат-ионов и ионов Н+ в 0,6 %- |
|
|
м растворе муравьиной кислоты ( = 1,0 г/см3). |
|
33. |
Какой объем воды необходимо добавить к 300 мл 0,2 Н рас- |
|
|
твора хлорноватистой кислоты, чтобы степень диссоциации |
|
|
ее увеличилась в 2 раза? |
|
|
81 |
|
