
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdf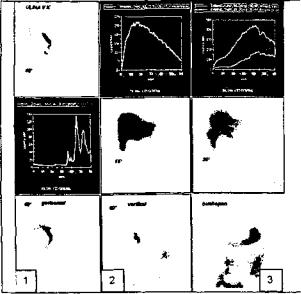
Липидный дистресс-синдром в хирургии
Орган-мишень — фатеров сосочек. Липидная инфильтрация мышц фатерова сосочка проявляется холестерозом с выраженными функциональными нару шениями, нарушающими поступление желчи в кишеч ник. Разработанные специальные методы радионуклидной диагностики позволяют достоверно установить холестероз фатерова сосочка даже без биопсии и предот вратить ненужную папиллосфинктеротомию у 43—47% больных. Длительная дехолестеринизация фатерова сосочка по программе лечения ЛДС позволяет эффективноустранить внепеченочные билиарные дисфункции, восстановить транспорт желчи и устранить клинические симптомы синдрома нарушенного пищеварения.
При верифицированных внепеченочных билиарных дисфункциях вследствие холестероза фатерова сосочка (это, как правило, около 53% пациентов) в комплекс ное лечение ЛДС в течение 2—4 месяцев необходимо включать избирательный спазмолитический препарат Бускопан® (рис. 7).
Рис. 7. Сиинтиграммы печени и внепеченочных желч ных путей при холестерозе фатерова сосочка: длительная
задержка радиофармпрепарата в холедохе (1—2); восстанов ление транспорта в двенадцатиперстную кишку через 20 минут после приема бускопана® (3)
Орган-мишень — печень. Изучение кровотока в печени при нарушениях липидного обмена и ее струк туры ультразвуковыми и радиоизотопными методами позволило включить в липидный дистресс-синдром еще одно заболевание, которым вообще ранее не инте ресовались хирурги — жировой гепатоз. Признаки жирового перерождения печени имеются практически
у всех больных с нарушениями липидного метабо лизма. Но особенно они выражены после лечения статинами. На ранних стадиях это заболевание, как впрочем, и все заболевания, связанные с нарушениями липидного метаболизма, обратимо. Но это происходит при одном условии — полном исключении из схемы лечения ксенобиотиков. Комплексная терапия жиро вого гепатоза по программе ЛДС проводится в течение 8—12 месяцев.
Орган-мишень — поджелудочная железа. Нару шения липидного обмена являются ключевым звеном в патогенезе острого панкреатита у 30% больных. Длительная и стойкая нормализация уровней плазмен ных липидов позволяет предотвратить развитие необ ратимых изменений в поджелудочной железе и «атаки» острого панкреатита. Использование принципов лече ния ЛДС у пациентов, перенесших панкреонекроз, пре дупреждает развитие синдрома нарушенного пище варения (вторичного внешнесекреторного дефицита панкреатических ферментов). Лечение жирового панкреатоза проводится по стандартам терапии ЛДС.
Перитонит и его дисметаболические последст вия. Энтеросорбция через назоинтестинальный зонд с использованием особой жидкой формы ФИШант-С* при перитоните позволяет в первые сутки после операции значительно уменьшить эндотоксемию, предотвратить развитие полиорганной недостаточности и прогрессирование абдоминального сепсиса, быстро восста новить перистальтику и моторно-эвакуаторную функ цию кишечника, уменьшить время назоинтестинальной интубации, избежать необходимости проведения меди каментозной стимуляции кишечника.
Важным и принципиальным отличием ФИШант-С* от других энтеросорбентов служит высокая сорбционная емкость, поглощение эндотоксина не только из содер жимого кишечника, но и сорбция токсичных комплексов «желчные кислоты — эндотоксин», кроме того, он пре пятствуют всасыванию эндотоксина, способствует хоро шей эвакуации из кишечника, образуя защитную пленку на слизистой и благоприятно воздействуя на микробио ценоз кишечника в послеоперационном периоде.
Результаты исследования концентраций эндоток сина в плазме крови и содержимом кишечника у паци ентов после удаления назоинтестинального зонда до завершения антибактериальной терапии послужили основанием для выделения этого периода заболевания в особую стадию — стадию постэндотоксиновой агрес сии. Снизившиеся к моменту извлечения назоинтести нального зонда по сравнению с исходными значениями концентрации эндотоксина в плазме крови через 7—10 суток вновь повышаются в 2—3 раза (рис. 8). Логичным
861

Общие вопросы хирургии
|
1,6 |
TST |
ш |
1,4 |
|
|
|
|
СО |
1,2 |
|
X |
|
|
о |
|
0,9 |
it |
|
|
р |
0,8 |
|
X |
|
|
а |
0,6 |
|
се |
|
|
s |
|
|
=г |
|
|
СО |
0,4 |
|
о. |
|
|
I- |
|
|
X |
|
|
ф |
0,2 |
|
X |
|
|
о |
|
|
До операции |
После |
При выписке |
Норма |
|
энтеросорбции |
|
|
|
при удалении НИЗ |
|
|
Рис. 8. Изменение концентрации эндотоксина в плазме крови при лечении перитонита
негативным метаболическим исходом повторного повы шения эндотоксина в плазме крови и в содержимом кишечника является сохранение патофизиологичес ких условий для развития впоследствии ЛДС. Главной причиной также является ЭТ грамотрицательной мик рофлоры, реализующий свой патогенный потенциал с помощью широкого спектра медиаторов воспаления, повреждая, в первую очередь, эндотелий. Результатом является уже не абдоминальный сепсис, полиорганная недостаточность либо гнойно-септические осложне ния, свойственные перитониту, а развитие хронической патологии, в первую очередь, ЛДС в различных клини ческих формах.
Теория «эндотоксиновой агрессии», объяснившая основные механизмы патологического действия эндо токсина на организм человека, а также многочисленные результаты ее клинического применения в различных медицинских специальностях полностью подтвердили и еще больше укрепили клинические и фундаментальные научные позиции ЛДС Савельева.
Эндотоксиновая агрессия развивается при несо ответствии прироста эндотоксинсвязывающей актив ности крови избытку эндотоксина в общем кровотоке. Атеросклеротические поражения артерий (наиболее частого органа-мишени при липидном дистресс-синд роме) — не что иное, как манифестация эндотоксино вой агрессии и развившейся вследствие этого эндотелиальной дисфункции.
Эндотелиальная дисфункция играет существенную роль в патогенезе атеросклероза и его осложнений, гипертонической болезни и характеризуется дисба лансом между факторами релаксации и констрикции,
про- и антикоагулянтными субстанциями и между про- и антивоспалительными медиаторами.
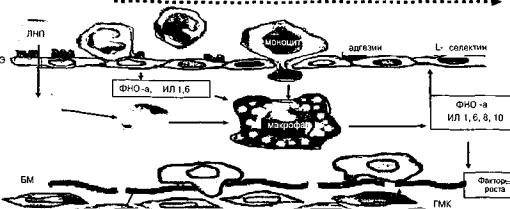
После перенесенного перитонита и выписки из хирургического стационара пациента нельзя считать выздоровевшим. Повторное увеличение концентра ций эндотоксина в кишечном содержимом и, главное, в плазме крови способствует инициации и/или прогрессированию атеросклероза (рис. 9):
тпод воздействием эндотоксина эндотелий синте зирует цитокины и рецепторы, ускоряющие про никновение моноцитов через эндотелий и накоп ление их в интиме;
•цитокины в интиме активируют макрофаги, акти вированные макрофаги секретируют цитокины, вновь активизирующие эндотелий;
•активированные эндотелиоциты со стороны кро вотока (эндотоксин) и со стороны интимы (мак рофаг) вызывают усиленную проницаемость липопротеидов низкой плотности, которые под воздейс твием цитокинов, вырабатываемых эндотелием, модифицируются (окисляются), легко захватыва ются рецепторами эндотелия и макрофагов, выде ляют дополнительные порции фактора некроза опухолей — альфа- и интерлейкина-1 и повторно активируют эндотелий и макрофаги, а также сек ретируют факторы роста с последующей миграци ей гладкомышечных клеток;
•липопротеиды высокой плотности помимо важной эндотоксинсвязывающей способности подавляют цитокин-индуцированную экспрессию селектинов, которые появляются на поверхности мембра ны эндотелиоцита после его активации эндоток-
862
Липидиый дистресс-синдром 0 хирургии
ЭНДОТОКСИНЫ
•<sQ^.
Рис. 9. Эндотоксининдуцированная эндотелиальная дисфункция после перитонита
сином, «захватывают» из кровотока и фиксируют на эндотелии моноциты и липопротеиды низкой плотности.
Противостоять и нивелировать развивающуюся после перитонита эндотелиальную дисфункцию могут меры, способные удалять или нейтрализовывать микро бные токсины и медиаторы воспаления, либо значитель но уменьшать их дисметаболические последствия.
В специальном исследовании, проведенном в нашей клинике 16 лет назад, была прослежена судьба паци ентов, перенесших перитонит. Из 34 выписанных после операции пациентов молодого возраста (до 45 лет) в течение 4—10 лет от различных сердечно-сосудистых заболеваний умер 21 больной (62%). При обследова нии выживших живых пациентов установлено, что у 8 из них (73%) имелась ишемическая болезнь сердца (1 перенес инфаркт миокарда), 1 пациент (9,1%) пере нес острое нарушение мозгового кровообращения, у 8 (73%) — гипертоническая болезнь, а у 7 (64%) — облитерирующий атеросклероз. Наиболее важным биохими ческим маркером у всех этих пациентов при выписке из стационара была крайне низкая (на 53%) концентрация липопротеидов высокой плотности. Других маркеров на тот период времени не существовало. Через много лет мы вновь вернулись к этой проблеме — к дисметаболическим последствиям перитонита, но уже вооруженны ми новыми знаниями и технологиями.
Обследование пациентов при выписке из стациона ра установило изменения, характерные для ЛДС — дислипопротеидемига, эндотоксинемию, повышение кон центрации высокочувствительного С-реактивного белка (эндотелиальную дисфункцию), выраженные наруше
ния метаболических функций печени, депрессию РЭС печени, тяжелый дисбиоз толстой кишки.
К наиболее важным биохимическим маркерам эндотоксининдуцированной эндотелиальной дисфун кции следует относить крайне низкую концентрацию липопротеидов высокой плотности, рассматриваемых в классической липидологии в виде антиатерогенного фактора, а в современной инфектологии как важный элемент антиэндотоксинового иммунитета. Низкие зна чения липопротеидов высокой плотности у пациентов не способны нейтрализовать эндотоксемию вследствие хирургической патологии и индуцированную антибио тиками.
Этот период после перенесенного перитонита харак теризуется выраженными нарушениями функций пече ни. Резко снижена активность клеток ретикулоэндотелиальной системы, замедлен синтез желчи гепатоцитами и транспорт ее из печени, снижена моторно-эваку- аторная функция желчного пузыря. Функциональные изменения печени сопровождаются патологическими структурными реконструкциями различных органов гепатопанкреатической зоны (увеличивается плотность стенки желчного пузыря, желчи, паренхимы печени, поджелудочной железы), характерными для поражений органов-мишеней при ЛДС.
Продолжение антибактериальной терапии после удаления назоинтестинального зонда негативно влияет на микробиоценоз толстой кишки: сохраняется тяжелый дисбиоз, выражающийся понижением общего уровня летучих жирных кислот и повышением анаэробного индекса, характерных для угнетения активности рези дентной микрофлоры кишечника.
863
Общие вопросы хирургии
Нарушения метаболических функций печени и депрес сия ее ретикулоэндотелиальной системы после перитони та являются прямым следствием нарушенного симбиоза в системе «микробиота-хозяин» в результате исходных и сохраняющихся после операции нарушений (эндотоксиновый стресс), порождающих взаимную агрессию микробиоты и «хозяина». Побеждает в этом «метаболическом поединке» микробиота при помощи активации «ударно го» ферментативного аппарата бактерий и высвобожде ния эндотоксина. Формирующиеся новые, либо сохраня ющиеся старые повреждения эпителия илеоцекального отдела кишечника и последствия синдрома избыточного бактериального роста, касающиеся в первую очередь, подвздошной кишки, нарушают циклы энтерогепатической циркуляции желчных кислот, в значительной мере изменяя холестериновый гомеостаз.
Нарушения метаболизма желчных кислот и холесте рина при сохраняющейся эндотоксинемии после пери тонита (или иной массивной эндотоксиновой агрессии) становятся важным патогенетическим звеном эндотелиальной дисфункции и ЛДС. Для лечения разрабо тан специальный комплекс, в основу которого также положены основные принципы лечения ЛДС - вос становление циклов энтерогепатической циркуляции желчных кислот, сорбция эндотоксинов, нормализация метаболических функций печени, коррекция дисбиоза кишечника, эндотелиопротекция и иммуномодуляция. В целом, лечение должно быть направлено на норма лизацию пищеварительно-транспортного конвейера и предотвращение поражений органов-мишеней (арте рий, печени и т.д.).
При использовании комплексной терапии липидный метаболизм, функции печени, морфофункциональные изменения органов гепатобилиарной зоны и микробиоценоз толстой кишки, а также концентрации эндо токсина в плазме крови и содержимом кишечника концентрация С-реактивного белка нормализуются. Но это происходит не ранее б—8 месяцев непрерывного лечения.
Базовый алгоритм лечения липидного дистресс-синдрома
•ФИШант-С* — 1 раз в неделю — 4—12 месяцев;
•гепабене* — по 1—2 капсулы 3 раза в сутки — 2—б месяцев (или другой растительный гепатопротекторный препарат);
•хилак форте* — по 40—60 капель 3 раза в сут ки — 2 недели, далее по 15—20 капель 3 раза в сутки — б—8 недель, затем пребиотики, пробиотики, синбиотики в различных комбинациях — 6—8 недель;
•антистакс'по 2 капсулы 1 раз в сутки 2—3 месяца 2 раза в год.
Таким образом, концепция липидного дистресс-син дрома наиболее полно на сегодняшний день раскры вает этиопатогенез многих заболеваний, связанных с нарушениями липидного метаболизма, хронической эндотоксиновой агрессией, нарушениями метаболиче ских функций печени и эндотелиальной дисфункцией и предлагает эффективный алгоритм их лечения.
1
864
ОЖОГОВАЯ ТРАВМА В ПРАКТИКЕ ХИРУРГА
СВ. Смирнов, B.C. Борисов
Специализация медицинской помощи уже доволь но давно привела к возникновению комбустиологии. Вместе с тем комбинированный характер поражения, как в мирное, так и в военное время диктует необходи мость для хирурга знаний принципов лечения ожоговой болезни.
Ожог — это один из видов травмы, возникающей под действием на ткани организма высокой темпе ратуры (пламя, горячая жидкость), электрического тока (технического или атмосферного — электроожог), химических агентов (кислоты, щелочи — химические ожоги). Обожженным называют человека, получив шего ожоговую травму. В структуре ожогового трав матизма на долю поражения пламенем приходится до 77,5%, горячей жидкостью — 15%, электрическим током— 2,5%, химическими агентами— 5% от всех пострадавших.
Классификация ожогов
ДЛЯ достижения единства в понимании ожоговой патологии, в тактике и методах ее лечения используют единые критерии для построения диагноза и прогноза, основанные на современной классификации ожогов. Ожоги классифицируют:
•по площади поражения (в % к поверхности тела);
•по глубине поражения (I, И, ША, ШБ, IV степе ни);
•по периодам течения ожоговой болезни (шок, ост рая ожоговая токсемия, септикотоксемия, реконвалесценция);
•по фазам течения раневого процесса (первичные анатомо-функциональные изменения, реактивно-
воспалительный процесс, регенерация).
Площадь термического поражения. Для ориенти ровочного определения площади поражения использу ют простые критерии — «Правило девятки» и «Правило ладони».
«Правило девятки» — согласно этому правилу, поверх ность головы и шеи взрослых составляет 9%, одной верхней конечности — 9%, одной нижней конечнос ти — 18% (бедро — 9%, голень и стопа — 9%); передняя поверхность туловища — 18%, задняя — 18%, промеж
ность и наружные половые органы — 1% поверхности тела (п.т.). Вся поверхность тела взрослых спереди составляет 51%, сзади — 49% п.т. Для оценки площади ожогов у детей «правило девятки» в представленном виде не применяется.
«Правило ладони» — это измерение ладонью пло щади термического ожога. Размер ладони взрослого человека составляет примерно 1% п.т. Данный способ применяют при ограниченных ожогах до 10%, или, напротив, при субтотальных поражениях. В последнем варианте определяют площадь непораженных участков тела и, вычитая полученную сумму из 100, получают процент поражения кожных покровов.
Глубина термического поражения. Поверхностные ожоги I, II, ША степени — при них возможна самостоя тельная эпителизация кожных покровов за счет сохра нившихся эпителиальных клеточных элементов.
Глубокие ожоги ШБ, IV степени — при них вос становление кожных покровов может быть достигнуто лишь оперативным путем за счет пересадки собственной кожи, сохранившейся вне зоны термической травмы.
За рубежом принята трехстепенная классификация, согласно которой ожоги подразделяются на поверхност ные (I степень), дермальные (II степень) и глубокие (III степень).
Под общей площадью ожогов понимают сумму циф ровых значений площадей поверхностного и глубокого поражения, выражаемую в процентах поверхности тела.
Прогноз ожоговой болезни
ДЛЯ определения прогноза ожоговой болезни (бла гоприятный, сомнительный, неблагоприятный) и опре деления возможной тяжести поражения удобно поль зоваться индексом Франка, согласно которому каждый процент поверхностного ожога соответствует 1 единице индекса, а каждый процент глубокого ожога — 3 еди ницам. Если сумма (индекс Франка) составляет от 30 до 70 единиц, то обычно наблюдают состояние больного средней степени тяжести, от 71 до 130 — тяжелое, 131 и более— крайне тяжелое. Для более точной интег-
33 S0 лекции по хирургии
865
Общие вопросы хирургии
ральной оценки тяжести поражения руководствуются эмпирическим индексом тяжести поражения (ИТП), представляющим интегральную составляющую площа дей поверхностного и глубокого ожогов, выраженную в единицах. При вычислении ИТП принимается, что 1% ожога соответствует: при ожогах I—II степени — 1 единицу, ША степени— 2, ШБ—IY степени— 3. При ингаляционной травме легкой степени тяжести значение ИТП увеличивается на 10 единиц, при тяже лой — на 30, при крайне тяжелой — на 45. Каждый год жизни пациента свыше 60 лет— 1 единица. При определении прогноза ожоговой болезни можно так же использовать «Правило 100» (ПС), представля ющее сумму цифровых значений возраста (в годах) и общей площади ожога (в %). Согласно ПС прогноз благоприятен при показателях до 60, относительно благоприятен от 61 до 80; сомнителен — от 81 до 100, неблагоприятен — более 101.
Патогенез ожоговой болезни
Патофизиологической основой местных изменений при термическом поражении является локальное выде ление медиаторов воспаления, повышение сосудистой проницаемости, тромбоз микрососудов.
Для минимальных ожогов характерны только мес тные нарушения. При поверхностном ожоге до 10— 12% п.т. или глубоком до 3—4% п.т. Ответ организма на травму сопровождается общими проявлениями: субфебрильным повышением температуры тела, умерен ным лейкоцитозом и/или сдвигом лейкоцитарной фор мулы влево, явлениями легкого недомогания, однако ожоговая болезнь не развивается. Ожоги II — ША ст. свыше 10—12% п.т. или ШБ ст. свыше 5% сопровожда ются развитием ожоговой болезни.
Клиническая периодизация ожоговой болезни
В клиническом течении ожоговой болезни отечес твенная классификация выделяет стадии ожогового шока, токсемии, септикотоксемии и реконвалесценции.
Стадия ожогового шока. Ожоговая травма свыше 10—12% п.т. сопровождается ожоговым шоком различ ной степени тяжести. Для ожогового шока в отличие от травматического не характерно падение артериально го давления, поскольку потери плазмы из сосудистого русла происходят постепенно.
Восстановление диуреза (более 40 мл/час) и купи рование гемоконцентрации (гемоглобин более 100 г/л, гематокрит около 35%) свидетельствуют об окончании ожогового шока и переходе ожоговой болезни в стадию токсемии, которая условно продолжается до 6—8 суток, а затем — в стадию септикотоксемии.
Стадии токсемии и септикотоксемии. Даже неосложненное течение стадий токсемии и септико токсемии ожоговой болезни протекает очень тяжело. Сознание больного остается ясным, однако он вял, заторможен, боли в ранах при движениях ограничива ют его активность даже в пределах постели. Быстро нарастает мышечная гипотрофия и слабость за счет прогрессирующей потери мышечной массы до 2—5 кг в неделю вследствие катаболизма белка.
Опасность генерализации инфекции при ожоговой болезни обусловлена не только микробной флорой, но также длительным угнетением адаптивного иммунитета.
Стадия реконвалесценции ожоговой болезни начи нается после полного восстановления кожного покро ва. Больной, перенесший обширные тяжелые ожоги, несколько оперативных вмешательств, длительный пос тельный режим с иммобилизацией, нуждается в реабили тации, которая может быть столь же продолжительной и трудоемкой, как и острый период ожоговой болезни.
Термоингаляционная травма
В структуре ожогового травматизма ингаляционная травма (ИТ) продолжает оставаться одной из наиболее тяжелых, сложных для диагностики и лечения острой патологией. Факторами риска возникновения ИТ явля ются: пожары или аварии в закрытом помещении, дли тельное пребывание в помещении с высокой степенью задымленности.
Жалобы пострадавших с ИТ являются типичными. Обычно больных беспокоят боли и першение в горле, осиплость (дисфония), афония, затрудненное дыхание, боли за грудиной, кашель.
Постановка диагноза ИТ от вдыхания дыма и про дуктов горения не представляет больших трудностей на основании клинических признаков, которые в некото рых случаях позволят судить даже о тяжести пораже ния. Дополнительную информацию несут инструмен тальные методы исследования.
Рентгенологическое исследование грудной клет ки в ранние сроки после травмы выявляет обогащение бронхососудистым рисунком легочной ткани.
Ларингоскопия позволяет выявить такие измене ния, как гиперемия и отек слизистой, рта, глотки, горта ни, определить наличие копоти.
866
Ожоговая травма в практике хирурга
Фибробронхоскопия (ФБС) — метод, который поз воляет получить истинную картину состояния трахеобронхиального дерева у пострадавших с ИТ. В настоящий момент создана новая классификация, объективно отра жающая степень тяжести поражения на основании пер вичных признаков, выделяющая 4 степени ИТ:
• I степень: при эндоскопическом исследовании отмечается гиперемия и отек слизистой голосовых связок, гортани, трахеи и бронхиального дерева, наложение копоти.
•II степень: наряду с отеком и гиперемией сли зистой трахеобронхиального дерева выявляются острые эрозии без фибрина до 0,1—0,3 см, лока лизующиеся преимущественно в трахее и на шпо рах долевых и сегментарных бронхов.
•III степень: на стенках трахеи и бронхов в пер вые сутки с момента травмы имеется большое количество фиксированной копоти от очаговых до циркулярных наложений. Слизистая дыха тельных путей во всех отделах отечна, гиперемирована с повышенной контактной и спонтан ной кровоточивостью. Эрозивные и язвенные изменения выявляются преимущественно в дистальных отделах трахеи и на шпорах бронхов. Секрета практически нет. Затем со вторых суток появляется секрет гнойного характера. После очищения слизистой трахеи и бронхов от копо ти определяются эрозии и язвы, покрытые фиб рином.
•IV степень: при поступлении отмечается тоталь ное наложение копоти на слизистой трахеи и бронхов. По мере удаления копоти обнажает ся язвенно-некротическая поверхность. Позже наблюдается разрастание грубой соединительной ткани.
Лечение. Комплекс лечебных мероприятий вклю чает:
•кортикостероидные препараты в/в (преднизолон 240—360 мг/сут или гидрокортизон 250—375 мг/сут);
•бронхолитики (2,4% раствор эуфиллина по 10 мл 3—5 раз в сутки);
•антибиотики широкого спектра действия (в/в, в/м, интратрахеально);
шгепарин 20—30 тыс. ед/сут в/в, затем подкожно;
•диуретики (лазикс 40—180 мг/сут);
•препараты, улучшающие реологические свойства крови (реополиглюкин, трентал);
•санационные фибробронхоскопии, ингаляции (растворы эуфиллина, новокаина, антисептиков, гидрокортизона, протеолитических ферментов, солкосерила);
•дыхательная гимнастика и вибромассаж грудной клетки.
Коррекция инфузионной терапии проводится с уче том тяжести ингаляционной травмы, при мониторинге центрального венозного давления, спонтантного темпа диуреза (не ниже 0,5—1 мл/кг/час), показателей крас ной крови.
В комплексе лечебных мероприятий чрезвычай но важное значение имеет локальное воздействие на пораженную слизистую дыхательного тракта. Весьма благоприятное действие оказывает сочетанное приме нение отечественного антисептика «мирамистин» (для санации) и эндоскопической лазерной терапии.
Электроожог
Под термином «электроожог» принято понимать местное повреждение организма электрическим током, возникающее в результате действия технического или атмосферного (молния) электричества.
Возможны следующие основные варианты пораже ния техническим электричеством:
ш при непосредственном контакте с проводником электрического тока;
• через дуговой контакт (для токов высокого напря жения);
ш от «шагового напряжения», возникающего из-за разности потенциалов на двух конечностях (на расстоянии одного шага), касающихся земли вбли зи лежащего на грунте провода.
Классификация электротравм по тяжести патологи ческого процесса (Френкель Г.Л., 1946; Березнева В.И., 1964):
•I степень — судорожное сокращение мышц без потери сознания;
•II степень — судорожное сокращение мышц и потеря сознания;
•III степень — потеря сознания и нарушение функ ции сердечной деятельности или дыхания (либо того и другого вместе);
•IV степень — клиническая смерть.
Местные явления. Повреждения на местах входа и выхода электрического тока отличаются многообра зием. Наиболее характерными являются «знаки тока». Они представляют собой участки сухого некроза округ лой, эллипсоидной или линейной формы, иногда в виде отпечатка проводника, цвет их пепельноили грязносерый, бледно-желтый или молочный. В центре имеется втяжение, более темное, края приподняты и несколько светлее. Иногда знаки тока имеют вид подсыхающего пузыря после ожога, но наполненного не экссудатом.
867
Общие вопросы хирургии
а газом. Для течения процесса характерно длительное анабиотическое состояние тканей в области повреж дения, скрытый период и медленное развитие. Нередко очаги некроза располагаются под внешне здоровой кожей. Отсюда возникают трудности в определении границ повреждения сразу после травмы.
Поражения от разрядов атмосферного электри чества (удар молнией). Молния представляет собой гигантский электрический разряд в атмосфере силой до 2000 ампер, напряжением до 1 млн V, тепловой энерги ей до 5000 Дж; длительность разряда составляет доли секунды (0,0001 с). Поражающими факторами молнии являются: 1) электрический ток, 2) световая и звуковая энергия, 3) ударная волна. У пострадавших наблюдают ся явления сотрясения мозга, шока. Затем появляется сонливость, подавленность, головная боль или, реже, возбужденное состояние. Нередки различные цере бральные явления, расстройства сердечно-сосудистой и дыхательной деятельности, легочные кровотечения, расстройства пищеварения, мочеиспускания, зрения, слуха, разрывы мышц и т.д. Местные явления представ ляются в виде точечных пятен или следов в виде поро ховых выстрелов, ожоговых ран и фигур молнии.
Лечение. Первая помощь при электротравме долж на оказываться немедленно, непосредственно на месте происшествия и состоит в быстром освобождении пострадавшего от контакта с электрическим током (отключение рубильника или выключателя, отделение токоведущей части от человека, вытягивание постра давшего, перерубание или перерезка провода и т.д.). Если видимые признаки жизни отсутствуют, тотчас и настойчиво применяют меры оживления (громкий окрик, искусственное дыхание рот в рот, непрямой массаж сердца). Эвакуировать пострадавшего следу ет только в лежачем положении в приемное отделе ние многопрофильной больницы, или ожоговый центр. Легко пострадавших с площадью ожога до 5%, без нару шений функций органов и систем, отсутствии потери сознания во время электротравмы помещают в палату интенсивной терапии для тщательного клинического наблюдения. Тяжело пострадавшие с площадью ожогов свыше 5%, с признаками явной электротравмы должны находиться в реанимационном отделении.
Основной принцип местного лечения электроожогов заключается в ранней активной хирургической тактике, которая состоит из:
ш декомпрессионной некротомии;
•некрэктомии и остеонекрэктомии;
•превентивной перевязки сосудов;
•ампутации и экзартикуляции;
•аутодермопластики;
• хирургического лечения осложнений (вскрытие |
' |
абсцессов и флегмон). |
i |
Декомпрессионная некротомия — это своевре |
|
менная некротомия, выполненная в первые часы или |
|
сутки (тогда можно достичь максимального эффекта). |
|
Некротомия носит лечебный характер: улучшает отток, |
|
снижает сдавление сосудов, может предотвратить вто |
|
ричный ишемический некроз при циркулярных глубо |
|
ких ожогах. Является одновременно диагностическим |
|
приемом для определения границ некроза и выработки |
|
дальнейшей тактики лечения. Если больной поступает рано (в течение 5 суток) до манифестации токсемии (до микробной инвазии), и если позволяет состояние больного — надо отдать предпочтение ранней некрэк томии с последующей реконструктивно-восстанови- тельной операцией (микрохирургической), если есть чем закрыть иссеченные участки ткани. Если больной поступает поздно (после 5 суток), несвоевременно, развивается токсемия (наличие микробной инвазии), операция осуществляется по жизненным показаниям. Если закрыть рану собственной кожей не представляет ся возможным, необходимо прикрыть дефект раневыми покрытиями, а затем производить этапные некрэкто мии, возможно применение пластики лоскутами и т.д. Ампутация производится от 26 до 70% больных с элек троожогами.
Химические ожоги
Химические ожоги возникают в результате воздей ствия на кожу или слизистые едких жидкостей, концен трированных кислот, щелочей и солей некоторых тяжелых металлов. Химические ожоги встречаются значительно реже, чем термические, и составляют от 2,5 до 5,1% слу чаев в общей структуре ожогового травматизма. Чаще всего они имеют ограниченный характер и в 90% слу чаев не превышают 10% поверхности тела. Необходимо отметить, что химические вещества вызывают не только ожоги, но и контактные дерматиты. Первая помощь оказывается в обильном промывании ожога проточной водой независимо от состава агента (за исключением негашеной извести). Ожог следует промывать в течение, по меньшей мере, 30 минут. Одежда, пропитанная хими ческим веществом, должна быть сразу удалена.
Поражения кислотами. В месте контакта с кисло той образуется сухой струп, который имеет четкие гра ницы и, как правило, не возвышается над кожей, а даже западает в виде углубления. Сильное прижигающее и обезвоживающее действие кислот практически полно стью исключает образование пузырей. Поражение часто имеет характер термохимического. При попадании на
868
Ожоговая травма в практике хирурга
кожу серной кислоты образуется струп грязно-серого или коричневого цвета. Азотная кислота поражает кожу сильнее, чем серная кислота с образованием струпа зеленовато-желтого цвета. Соляная кислота в техниче ских концентрациях образует некрозы серо-сапфир ного цвета. Уксусная кислота относится к слабым кис лотам и формирует поверхностный струп зеленоватого цвета, препятствующий глубокому проникновению ее в ткани. Поэтому глубокие поражения кожи развиваются относительно редко.
Поражение щелочами. Действие щелочей заклю чается не в коагуляции белковых веществ, а в их рас плавлении, что часто приводит к глубокому пораже нию тканей. Образуется влажный некроз грязно-белого цвета.
Первая и неотложная помощь при термических ожогах
При оказании помощи обожженным на месте происшествия следует:
1.Удалить пострадавшего из опасной зоны.
2.Прекратить действие поражающего фактора (горячая жидкость, пламя, химические вещества) на организм.
3.При необходимости восстановить проходимость дыхательных путей (удалить слизь, копоть, рвотные массы из полости и глотки, устранить западение языка), при отсутствии дыхательных движений осуществить искусственное дыхание.
4.Охладить обожженные участки тела водой или прикладыванием холодных предметов.
5.При наличии обширных ожогов ввести обезболи вающие препараты.
6.Наложить на раны повязки из стерильных пере вязочных средств или подручных материалов.
7.При поражении кистей снять кольца для предо твращения развития отека и ишемии пальцев.
8.Доставить пострадавшего в лечебное учрежде ние для оказания первой медицинской помощи.
Первая медицинская помощь (в приемном отделе нии) включает обеспечение проходимости дыхательных путей, восстановление и стабилизацию кровообраще ния и дыхания, оценку сопутствующих повреждений.
Впервые часы после травмы основные усилия должны быть направлены на лечение шока, а не ожоговой раны. Медицинские работники:
•обеспечивают проходимость дыхательных путей;
•измеряют основные физиологические показатели, включая температуру тела;
•раздевают и взвешивают больного;
•устанавливают венозный катетер наибольшего диаметра;
•начинают инфузию кристаллоидных препаратов;
•рассчитывают потребность в растворах для инфузионной терапии;
•определяют площадь ожогов I—II—ША-Б—IV степени;
•устанавливают мочевой катетер;
•устанавливают назогастральный зонд (при ожогах более 25% поверхности тела);
•назначают седативные и обезболивающие препа раты;
•проводят профилактику столбняка;
•выполняют первичный туалет ожоговой раны;.
•решают вопрос о госпитализации больного в лечебное учреждение.
Показания для госпитализации:
•пострадавшие с ожогами I—II—ША степени более 10—12% п.т.;
•ожоги ШБ степени более 2% п.т.;
•все ожоги IV степени;
•термические поражения органов дыхания (даже при отсутствии ожогов кожи);
•ожоги особых локализаций (лица, кистей, стоп, промежности, половых органов);
•группа пострадавших повышенного риска (лица старше 65 лет, наличие тяжелой сопутствующей патологии).
Инфузионно-трансфузионная терапия ожоговой болезни в различные ее периоды
Проведение инфузионно-трансфузионной терапии у ожоговых больных необходимо начинать с соблю дения правила трех катетеров: 1) катетеризация цент ральной вены; 2) заведение уретрального катетера; 3) установка носового катетера для инсуфляции увлаж ненного кислорода. При невозможности использовать внутривенный метод, в критической ситуации может быть использован внутриартериальный метод введения инфузионных сред.
Ожоговый шок. Неотложную инфузионно-трансфу- зионную терапию назначают всем больным, находящим ся в состоянии ожогового шока или тем из них, которым угрожает его развитие.
Показания к трансфузии. Основным патогенетичес ким показанием к применению инфузионно-трансфузи онной терапии ожогового шока служат расстройства кровообращения и нарушение обменных процессов.
869
Общие вопросы хирургии
Главными задачами инфузионной терапии в периоде ожогового шока являются:
•борьба с болевым синдромом, предоставление больному условий физического и психического покоя, перевод пациента в состояние седации;
•восстановление объема циркулирующей крови, ликвидация гемоконцентрации, увеличение сер дечного выброса, улучшение микроциркуляции; устранение кислородной недостаточности, нару шений водно-солевого и кислотно-щелочного равновесия;
•борьба с синдромом гиперкоагуляции, профилак тика ДВС-синдрома;
•поддержание и стимуляция мочевыделительной функции почек;
•защита и стабилизация клеточных мембран, уст ранение вентиляционной, циркуляторной и транс портной гипоксии и гипоксемии;
•коррекция расстройств энергетического гомеостаза;
•по показаниям — антибактериальная и иммунозамещающая терапия.
Выбор инфузионных сред для лечения ожогового шока сводится, в основном, к замещению четырех ком понентов: воды, солей, белков и эритроцитов.
Дозы инфузионных сред для лечения больных в периоде ожогового шока чаще всего основываются на формулах, учитывающих общую площадь поражения и вес больного. Наиболее широко распространена фор мула Эванса, согласно которой обожженному вводятся:
•в первые 24 часа после травмы:
—растворы электролитов — 1 мл х % ожога х вес тела в кг;
—коллоидные растворы 1 мл х % ожога х вес тела
вкг;
—5% раствор глюкозы — 2000 мл;
—2/3 суточного количества инфузионных сред вводится в первые 8—12 часов;
•во вторые 24 часа:
—1/2 объемов растворов электролитов и колло идных жидкостей, перелитых в первые 24 часа;
—5% раствора глюкозы — 2000 мл.
Инфузионно-трансфузионная терапия ожогово го шока не ограничивается введением одних жидко стей. Одновременно необходим комплекс мероприятий, направленный на введение обезболивающих (1% рас твор морфина и 2% раствор промедола в сочетании с 50% раствором анальгина), кардиотонических средств, аитигипоксантов. Значительному улучшению кровоснаб жения мышцы сердца и почек способствует эуфиллин, обладающий и диуретическим действием. Для снижения
проявлений гиперкоагуляционного синдрома и профи лактики коагулопатии потребления обязательно вво дится гепарин с антиагрегантами. Обычно используется схема: 5 000 ЕД гепарина через 4 часа, с поддержанием времени свертывания крови в пределах 5—7 минут по Ли—Уайту. Кроме того, необходимо введение полно го комплекса витаминов: аскорбиновой кислоты — по 10— 20 мл 5% раствора до 2—3 раз в сутки, витамина В1( В6 по 5,0 мл 2,5% раствора тиамина хлорида и 1% раство ра пиридоксина хлорида, витамина В12 по 100—200 мкг 3 раза в сутки, а также кокарбоксилазу, АТФ, цитохром С (по 50—100 мг 2—3 раза в сутки).
С целью ингибиции протеолиза и ферментов калли- креин-кининовой системы в состав инфузионных сред целесообразно вводить контрикал по 100 000 ЕД или гордокс по 500 000 ЕД в сутки.
Основными критериями выхода обожженных из шока являются:
•восстановление 0ЦК, сердечного выброса, норма лизация артериального давления, пульса;
•адекватный диурез (более 60 мл/ч);
•повышение температуры тела выше 37°С;
•отсутствие жажды, отсутствие тошноты и рвоты. Констатация факта окончания периода шока важна
не только в практике специализированной медицинской помощи, но особенно при решении вопроса о транс портабельности пострадавших на дальнейших этапах эвакуации.
Острая ожоговая токсемия. Основным патогенети ческим показанием к проведению инфузионно-трансфу- зионной терапии в периоде острой ожоговой токсемии служат интоксикация, расстройства периферической перфузии тканей, нарушение обмена веществ и анемия. С целью дезинтоксикации и улучшения периферического кровообращения используются низкомолекулярные плазмозамещающие растворы. Снижению явлений интоксика ции способствует включение в комплекс инфузионных сред осмотических диуретиков (20% раствор маннитола, 30% раствор мочевины и др.). Вливание их целесообраз но чередовать с внутривенным введением низкомолеку лярных плазмозамещающих растворов, что обеспечивает форсированный диурез. Для уменьшения гипопротеинемии, и в первую очередь, гипоальбуминемии используют ся переливания плазмы, альбумина, протеина.
Необходимым является применение препаратов парентерального питания (гидролизаты белка, раство ры синтетических аминокислот (аминоплазмаль, аминостерил, аминосол, полиамин и др.), глюкозы, рас творы калия, натрия, жировые эмульсин (интралипид, липофундин С, инфузолипол и др.), микроэлементы, витамины). С целью профилактики и борьбы с анемией
870
