
хирургия 5 курс / книги / Savel'ev V.S. (red.) 80 lekcij po hirurgii (Litterra, 2008)(ru)(T)(K)(910s)(ISBN 9785982161190)
.pdfРак поджелудочной железы
нить эту артерию, но расстройств кровообращения и связанных с этим осложнений мы не наблюдали.
В многофакторном анализе ближайших и отдален ных исходов 201 ПДР в стандартном варианте и с сохранением привратника клиника J. Hopkins из США, которая располагает крупнейшим в мире опытом таких операций, показывает предпочтительность органосберегающей операции по многим мотивам, включая онкологические.
W. Kozuschek и соавт. (1994) из университетской клиники г. Бохум (Германия), сравнивая стандартную ПДР (15 пациентов) и с сохранением привратника (43 пациента) у больных опухолями головки подже лудочной железы и периампулярной зоны, отмети ли, что только при сохраненном привратнике не
было ни одного случая образования пептических язв зоны анастомоза, демпинг-синдрома, остава лось нормальным время прохождения пищи по желудочно-кишечному тракту, умеренно проявля лась экзокринная недостаточность поджелудочной железы и незначительно был затронут метабо лизм глюкозы. Через б и 12 месяцев после операции дооперационную массу тела восстановили 75 и 86% пациентов с сохраненным привратником, тогда как при гастропанкреатодуоденальной резекции только 35 и 43%, соответственно.
Основным ключом в определении резектабельности опухоли головки поджелудочной железы является взаи мосвязь ее с верхними брыжеечными сосудами и ворот ной веной. Инвазия опухоли в брыжеечные сосуды, особенно вены, нередко устанавливается только после пересечения шейки поджелудочной железы и полного обнажения сосудов. Поэтому уже на этапе ревизии при ощущении тесного контакта опухоли с сосудами здесь часто целесообразно привлекать ультразвуковое исследование.
Для своевременного установления опухолевой инва зии в венозные стволы после мобилизации двенадцати перстной кишки по Кохеру целесообразно использовать и другой прием. J. Howard — первый американский хирург, который избежал летальности в большой серии панкреатодуоденальных резекций, на первом этапе рекомендует произвести холецистэктомию, пересечь желчный проток и по воротной вене подойти к верхней брыжеечной вене. Именно в этой зоне чаще всего име ется опухолевая инвазия в сосуды. Такой тактический прием позволяет избежать пересечения шейки железы при заведомо нерезектабельной опухоли.
Среди 114 радикально оперированных в институте хирургии больных раком поджелудочной железы подав ляющее большинство перенесли стандартную ПДР.
Реконструктивный этап после ПДР в большинстве клиник со значительным опытом таких операций стан дартизирован. Анастомозы с культей поджелудочной железы, желчного протока, желудка или двенадца типерстной кишки осуществляются на единой петле
тощей кишки. По нашему опыту, это также упрощает тех нику операции, не повышает риск развития типичных пос леоперационных осложнений или тяжесть их течения.
Ахиллесовой пятой операции ПДР всегда являлся панкреатодигестивный анастомоз. Его несостоятель ность, чаще вследствие послеоперационного панкреа тита, и цепь последующих осложнений остаются основ ной причиной летальных исходов после ПДР. В опыте института хирургии — выполнения более 300 ПДР при различных заболеваниях, и апробированы все виды панкреатодигестивных анастомозов.
В последние годы мы полностью отказались от окклюзионных анастомозов, редко используем наруж но-внутреннее дренирование протока культи железы и придерживаемся избирательной тактики формирова ния панкреатодигестивных анастомозов. На наш взгляд,
для культи железы с малоизмененной паренхимой и узким ее протоком предпочтительны инвагинационный панкреатоеюноили панкреатогастроанастомоз
с погружением всего среза железы в просвет кишки или желудка. Если в паренхиме железы имеются фиб розные изменения и расширен главный панкреатичес кий проток, минимальный риск осложнений возникает при терминолатеральном анастомозе с изолированным вшиванием протока или терминолатеролатеральном панкреатоеюноанастомозе.
Возможно, снижению частоты несостоятельности панкреатодигестивных анастомозов в последние годы способствовала не только избирательная техника их выполнения, но и совершенствование интенсивной терапии, широкое использование октреотида, эффек тивная декомпрессия желудочно-кишечного тракта и раннее зондовое питание.
Частота рака дистальных отделов поджелудочной железы не превышает 20%. Но при такой локализа ции частота резектабельности опухолей драматически низка из-за скудных клинических проявлений в течение длительного времени и диагностики на этапе прораста ния в соседние органы и магистральные сосуды. Вместе с тем нельзя не отметить, что практически во всех широ ко известных отечественных руководствах по хирургии поджелудочной железы не обсуждается онкологически обоснованный объем ее резекции при локализации раковой опухоли в левых отделах.
Европейский консенсус дает в этом отношении чет кие определения.
591
Оннохирургия
Стандартная дистальная резекция поджелудочной железы — это резекция дистальных отделов железы, дополненная спленэктомией, при которой поджелудоч ная железа пересекается справа от верхней брыжееч ной или воротной вены с пересечением селезеночной артерии у ее устья, пересечением нижней брыжеечной вены и селезеночной вены непосредственно у конфлюенса воротной вены. Эта операция дополняется удале нием лимфатических узлов следующих групп: вокруг чревного ствола, в воротах селезенки, вдоль селезеноч ной артерии и по нижнему краю тела и хвоста железы.
Радикальная дистальная резекция поджелудоч ной железы подразумевает также иссечение в блоке следующих групп лимфоузлов: вдоль общей печеноч ной артерии, вдоль верхней брыжеечной артерии и вдоль верхней брыжеечной вены, от верхнего края чревного ствола до нижнего края левой почечной вены, от нижнего края левой почечной вены до верхнего края устья нижней брыжеечной артерии. Левосторонняя адреналэктомия не обязательна.
Касаясь результатов ПДР, следует отметить, что эта операция все еще имеет высокий риск тяжелых ослож нений и летальных исходов. Во многих отечественных и зарубежных клиниках летальность достигает 15—20%. Лишь в немногих клиниках (Патютко Ю.И. — РОНЦ; J. Howard и J. Camerom — США; М. Trede — Германия) удалось избежать летальных исходов при опыте более 100 ПДР.
Крупнейший в России опыт хирургии рака подже лудочной железы представляет Н.Н. Артемьева с соавт. (1999) из Санкт-Петербурга. В течение 18 лет они наблю дали 651 больного, среди которых у 76,5% опухоль лока лизовалась в головке железы. ПДР удалось осуществить у 127 больных. Послеоперационная летальность соста вила 8,7%. Резектабельность достигала 22%.
Среди послеоперационных осложнений главенс твующее значение имеют внутрибрюшные и желудочнокишечные кровотечения, послеоперационный панкреа тит, несостоятельность панкреато- и билиодигестивного анастомоза, перитонит. По нашему опыту, в условиях адекватного дренирования брюшной полости несосто ятельность этих анастомозов редко требует повторных оперативных вмешательств или имеет фатальные пос ледствия. Кроме того, широкое использование чрескожных пункционно-дренирующих вмешательств под ультразвуковым наведением позволяет в большинстве случаев эффективно устранить и изолированные скоп ления жидкости, и гнойники. Уменьшение частоты пал лиативных ПДР, совершенствование техники операции и интенсивной терапии позволило нам в последние годы снизить летальность при этой операции с 17 до 5%.
Рассматривая отдаленные результаты радикально го хирургического лечения, следует подчеркнуть, что протоковая аденокарцинома поджелудочной железы характеризуется высокой онкологической агрессивно стью и непредсказуемостью в исходах. Отсутствие строгой зависимости между отдаленными результатами, формальными характеристиками опухолевого процесса (стадия заболевания ко времени операции, морфологи ческая зрелость опухоли, отдельные молекулярно-гене- тические ее особенности и др.), объемом оперативного вмешательства и лечения в целом не находит пока объ яснения и не имеет каких-либо закономерностей.
В этом отношении интересны данные Hans Beger, который обобщил опыт и провел многофакторный его анализ у 9 мировых лидеров в хирургии рака поджелу дочной железы (Allison D.C.; Cameron J.; Ishikawa 0.; Pedrazzoli S.; Trede M. и др). При этом показано, что среди большого числа принятых во внимание факторов
на выживаемость после панкреатодуоденальной резекции достоверно негативно влияют лишь раз меры опухоли более 2 см, инвазия ее в сосуды, объем трансфузии крови более 500 или 1000 мл, метастазы в регионарных лимфоузлах, низкая сте пень дифференцировки опухоли, анэуплоидность ДНК в опухоли, локализация опухоли в крючковидном отростке. Масштаб лимфодиссекции также досто верно не влиял на выживаемость в отдаленные сроки.
К таким выводам приходят едва ли не все специ алисты в этой сфере. Так, R. Tsuchiya и N. Fujisava из Нагасаки полагают, что до появления отдаленных мета стазов основные наши локальные ориентиры — размер опухоли, даже прорастание ею капсулы поджелудочной железы или вовлечение регионарных лимфоузлов — не являются абсолютным отражением далеко зашедшей стадии опухоли в общепринятом ее понимании. К 1986 г. авторы собрали много случаев протоковой аденокарциномы размером менее 2 см. Пятилетняя выживаемость у таких больных после операции составила 30,3%. В то же время 5-летняя кумулятивная послеоперационная выживаемость в целом при раке 1-й стадии (без пораже ния лимфоузлов, прорастания капсулы, ретроперитонеальной и сосудистой инвазии) достигла всего лишь 37%, С другой стороны, при маленьком раке поджелудочной железы 30% больных имели поражение лимфоузлов, 20% прорастание капсулы, 12 и 9%, соответственно, имели ретроперитонеальную и сосудистую инвазию.
Эти данные подтверждают известный постулат в он кологии «маленький рак — не всегда ранний рак». 8 этом отношении еще более выразительные данные представ ляют 0. Ishikawa с соавт. (1996), которые среди 26 боль ных с опухолью размером менее 1 см отметили 5-летнюю
592
Ран поджелудочной железы
выживаемость только 67% из них. Совершенно очевидно, что имеется некоторая зависимость между стадией опу холи и сроками выживаемости. Но один лишь размер
опухоли реально не является исчерпывающей харак теристикой стадии заболевания. Такова особенность именно рака поджелудочной железы.
Тем не менее в хирургическом лечении рака подже лудочной железы в последние десятилетия отмечается значительный прогресс. По данным многих зарубежных авторов, удается достигнуть неуклонно возрастающего уровня 5-летней выживаемости.
Согласно данным Национального ракового банка данных США, обобщающим сведения о 18 000 пациен тах, показано, что 5-летняя выживаемость у опериро ванных больных составляет 12 и 4% у неоперированных пациентов (Cameron J.I., 2000).
По данным Н.Н. Артемьевой с соавт. (1990), сред няя продолжительность жизни после ПДР составляла 17,4 месяца, но при 1—2-й стадии без вовлечения лим фоузлов она достигала 26,4 месяца. В преобладающей по числу больных группе паллиативных вмешательств медиана выживаемости не превышала 6 месяцев.
Интересно, что авторы наблюдали 13 случаев рака головки поджелудочной железы размером до 2 см. Всем больным выполнена ПДР. В половине случаев выявлены метастазы в регионарных лимфатических узлах. Лишь 4 пациента живут более трех лет.
В большом опыте хирургии рака поджелудочной железы в Российском онкологическом научном центре не наблюдалось 5-летней выживаемости при протоковой аденокарциноме как при стандартной, так и при расширенной ПДР. По мнению Ю.И. Патютко, случаи 5-летней выживаемости есть не более чем результат ошибки морфологического диагноза.
По данным нашего института, кумулятивная выжи ваемость в течение 3 лет после радикальных операций составила 20,3%, а через 5 лет только 2,9%. Медиана выживаемости при этом составила около 17 месяцев.
Таким образом, в отношении рака поджелудочной железы как одного из лидирующих в онкологии забо левания в настоящее время должна быть предпринята
широкая система мер по ранней диагностике, профи лактическому обследованию групп риска, расширению доступности радикального хирургического и комбини рованного лечения. Во всех индустриально развитых странах эта проблема давно последовательно решается на государственном уровне.
Литература
1.Pedrozzoli S., Berger H.G., Obertop Н., Andren-Sandberg A. et at. A surgical and pathological Based Classification ofresective treatment of pancreatic cancer. Dig. Surg., 1999, v. 16, № 4, p. 337—345.
2.Crist D.W., Cameron 3.L. The current status of the Whipple operation for periampullary carcinoma. Adv. Surgery, 1992,
v.25, № 21.
3.Janes R.N., Niederhuber J.E., Chmiel 3.S. et al. National pat terns of care for pancreatic cancer. Annals of Surgery, 1996, № 223, p. 261.
4.Moon Y.M., Kim W.A., Shin S.T. et al. A study of 122 cases of pancreatic cancer diagnosed by endoscopic retrograde cholan giopancreatography (ERCP). Korean J. Intern. Med., 1986, № 1,
p.131—139.
5.McPerson J.A., Benjamin I.S., Hodgson H.J.F. Preoperative percutaneous transhepatic biliary drainage: the results of a controlled trial. Br. J. Surg., 1984, v. 71, p. 371—375.
6.Pitt H.A., Gomes A.S., Lois 3.F. Does preoperative percutaneous biliary drainage reduce operative risk or increase hospital cost? Ann.Surg., 1985, № 201, p. 545—553.
7.Todd K.E., Lane J.S., Reber H.A. Questions most commonly asked regarding pancreatic cancer. Problems in general sur gery, 1997, v. 14, № 2, p. 27—32.
8.Crist D. W., Cameron J.L. Current status of pancreaticoduodenec tomy for periampullary carcinoma. Hepatogastroenterology. 1989, v. 36, p. 478—485.
9.Ishikawa 0., Imaoka S., Ohigashi H. et al. A new method of intra operative cytodiagnosis for more precisely locating the occult neoplasms of the pancreas. Surgery, 1992, № 111, p. 294—300.
10.Warshaw A.L., Gu I., Wittenberg J. et al. Preoperative staging and assesment of resectability of pancreatic cancer. Arch. Surg., 1990, v. 125, p. 230—233.
593
ДИАГНОСТИКА И ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ МЕТАСТАТИЧЕСКИХ ПОРАЖЕНИЙ ПЕЧЕНИ
В.Д. Федоров
Всвязи с ростом числа онкологических заболеваний,
атакже появлением современного диагностического оборудования и методик в последнее время отмечается увеличение количества больных с метастатическими поражениями печени различной природы. К настояще му моменту в мире накоплен огромный опыт лечения таких пациентов.
случаях целесообразно использовать классификацию German. Единый подход к классификации крайне важен для сравнения результатов лечения в различных кли никах. Первые работы, обобщающие данные по тера пии метастатического рака печени, были представле ны Adson M.A., van Heerden J.A. (1980) и Foster G.H., LundyJ. (1981).
История вопроса
Первое вмешательство по поводу опухоли левой доли печени было выполнено в 1887 г. немецким хирур гом Карлом Лангенбушем. В то же время регулярные элективные оперативные вмешательства на печени по поводу метастазов злокачественных опухолей стали производиться лишь в 70—80-е годы прошлого сто летия. Это было связано с несколькими факторами. К этому периоду был накоплен опыт консервативно го лечения метастазов в печени различного генеза, который свидетельствовал о неудовлетворительных результатах различных вариантов изолированного химиотерапевтического и лучевого воздействия. В то же время анализ результатов резекций печени говорил о возможности значительного продления жизни при ряде онкологических заболеваний, сопровождавшихся метастазами в печени.
Первые клинические классификации метастазов в печени были предложены Pettavel (1978), Taylor (1981) и German (1982, 1985). К I стадии метастатического поражения печени относят единичный метастаз, зани мающий не более 25% объема печени, ко II стадии — множественные и билобарные метастазы объемом не более 25%, а также единичный метастаз объемом от 25 до 50%, к III стадии — множественные и билобарные метастазы объемом 25—50%, а также метастазы общим объемом более 50% (5,6). 8 последние годы при колоректальных метастазах в печени стали чаще использо вать mTNM классификацию, предложенную Iwatsuki S.C. с соавт. в 1986 г.
Мы в своей практике предпочитаем mTNM класси фикацию, позволяющую более точно оценить стадию процесса и его прогноз. До сих пор отсутствует единая классификация неколоректальных метастазов, в этих
Этиология и патогенез
При метастазировании злокачественных опухолей раз личной локализации наиболее часто поражается печень.
По секционным данным, метастазы в печени выявля ются у 36% больных со злокачественными опухолями
(Foster G.H., Lundy J., 1981). Наиболее частыми первич ными очагами при этом являются опухоли толстой и тон кой кишки, желудка, поджелудочной железы, гениталий. Реже в печень метастазируют злокачественные опухоли почек, простаты, легких, кожи, мягких тканей, костей и головного мозга. Наиболее частыми путями распростра нения злокачественных клеток является лимфогенный
игематогенный. В этой связи большое значение имеет абластичное выполнение операций по поводу первичных опухолей (лимфодиссекция, предварительная перевязка сосудов, кровоснабжающих резецируемый орган), а также системная химиотерапия после радикальных оперативных вмешательств. Скорость роста метастазов определя
ется, прежде всего, биологией первичной опухоли,
атакже состоянием иммунной системы пациента. Многочисленные исследования показали, что метастазы имеют преимущественно артериальное кровоснабжение, индуцируют неоангиогенез с формированием патологи ческих сосудов. Быстрый рост метастазов в виду актив ного метаболизма и деления опухолевых клеток приводит к ишемии в центральных участках узлов с их последую щим некрозом. Соотношение процессов роста, некроза
иперифокальной реакции здоровой паренхимы печени обуславливают разнообразие семиотики метастатических образований, по данным ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резо нансной томографии (МРТ).
Время удвоения метастазов колоректального рака в печени составляет от 50 до 112 дней, при этом большая
594
Диагностика и хирургическое печение метастатических поражений печени
часть МТС выявляется при размерах 1 см3 (10 млрд кле ток). Таким образом, если объем очага составляет 1 мм3, то его теоретически можно выявить через 10 месяцев (Bozzetti F. et at., 1987).
Диагностика метастазов в печени
При выявлении очагов в печени следует иметь в виду, что в 95% случаев опухолевого поражения печени оно является метастатическим. Это правило относится, прежде всего, к европейским странам. В странах ЮгоВосточного региона преобладающей патологией явля ется первичный рак печени.
Онкологическая настороженность особенно важна у больных, ранее оперированных по поводу злокачествен ных опухолей. Регулярные динамические обследования в группах высокого риска позволяют выявлять метастазы на ранних стадиях, что влияет на результаты лечения.
Диагностика метастазов включает обязательное выполнение комплексного ультразвукового исследо вания, спиральной компьютерной томографии (СКТ), а также определение уровня опухолевых маркеров.
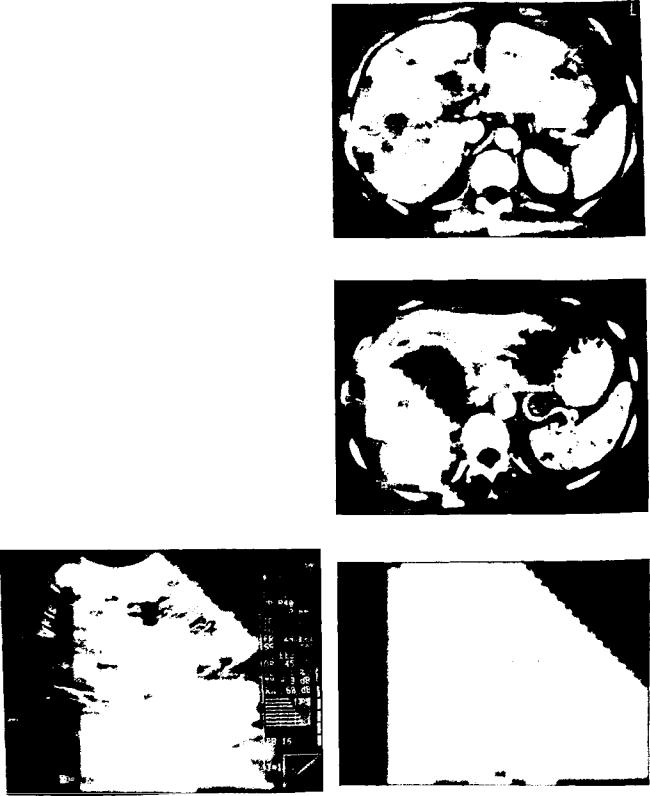
Для колоректальных метастазов при УЗИ характер ным признаком является симптом «бычьего глаза» и наличие кальцинатов (рис. 1), при СКТ — неровность и неоднородность контрастирования и появление гипер контрастного ободка в артериальную фазу (рис. 2). Метастазы рака яичника и матки могут иметь кистозносолидную структуру (рис. 3). Метастазы хорошо васкуляризированы, что подтверждается при СКТ, ангиографии (рис. 4) и цветном дуплексном картировании (рис. 5).
Трудности диагностики возникают при небольших
Рис. 2. СКТ. Артериальная фаза. Метастазы в печени
Рис. 3. СКТ при метастазах кистозио-солнднон структуры
Рис. 1. УЗИ-картина при МТС колоректального рака |
РИС. 4. Литографическая картина при МТС в печени |
|
595
!

Онкохирургия
Рис. 5. Цветное дуплексное картирование. МТС в печени
гипер- и гипоэхогенных метастазах, когда их прихо дится дифференцировать с гемангиомами, кистами и абсцессами печени. В данной ситуации целесообразно произвести пункционную биопсию печени, чувствитель ность последней при МТС составляет, по нашим данным, 94,2%, специфичность 100%, общая точность 94,4%.
Для исключения метастатического поражения кос тной системы выполняется сцинтиграфия скелета, детально обследуются легкие и желудочно-кишечный тракт. При перенесенных ранее вмешательствах на пря мой кишке показана компьютерная томография органов малого таза для исключения местного рецидива.
При массивном унилобарном метастатическом пора жении печени в предоперационном периоде возможно выполнение химиоэмболизации, а также портальной эмболизации пораженной доли с целью стимуляции регенерации непораженной части печени.
стазов. В то же время при вовлечении в процесс таких органов, как диафрагма, надпочечник и почка, возмож но выполнение сочетанных операций.
Другими необходимыми условиями резекции печени по поводу ее метастатического поражения являются радикальное удаление первичного очага, а также доста точные функциональные резервы остающейся печени.
Вариант резекции определяется размерами, располо жением и числом метастатическихузлов, их соотношени ем с трубчатыми структурами печени. Неанатомические резекции печени выполняют при поверхностно распо ложенных «легкодоступных» метастазах размерами не более 5 см. При глубоко расположенных метастазах
размерами более 5 см необходимо проведение стан дартных анатомических резекций печени (рис. 6).
Сегментэктомии в различных сочетаниях выполняются при циррозе печени, когда операции большего объема не переносимы или при изолированном поражении сегментов печени. Радикальными следует считать те операции, при которых резекция выполняется на рас стоянии не менее 1,0 см от видимых границ опухоли.
Принципы хирургического лечения
Резектабельность метастазов печени по данным различных авторов, составляет от 25% до 30% (Au gust D.A. et al., 1985). В большинстве случаев показани ем к выполнению резекции печени являются метастазы колоректального рака, реже злокачественных опухолей тонкой кишки, почек, надпочечников, желудка, молоч ных желез, матки, яичников, поджелудочной железы и меланомы (Iwatsuki S. et al, 1989).
Противопоказанием к оперативному вмешательству является наличие отдаленных внепеченочных мета
Рис. 6. Стандартная анатомическая резекция печени (момент операции)
Основные моменты хирургического вмешательства
Операция выполняется из стандартного J- или Т-образ ного доступа. При операциях по поводу метастатического поражения печени прежде всего необходима тщательная ревизия органов брюшной полости и забрюшинного про странства с целью исключения отдаленных метастазов и местного рецидива первичной опухоли. После визу-
596

Диагностика и хирургическое печение метастатических поражений печени
Рис. 7. ИОУЗП при МТС в печени
альной и пальпаторной оценки печени обязательным является проведение интраоперационного ультразву кового исследования (ИОУЗИ). ИОУЗИ позволяет выявить небольшие (менее 1,0 см) глубокие метастазы, не выявлен ные до операции, что в 10—15% случаев приводит к необ ходимости изменения предварительно намеченного плана операции {рис. 7). Важным этапом является лимфаденэктомия из гепатодуоденальной связки. Дальнейшие этапы операции зависят от варианта предпринимаемой резекции печени и мало отличаются от таковых при опера циях по поводу поражений печени другого генеза.
Использование атравматичной сосудистой хирурги ческой техники, предварительная сосудистая изоляция удаляемого участка печени, применение кавитационного ультразвукового хирургического аспиратора, аргон усиленной коагуляции, а также пленкообразующихся клеющихся композиций позволили значительно умень шить объем интраоперационной кровопотери и риск оперативного вмешательства. Операция завершается контрольным ИОУЗИ печени и дренированием брюшной полости. После получения данных гистологического исследования окончательно устанавливается стадия метастатического поражения печени, что определяет прогноз заболевания и необходимость проведения того или иного варианта комбинированного лечения.
Особенности послеоперационного ведения
В первые часы после операции проводится непре рывное мониторирование основных жизненно важных функций (давление, пульс, сатурация крови, ЦВД, КЩС, гемоглобин и гематокрит, почасовой диурез), контроль
отделяемого по дренажам. Особое значение придает ся ранней экстубации больных, сбалансированному парентеральному и энтеральному питанию. При резек циях печени большого объема отмечается значительное снижение синтетической функции печени, в связи с чем необходимо коррекция гипоальбуминемии, перелива ние коллоидных и кристаллоидных растворов, а также аминокислот и витаминов.
Крайне важным является регулярное ультра звуковое исследование брюшной и плевральных полостей с целью раннего выявления жидкостных скоплений в зоне операции. При значимых скоп лениях жидкости проводится пункция и эвакуация содержимого под УЗИ-контролем с последующим бак териологическим исследованием. Дренажи из брюшной полости, как правило, удаляются на 5—7-е сутки. При благоприятном течении больные на 2—3-е сутки после операции переводятся из палаты интенсивной терапии в обычную палату и выписываются из стационара на 14—17-е сутки.
Перед выпиской у больных после резекции печени по поводу метастатического поражения обязательно определяется уровень специфического для конкрет ной патологии онкомаркера, что важно для последу ющего динамического наблюдения. Регулярное обсле дование больных осуществляется 1 раз в 3 месяца на протяжении первых 2 лет после вмешательства. При метастатических поражениях печени III—IVA стадий в обязательном порядке проводится системная хими отерапия.
Ближайшие перспективы развития хирургии метастазов в печени
Частота послеоперационных осложнений составляет от 19 до 43%. Послеоперационная летальность колеб лется в пределах от 4 до 7%. При этом летальность у больных с сопутствующим циррозом печени состав ляет 37%, в то же время при отсутствии цирроза — 2% (Iwatsuki S. et al., 1989). Средняя продолжитель ность жизни при метастатическом поражении печени без лечения составляет б месяцев. Системная хими отерапия увеличивает продолжительность жизни до 9—12 месяцев.
Разительный контраст представляют результаты оперативного лечения. Продолжительность жизни от 1 до 5 лет после операций по поводу метастазов колоректального рака составляет 90%, 69%, 52%, 40% и 37%. Практически столько же живут больные, опери-
597
Онкохирургия
рованные по поводу метастазов из других первичных источников: 75%, 54%, 47%, 38% и 20%. Разница в продолжительности жизни при этом статистически не достоверна (Iwatsuki S. et al., 1989).
Продолжительность жизни после операций по поводу солитарных и множественных метастазов достоверно не отличаются, однако при количестве метастазов 4 и более она достоверно ниже. При анализе продолжительности жизни при колоректальных метастазах в зависимости от стадии первичной опухоли была выявлена достоверная разница между группами В и С по Дюку и отсутствие различий между С и D (синхронные с первичной опухолью метастазы в печени). При этом 5-летняя продолжительность жизни при стадии В составила 36%, при С — 25% (Iwatsuki S. et al., 1986). Статистически достоверные различия в длительности жизни после операции отмечены при различных стадиях метастатическо го поражения печени. При I стадии 3 года живут 73% больных, оперированных по поводу метастазов колоректального рака, при II стадии — 60%, при I I I стадии — 29%. При сравнении продолжительности жизни, в зависимости от объема операции, худшие результаты были отмечены при расширенных гемигепатэктомиях по сравнению с лобэктомиями и резек циями печени меньшего объема. Длительность жизни после лобэктомий, левосторонних латеральных сегментэктомий и краевых резекций печени была одина ковой. Это объясняется тем, что расширенные резек ции печени предпринимаются по поводу больших, центрально расположенных метастазов, тогда как краевые резекции — при небольших периферических поражениях. При проведении системной химиоте рапии после резекции печени до появления призна ков рецидива заболевания была отмечена большая продолжительность жизни, чем в группе больных, которые ее не получали. Продолжительность жизни после резекции печени по поводу ее метастатичес кого поражения не отличается в различных возрас тных группах, а также не зависит от половой прина длежности. Продолжительность жизни без рецидива метастазов составляет 9—10 месяцев, 2 года без рецидива живут 46% больных, перенесших резекцию печени по поводу ее метастатического поражения, 3 года — 28%. У всех больных с III стадией мета стазов печени отмечается рецидив в пределах 2 лет после резекции печени, в те же сроки при I стадии рецидив отмечается лишь в 28%. В среднем интерва лы времени от операции до возникновения рецидива при I, II и III стадиях составляют соответственно 15, 9 и 7 месяцев.
В39% случаев местом повторного метастазирования является печень, в 17% — легкие, в 21% — малый таз,
в13% — ретроперитонеальные лимфоузлы, в 3,5% — головной мозг. Наиболее часто рецидивы возникают при раке прямой кишки (75%).
Вряде случаев даже после обширных резек ций печени возможно выполнение резекций при повторном метастазировании. В последние годы оперативное лечение метастазов печени все шире комбинируется с региональной химиотерапией, внутрипортальной и внутричревной химиоэмболизацией, чрескожной алкоголизацией, криодеструкцией и СВЧ и лазер-деструкцией небольших метастатических узлов, а также иммуномодулирующей терапией. Несмотря на большое количество публикаций, свидетельствующих
обесспорной эффективности хирургического лечения метастазов печени, до сих пор в среде врачей быту ет мнение о фатальности поражения, в связи с чем значительное количество больных не направляются в специализированные гепатологические стационары и центры. Введение семинаров по хирургической гепатологии в программы высших медицинских заведений, а также факультетов усовершенствования врачей раз личных специальностей позволит значительно улучшить результаты лечения пациентов с онкологическими забо леваниями.
Перспективные направления исследований находят ся в области ранней диагностики метастазов печени, разработке мультимодальных методов терапии, в том числе и малоинвазивных методов лечения первичных и рецидивных метастазов в печени. Необходимо проведе ние мультицентровых исследований по согласованным протоколам, только такой подход позволит выработать оптимальный алгоритм терапии метастатического пора жения печени.
Литература
1. Adson M.A., van Heerden J.A. Major hepatic resection for metastatic colorectal cancer. Ann Surg., 1980, v. 191,
p. 576—583.
2.August D.A., Sugarbacer P.H., Schneider P.O. Lymphatic dissemination of hepatic metastases: Implications for the
follow-up and treatment of patients with colorectal cancer. Cancer, 1985, v. 55, p. 1490—1494.
3.Bozzetti F., Bignami P., Morabito A. et. al. Patterns of failure following surgical resection of colorectal cancer liver metastases Annals of Surgery, 1987, v. 205, № 3, p. 246— 269.
4.Foster G.H., Lundy J. Liver metastases. Current Problems in Surgery, 1981, v. 18, № 3, p. 160—195.
598
Диагностика и хирургическое лечение метастатических поражений печени
5.Gennari L. Doci R., Bozzetti F., Veronesi U. Proposal for a clinical classification of liver metastases. Tumori 1982, 1982, v. 68, p. 443— 449.
6.Gennari L, Doci R., Bozzetti F., Binami P. Proposal for staging liver metastases. In Hellman K., Eccles S.A., eds. Treatment of Metastases. Problems and Prospects. London: Taylor and Francis, 1985, 37—40.
7.Iwatsuki S., Sheahan D.G., Starzl Т.Е. The Changing Face of Hepatic Resection. Current problems in Surgery, 1989, v. 26, № 5, p. 281— 379.
8.Iwatsuki S., Esquivel C, Gordon R., Starzl Т.Е. Liver resection for metastatic colorectal cancer. Surgery, 1986, v. 100, W? 4, p. 804—810.
9.Pettavel J., Mogenthaler F. Protracted arterial chemo therapy of liver tumors: an experience of 107 cases over a 12year period. Prog. Klin. Cancer, 1978, N? 7, p. 217— 233.
10.Taylor I. Stadies on the treatment and prevention of colorectal liver metastases. Ann. R. Coll. Surg. Eng., 1981, v. 63, p. 270— 276.
599
ОБШИРНЫЕ РЕЗЕКЦИИ ПЕЧЕНИ
В.А. Вишневский, Н.А. Назаренко
К обширным резекциям печени (ОРП) относят резек ции, предусматривающие удаление трех и более сег ментов печени, а именно — гемигепатэктомии и расши ренные гемигепатэктомии. При этом выполнение лево сторонней гемигепатэктомии влечет за собой удаление 35%, правосторонней — 65%, а правоили левосто ронней расширенной гемигепатэктомии — до 70—80% объема органа.
История становления современной резекционной хирургии печени насчитывает, по меньшей мере, три столетия. В начальном ее периоде предпринимались лишь единичные попытки операций при ранениях пече ни, в целом же считалось, что вмешательства на печени невозможны ввиду массивности интраоперационной кровопотери и трудностей гемостаза.
В конце XIX столетия стали появляться эксперимен тальные работы, демонстрирующие наличие регенера ции печени после ее резекции. Так, Н. Tillman's (1879), Т. Gluck (1883), Е. Ponflick (1889) в эксперименте на животных показали, что печень после резекции до 4/5 ее объема способна активно регенерировать и восста навливать свою первоначальную массу. Важнейшим вкладом в развитие хирургии печени явились пред ложенные Ю.Р. Пенским и М.М. Кузнецовым в 1894 г. гемостатические швы.
Развитие в дальнейшем анестезии, принципов асеп тики, а также накопленный опыт операций на печени при травме, появление данных по регенерации печени дали возможность Langenbuch в 1888 г. выполнить первую успешную избирательную резекцию левой доли печени по поводу опухоли.
Прогрессу резекционной хирургии печени способс твовали в значительной степени анатомические исследо вания, результатом которых явилась концепция о долевом и сегментарном строении печени (Мельников А.В., 1956; Шапкин B.C., 1967; Couinaud С, 1957), а также предло женная в 1908 г. J. Pringle временная окклюзия сосудов гепатодуоденальной связки, позволившая поднять на новый уровень контроль за интраоперационным крово течением из паренхимы печени.
Современная эра резекционной хирургии печени начинается с сообщения Lortat-Jacob и Robert (1952), в котором была представлена принципиально новая техника выполнения обширной резекции правой доли печени, предусматривающая лигирование элементов
глиссоновой ножки, а также экстрапаренхиматозную перевязку правой печеночной вены до этапа рассече ния паренхимы печени.
В России первая резекция печени была выполнена Н.В. Склифосовским в 1889 г. С.С. Юдин в 1929 г. впер вые в России произвел резекцию левой кавальной доли, использовав элементы анатомической резекции. Первую успешную анатомическую правостороннюю гемигепатэктомию (ПГГЭ) выполнил в 1955 г. A.M. Дыхно.
Классификация резекций печени
Резекции печени принято подразделять на типич ные (анатомические) и атипичные. При анатомической резекции печени непременным моментом техники опе рации является перевязка магистральных сосудов и протоков в портальных и кавальных воротах печени, а само разделение паренхимы печени производится по малососудистым зонам — портальным фиссурам. Атипичные резекции выполняются без строгого учета внутриорганной архитектоники сосудов и протоков, без предварительной перевязки сосудисто-секреторной ножки и основным моментом является гемостатический шов или внутрипаренхиматозная перевязка сосудов и протоков (Шапкин B.C., 1967).
Анатомическая резекция печени считается в насто ящее время стандартом операций на печени, так как является единственно радикальной операцией при злокачественных опухолях, позволяет снизить риск массивной кровопотери, повреждения магистральных сосудистых структур противоположной доли печени, а также избежать секвестрации паренхимы печени (Журавлев В.А., 2003).
До последнего времени не существовало единой терминологии в классификации резекций печени. При анатомических резекциях в основном использовались 2 классификации (табл. 1) — Goldsmith и Woodburne (1957), а также Couinaud (1957).
Следует отметить, что по классификации Goldsmith и Woodburne понятие «сегмент» соответствует 2 сег ментам в классификации Couinaud. Так, «правосторон няя трисегментэктомия» по номенклатуре Goldsmith и Woodburne означает удаление правого заднего, правого
600 |
\ |
|
