- •1.1. Історія розвитку нанотехнологій.
- •1.2. Поняття про наноматеріали.
- •1.3. Адресна доставка ліків.
- •1.4. Магнітні наночастинки у виробництві лз.
- •1.5. Багатофункціональні наночастинки у виробництві лз.
- •2.1. Ліпосоми як нанокапсули. Загальні властивості . Поняття.
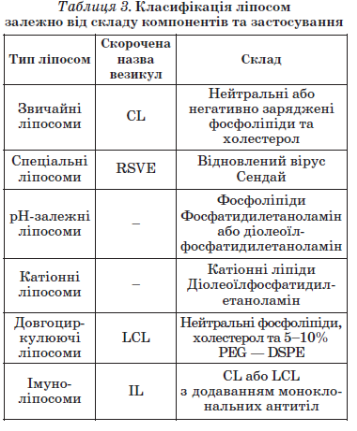
- •2.2 Сировина для одержання ліпосом.
- •2.3. Виробництво ліпосомальних систем.
- •2.4. Формування ліпосом за плівковими методами.
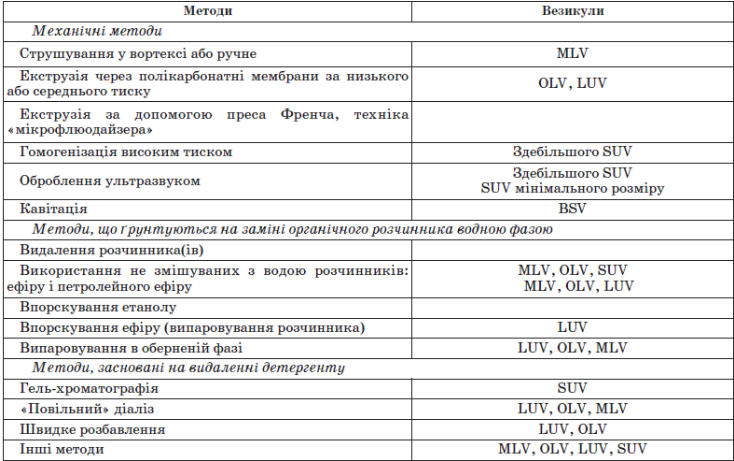
- •2.5. Методи гомогенізації у виробництві ліпосом.
- •2.6. Проліпосомний підхід у виробництві ліпосом.
2.6. Проліпосомний підхід у виробництві ліпосом.
Під проліпосомами розуміють речовини, які у процесі взаємодії з водою спонтанно утворюють ліпосоми. Цей метод дає змогу вирішити дві основні проблеми: одержання стерильних проліпосомальних форм та інкапсулювання активних компонентів безпосередньо перед уведенням в організм .
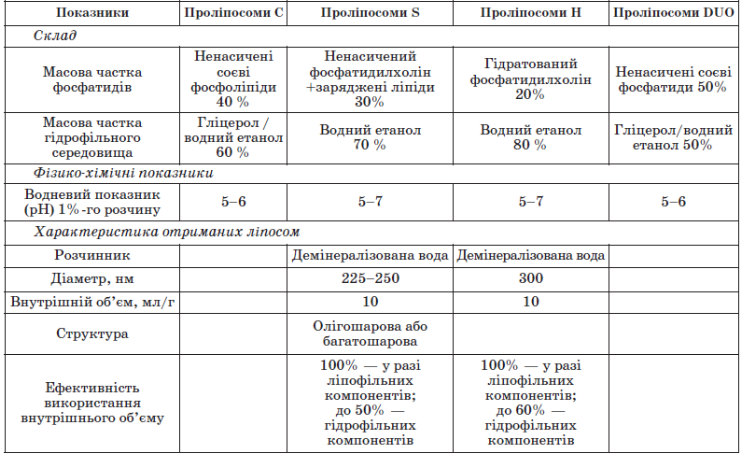
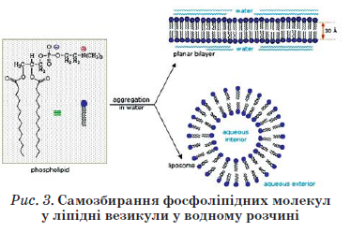
Проліпосоми самі по собі складаються з ретельно відібраної суміші фосфоліпідів у гідрофільному середовищі — суміші гідрофільних розчинників, зазвичай, але не обов'язково, водного етанолу та гліцеролу . У проліпосомах ліпіди структуровані у формі складених бішарів. Система не містить достатньої кількості води для формування ліпосом. Утворення ліпосом починається з простого додавання надлишку води. При цьому для клініки потрібен стабільний препарат, що зберігається тривалий час. Отже, ліпосоми потрібно висушити так, щоб перед уживанням залишалося тільки додати води, при цьому має утворитись така сама суспензія ліпосом, як і вихідна (до сушіння). Крім того, більша частина БАР має бути всередині ліпосом, інакше вся процедура втрачає сенс.
Можна використовувати два основних типи проліпосом. Один — із ненасиченими фосфоліпідами, які перебувають у рідкокристалічній фазі вже за кімнатної температури, інший -з гідрогенізованими фосфоліпідами у стані гелю.
Оскільки ліпосоми можуть бути утворені тільки в рідкокристалічній фазі, формування їх із використанням гідрогенізованих фосфоліпідів слід виконувати за підвищеної температури.
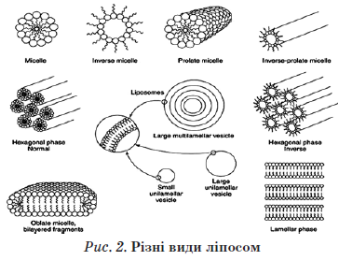
Існує кілька способів одержання проліпосом . Один із них — регідратація ліофільно висушених у вигляді тонкої плівки фосфоліпідів. Для цього вихідні ліпіди розчиняють в органічному розчинникові (хлороформ або етанол), потім розчин висушують до утворення тонкої плівки ліпідів. Після додавання до отриманої плівки води або водного буферного розчину утворюються багатошарові ліпосоми .
Запропоновано спосіб одержання проліпосом змішуванням фосфоліпідів, органічного розчинника і наповнювача. Активними компонентами у проліпосомах слугують протеїни або ензими. Характерною особливістю цього методу є те, що біологічно активний компонент вводять у проліпосоми шляхом змішування сухих проліпосом з розчином БАР у полярному розчинникові, а сушіння їх проводять у два етапи — до і після введення БАР. Концентрація БАР у водних розчинах становить від 0,01 до 5,0 мг/мл .
Відомий також спосіб одержання проліпосом на основі так званих речовинносіїв . Як носії використовують речовини, що мають розвинену зовнішню і внутрішню поверхню (високопористі), не розчинні в органічних розчинниках і добре розчинні у воді, наприклад цукри і полісахариди (глюкоза, фруктоза, декстрини тощо), поліоли (сорбіт, ксиліт та ін.), солі та порошкоподібні речовини. Запропоновано застосовувати не розчинні у воді й органічному розчинникові речовини (наприклад, оксид кремнію) або полімери, що набухають у воді, які потім видаляють із ліпосомальної дисперсії діалізом чи центрифугуванням.
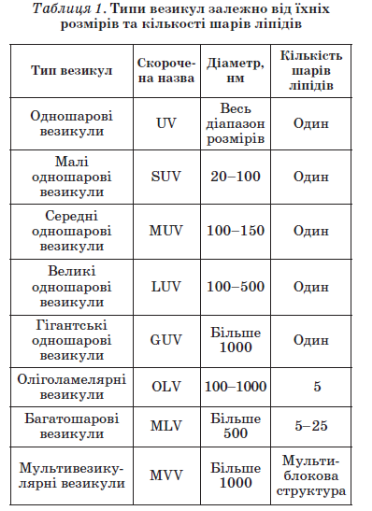
Існує ще один спосіб утворення ліпосом. Ліпосомальні дисперсії утворюються з негативно заряджених ліпідів, які набухають у воді (фосфатидилсерин, фосфатидна кислота, фосфатидилгліцерол). Ліпіди, які не несуть заряду або є в цілому електрично нейтральними (фосфатидилхолін), не набухають зовсім або набухають лише до граничної товщини водного прошарку між ламелами. Заряджені ліпіди схильні до необмеженого набухання і можуть включати воду між ламелами аж до порогової точки, коли утворюються фази повністю гідратованих моноламелярних везикул, що перебувають у стані рівноваги з водою. Ступінь набухання і відносна стабільність моно- і мультила-мелярних структур визначаються електростатичними взаємодіями. За низької іонної сили відбувається дестабілізація мультиламелярних структур. Необмежене набрякання може відбуватись і в тому разі, коли в суміші ліпідів міститься всього кілька відсотків заряджених ліпідів.
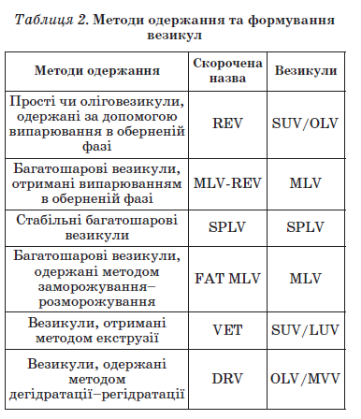
Основні типи проліпосом наведено в табл. 5(див.додаток).
Таким чином, сучасні проліпосомні технології дають змогу: уникнути енергоємних стадій, небажаних розчинників, застосовувати нескладне обладнання, зробити відносно нескладним інкапсулювання корисних речовин, проводити масштабування у промисловому виробництві.
Незалежно від того, який проліпосомний спосіб обрано, приготування ліпосом має відбуватися за вищої температури, ніж під час переходу ліпіду з гелю в рідкокристалічну фазу. Ця температура переходу, як правило, нижча 0 °С, але в разі повністю гідро-генізованих (насичених) ліпідів може бути значно вищою за кімнатну. Якщо використовують такі ліпіди, то процедура приготування проліпосом залишається такою самою, але всі операції слід виконувати за підвищених температур.
Показано, що захоплення водорозчинних компонентів є найефективнішим за двостадійного процесу розведення. Схему процесу подано в табл. 6(див.додаток).
У разі використання цих методів ефективність захоплення для більшості гідрофільних речовин зазвичай лежить у межах 40~60%, але може досягати 70-80°%. Для ліпофільних речовин ефективність захоплення змінюється залежно від їхніх індивідуальних властивостей і може наближатися до 100%. Однак кількість жиророзчинних компонентів загалом не перевищує 25% від вмісту фосфоліпіду.
Основна перевага системи проліпосом — можливість завантаження гідрофільних і ліпофільних активних компонентів.
ВИСНОВОКИ
Застосування нанотехнологій у виробництві ЛЗ дозволяє отримати препарат з принципово новими корисними властивостями.
Прикладом є адресна доставка ліків – коли препарат розподіляється не по всьому організму а лише у визначених структурах.
Звичайно це перевага що мінімізує побічні ефекти адже препарат діє на потрібний нам орган ,на потрібну структуру організму яку потрібно лікувати.
Під час агресивної терапії пухлин, аспект адресної доставки високотоксичних онкологічних препаратів набуває особливого значення. Додатково з'являється можливість управляти вивільненням ліків з контейнера.
Так, при використанні у якості контейнерів наночастинок з металевим ядром та полімерною оболонкою, у якій містяться лікарські речовини, можна викликати їх вивільнення при обмеженому нагріванні наночастинок. Це досягається накладенням змінного магнітного поля або опроміненням світлом лазера в ближньому інфрачервоному діапазоні, який слабо поглинається біологічними тканинами, але добре поглинається металевими наночастинками .
Також ліки виготовленні з наночастинок характеризуються більшою пролонгованістю що також має важливе значення.
Лікарські речовини у вигляді наночастинок мають не до кінця вивчені властивості, що впливають на їх фармакокінетику, тобто на всмоктування, розподіл у тканинах, біотрансформацію та виведення з організму. Систематичне вивчення закономірностей дії лікарських речовин у наноформі дозволить визначити як їх терапевтичний потенціал, так і можливі ризики для здоров'я людини . Адже за класичним визначенням ВООЗ, активний фармацевтичний інгредієнт - це стандартизована біологічно активна речовина (БАР) або їх суміш (з певною терапевтичною ефективністю), одержана шляхом синтезу, біотехнології або з об'єктів людського, тваринного, рослинного чи мінерального походження, яка дозволена до медичного застосування з метою виробництва (виготовлення) лікарських препаратів .
Активний фармацевтичний інгредієнт має відповідати вимогам Державної фармакопеї України (ДФУ) або аналітично-нормативної документації (АНД), затвердженої уповноваженим державним органом. Остаточний висновок про якість активного фармацевтичного інгредієнта будь-якого виробника складається з урахуванням відповідност його виробництва вимогам GМР за конкретною технологією та умовами реалізації (дистрибуції, транспортування, зберігання).
На даний час в Україні відсутня нормативно-правова база, яка регулює питання безпечного використання об'єктів, лінійні розміри яких знаходяться в на-нодіапазоні. Саме тому вкрай необхідною є організація системи сертифікації у галузі нанотехнологій, яка могла б забезпечити оцінку відповідност наноматеріалів заявленим характеристикам і параметрам безпечності, гарантій якості нанопродукціі на всіх стадіях виробництва та споживання, підтвердження відповідності підприємств та об'єктів наноіндустрії міжнародним вимогам безпеки виробництва.
Для вирішення поставлених питань потрібно сформувати сучасну технічну базу, освоїти адекватні методи ідентифікації наночастинок та методи визначення біологічної активності нанорозмірних речовин, а також створення чіткої системи реєстрації та обліку продуктів нанотехнологій.
СПИСОК ЛІТЕРАТУРИ
-
Арчаков А. И. Нанотехнологии в диагностике и терапии / Арчаков А. И., Иванов Ю. Д. // Медико-социальные аспекты отечественного здравоохра нения. Актуальные вопросы диагностики и лечения в клинике внутренних болезней. - М.: Общероссийский общественный фонд "Здоровье человека", 2007. - С. 10-18.
-
Ведерникова I. O. Одержання магнiтних рiдин для фармацевтичних цiлей / І. О. Ведерникова, Є. Я. Левтн, Т. О. Онопрієнко // Мат. XV Української конференцiї з неорганiчної хiмiї з мiжнародною участю 3-7 вересня 2001 р. -К.: "Науковий свiт", 2001. - С. 67.
-
Фiзико-хiмiчнi дослiдження часток магнетиту - компоненту магнiтних лiкарських форм / І. О. Ведерникова, Є. Я. Левітін, Т. О. Онопрієнко [та ін.] // Фармаком. - 2004. - № 4. - С. 64-68.
-
Ведерникова И. А. Реологические характеристики гидрофильного магнитного носителя / И. А. Ведерникова, Е. Я. Левитин, Т. А. Оноприенко // Труды X-й Международной Плесской конференции по магнитным жидкостям. -Иваново: ИГЭУ, 2002. - С. 121-124.
-
Взаимодействие лекарств и эффективность фармакотерапии / [Деримедведь Л.В., Перцев И.М., Шуванова Е.В. и др.]. - Х.: Изд-во "Мегаполис", 2002. - 784 с.
-
Головенко М. Адресна доставка наносистемами лікарських засобів до головного мозку / М. Головенко, В. Ларіонов // Вісник фармакології та фармації. -2008. - № 4. - С. 8-16.
-
Головин Ю. И. Введение в нанотехнику / Головин Ю. И. - М.: Машиностроение, 2007. - 496 с.
-
Гусев А. И. Наноматериалы, наноструктуры, нанотехнологии / Гусев А. И. -[2-е изд., испр.]. - М.: ФИЗМАТЛИТ, 2007. - 416 с.
-
Допоміжні речовини в технології ліків: вплив на технологічні, споживчі, еко-номічні характеристики і терапевтичну ефективність : навч. посіб. / [Перцев І. М. , Дмитрієвський Д. І., Рибачук В. Д. та ін.] ; за ред. І. М. Перцева. - Х: Золоті сторінки, 2010. - 600 с.
-
Жоаким К. Нанонауки. Невидимая революция / Жоаким К., Плевер Л. ; [пер. с фр. А. Кавтаскина]. - М.: КоЛибри, 2009. - 240 с.
-
Кобаяси Н. Введение в нанотехнологию / Кобаяси Н. ; [пер. с японск.]. - М.: БИНОМ, Лаборатория знаний, 2007. - 134 с.
-
Нанотехнологии и перспективы их использования в медицине и биотехнологии / В. М. Лахтин, С. С. Афанасьев, М. В. Лахтин [и др.] // Вестн. РАМН. -2008. - № 4. - С. 50-55.
-
Наукові основи наномедицини, нанофармакології та нанофармації / В.Ф. Москаленко, В. М. Лісовий, І. С. Чекман [та ін.] // Вісник Національного медич-ного університету. - 2009. - № 2. - С. 17-31.
-
Нанотехнології, наномедицина, нанофармакологія: стан, перспективи на-укових досліджень, впровадження в медичну практику / В. Ф. Москаленко, Л. Г. Розенфельд, Б. О. Мовчан [та ін.] // 1 національний конгрес "Человек и лекарство - Украина". Київ, 2008. - С. 167-168.
-
Нанотехнологии. Азбука для всех / Под ред. Ю. Д. Третьякова. — М.: Физ-матлит, 2008. - 368 с.
-
Настанова 42-02-2002. Належна виробнича практика активних фармацев-тичних інгредієнтів. - К.: МОЗ України, 2002. - 36 с.
-
Настанова 42-3.1:2004 Фармацевтична розробка. - К.: МОЗ України, 2004. - 30 с.
-
Промышленная технология лекарств : ученик в 2 т. / [Чуешов В. И., Чернов М.Ю., Хохлова Л. М. и др.]. ; под ред. В. И. Чуешова. - Харьков: Основа, Вид-цтво УкрФА, 2010. - Т. 2. - 704 с.
-
Пул Ч.-мл. Нанотехнологии / Пул Ч.-мл., Оуенс Ф. - [2-е, изд., доп.]. - М.: Техносфера. - 2006. - 336 с.
-
Нанотехнології в медицині, фармації та фармакології / Л. Г. Розенфельд, І. С. Чекман, А. І. Тертишна [та ін.] // Фармакологія та лікарська токсиколо-гія. - 2008. - № 1-3. - С. 3-7.
-
Тихоновский М. А. Наноматериалы: анализ тенденций развития на основе данных об информационных потоках / М. А. Тихоновский, А. Г. Шепе лев, Л. В. Пантеенко // Вопросы атомной науки и техники. - 2003. - № 13. -С. 103-110.
-
Фармацевтична енциклопедія ; голова ред. ради В. П. Черних. - [2-е вид.]. -К.: МОРІОН, 2010. - 1632 с.
-
Фармацевтичні та медико-біологічні аспекти ліків ; за ред. проф. І. М. Перцева. - Вінниця: Нова книга, 2007. - 728 с.
-
Фейнман Р. Ф. Внизу полным полно места: приглашение в новый мир физики / Р. Ф. Фейнман // Рос. хим. ж. - 2002. - Т. 46, № 5. - С. 406-409.
-
Фостер Л. Нанотехнологии. Наука, инновации и возможности / Фостер Л. -М.: Техносфера. - 2006. - 352 с.
-
Квантові мітки: клінічні та фармакологічні аспекти / І. С. Чекман, Я. М. Корнейкова, М. І. Загородний [та ін.] // Мистецтво лікування. - 2008. - Т. 50, № 4. - С. 72-74.
ДОДАТКИ





![]()
![]()