
- •Тесты к модулю №1 (для итогового рубежного контроля)
- •1) Термодинамика. Химическое равновесие.
- •4) Для нахождения реакции, следует воспользоваться формулой…
- •5) Для нахождения реакции, следует воспользоваться формулой …
- •6) Если энтальпия образования so2 равна -297 кДж/моль, то количество теплоты, выделяемое при сгорании 16г серы, равно . . . КДж
- •7) В реакции, протекающей в соответствии с термохимическим уравнением
- •12. В результате реакции, описываемой термохимическим уравнением
- •15. В результате реакции, термохимическое уравнение которой
- •23. В реакции, протекающей в соответствии с термохимическим уравнением
- •33) Будет ли влиять давление на смещение равновесия данной реакции
- •34) Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в обратном направлении
- •37) Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направления
- •40) Какие значения должна принимать энергия Гиббса, чтобы процесс шёл в прямом направлении
- •41) Как нужно изменить давление, чтобы сместить равновесие реакции
- •43) На состояние химического равновесия в системе
- •46) Равновесие в реакции, уравнение которой
- •48) В каком направлении идёт данная реакция
- •52) Повышение давления смещает равновесие в сторону продуктов для реакции…
- •56) Неверно, что согласно 2 началу термодинамики…
- •15) Сумма коэффициентов в уравнении реакции, соответствующая схеме , составляет …
- •25) Уравнение процесса, протекающего на инертном аноде при электролизе водного раствора хлорида натрия, имеет вид…
- •34) При электролизе водного раствора кСl на инертном аноде выделяется…
- •35) В реакции
- •36) При электролизе водного раствора СuCl2 с графитовым анодом на …
- •37) Oкислительно-восстановительная реакция в стандартных условиях возможна, если…
- •39) В системе, состоящей из луженого (покрытого оловом) железа при нарушении целостности покрытия в морской воде самопроизвольно протекает…
- •52) При нарушении оловянного покрытия на железном изделии, находящемся в кислоте, на аноде протекает реакция…
- •61) Гидроксид хрома (|||) Сr(oh)3 может проявлять в окислительно – восстановительных реакциях свойства:
- •1. Молярная масса неэлектролита, раствор 11,6 г которого в 200 г воды замерзает при -1,86°с (), равна _____ г/моль.
- •2.Массовая доля метанола в растворе, содержащем 60 г спирта и 40 г воды равна…
- •11.Молярная концентрация раствора, в 2 л которого содержится 4,25 г хлорида лития, равна______ моль/л.
11.Молярная концентрация раствора, в 2 л которого содержится 4,25 г хлорида лития, равна______ моль/л.
0,5 2) 0,1 3) 0,05 4) 1
12. Укажите верное определение понятия «раствор»
1) это система, состоящая из растворенного вещества и воды
2) это гомогенные системы, состоящие из двух и более компонентов и продуктов их взаимодействия
3) это гетерогенные системы, состоящие из двух и более компонентов и продуктов их взаимодействия
4) все предложенные утверждения верны
13. Формула для расчета молярной концентрации имеет вид:
1)
![]()
2)
![]()
3)
![]()
4)
![]()
14. В воде объемом 200 мл растворили соль массой 40 г. Определите массовую долю соли в полученном растворе, приняв плотность воды равной 1 г/мл.
1) 1,8% 2) 2 моль/л 3) 16,7% 4) 0,48
15. Укажите расчетную формулу и единицы измерения моляльной концентрации
1)
![]() ;[моль/кг]
;[моль/кг]
2) ![]() ;
[моль/г]
;
[моль/г]
3)
![]() ;[моль×г]
;[моль×г]
4)
![]() ;[моль/л]
;[моль/л]
16. Рассчитайте молярную концентрацию раствора, содержащего 117 г хлорида натрия
1) 2 моль/кг 2) 2,8 моль/л 3) 0,5 моль/кг 4) 2М
17. Эквивалент – это:
1) величина, соответствующая числу моль растворенного вещества
2) величина равная степени диссоциации
3) количество вещества, выпавшее в осадок
4) безразмерная величина равная основности кислоты; кислотности основания; для солей соответствует валентности металла, помноженное на количество его атомов; в окислительно-восстановительных реакций соответствует количеству электронов
18. Определите значение фактора эквивалентности для КMnO4 в кислой среде
1) 1/2 2) 3/4 3) 1/5 4) 1,5 моль
19. Рассчитать молярную массу эквивалента серной кислоты
1) 46 кг/моль 2) 98 г/моль 3) 49 г/моль 4) 98 %
20. Формула для расчета молярной доли компонента в растворе имеет вид:
1)
![]() 2)
2)![]()
3)
![]() 4)
4)![]()
21. К метиловому спирту массой 32 г плотностью 0,8 г/мл добавили воду до объема 80 мл. Определите объемную долю спирта в растворе
1) 2% 2) 50% 3) 64 моль/л 4) 46 г/моль
22. Рассчитать молярную концентрацию эквивалента хлороводородной кислоты массой 73 г в 10 л раствора
1) 8% 2) 0,2 моль/л 3) 24 г/л 4) 0,46
23. При смешивании воды объемом 50 мл (плотностью 1 г/мл) и метилового спирта объемом 70 мл (плотностью 0,8 г/мл) получили раствор с плотностью 0,9 г/мл. Определите объемную долю метилового спирта в растворе
1) 47 моль/л 2) 68 моль/л 3) 59,4 % 4) 5,94 %
24. Какую массу медного купороса CuSO4×5H2O и воды надо взять для приготовления раствора сульфата меди (II) массой 40 кг с массовой долей CuSO4 2%?
1) 1,25 кг CuSO4×5H2Oи 38,75 кгH2O2) 100 кгCuSO4×5H2Oи 56 кгH2O
3) 12 кг CuSO4×5H2Oи 800 гH2O4) 60 гCuSO4×5H2Oи 1 кгH2O
25. Определите молярную концентрацию раствора, полученного при растворении сульфата натрия массой 42,6 г в воде массой 300 г, если плотность полученного раствора равна 1,12 г/мл
1) 0,98 моль/л 2) 0,98% 3) 41М 4) 0,74
26. Фактор эквивалентности для Al2(SO4)3 равен
1) 0,6 2) 6 3) 1/6 4) 6%
27. Вычислите, какая масса щавелевой кислоты содержится в 200 мл раствора, если титр его равен 0,0012607 г/мл
1) 0,25214 г 2) 0,4 мг 3) 0,25214 г 4) 4,8 г
28. Определите молярную концентрацию раствора с массовой долей гидроксида натрия 0,2 и плотностью 1,22 г/мл
1) 0,164 моль/л 2) 3М 3) 8% 4) 6,1 моль/л
29. Метод определения молярной массы растворенного вещества по повышению температуры кипения его раствора называется…
эбуллиоскопией 2) экстракцией 3) криоскопией 4) перегонкой
31. Масса серной кислоты, содержащаяся в 2 л раствора с молярной концентрацией эквивалентов 0,5 моль/л, равна _______ грамма(–ам).
98 2) 24,5 3) 49 4) 196
30. В 250 граммах воды растворен неэлектролит с молярной массой 340 г/моль. Раствор замерзает при – 0,28°С. Масса вещества в растворе составляет _____ грамма(–ов).
1) 45,8 2) 12,8 3) 12800 4) 163,2
31. Односторонняя диффузия молекул растворителя через полупроницаемую мембрану в коллоидный раствор называется …
1) растворением 2) осмотическим давлением 3) осмосом 4) диализом
32. После растворения вещества в растворителе при температуре 20°С давление насыщенного пара растворителя…
1) Повышается
2) повышается до критического значения, затем понижается
3) понижается
4) не изменяется
33. Смешали 1,6 г метанола (СН3ОН) и 2,7 г дистиллированной воды мольная доля метанола в растворе составляет _____ %.
1) 0,25 2) 3 3) 0,75 4) 1
34. Смешали 200 г раствора глюкозы с массовой долей растворенного вещества 20% и 300 г раствора с массовой долей10 %. Массовая доля в полученном растворе равна___%.
18 2) 14 3) 16 4) 15
35. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25°С равно___кПа.
247,6 2) 51,6 3) 123,8 4) 61,9
36. Гипотоническим раствором по отношению к 0,1% раствору глюкозы является 0,1% раствор …
Сахарозы 2) глицерина 3) этанола 4) этиленгликоля
37. Масса воды, необходимая для приготовления 400 г раствора с массовой долей нитрата калия 20% _____ гр.
360 2) 320 3) 80 4) 160
38. Раствор, содержащий 5г вещества (не электролита) в 100 г воды, кипит при 100,43° (Кэ=0,52 град кг/моль). Молярная масса вещества равна ____ г/моль.
11 2) 60 3) 0,6 4) 216
39. В 400 г раствора гидроксида натрия с массовой долей растворенного вещества 10% содержится___моль NaOH
1 2) 0,5 3) 0,1 4) 2
40. Молярная концентрация раствора в 500 мл которого содержится 16 г сульфата меди, равна___моль/л
0,2 2) 0,1 3) 1 4)2
41. Для приготовления 0,5 л раствора глюкозы с молярной концентрацией 0,2 моль/л, необходимо растворить____гр. вещества
90 2) 9 3) 45 4) 18
42. Растворы, обладающие одинаковым осмотическим давлением, называются…
гипотоническими 2) изотермическими
3) гипертоническими 4) изотоническими
43. Под концентрацией раствора понимают...
1) содержание растворенного вещества (в определенных единицах) в единице массы или объема раствора
2) давление насыщенных паров растворителя в зависимости от количества растворенного вещества
3) сумму количеств растворенного вещества и растворителя
4) плотность раствора
44. Раствор, содержащий 4,6г глицерина
(Мr=92) в 100 г воды (K![]() =
1.86
=
1.86![]() )замерзает
при температуре ____ °С.
)замерзает
при температуре ____ °С.
1) -0,465 2) -0,372 3) -0,186 4) -0,93
45. Величиной, выражающей количественный состав раствора, является ...
1) концентрация 2) эквивалентность
3) парциальное давление 4) плотность
46. Для нахождения моляльной концентрации раствора, нужно воспользоваться формулой...
1)
![]() =
=![]() 2)
2)![]() =
=![]() 3)
3)
![]() =
=![]() 4)
4)
![]() =
=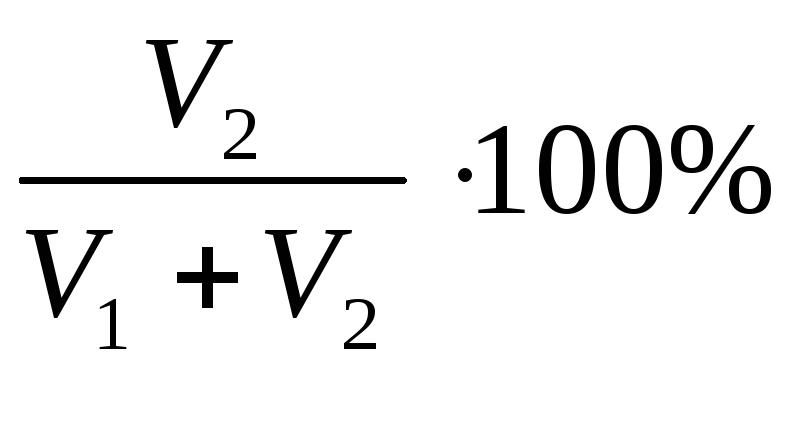
47. Для приготовления 520г с моляльной концентрацией 1моль/кг раствора NaOH требуется _____г растворённого вещества
1) 40 2) 80 3) 20 4) 60
48. Молярная концентрация HNO3 в 250 мл раствора, содержащего 12,6 грамма кислоты, равна____моль/л.
1) 0,2 2) 0,8 3) 8,0 4) 2,0
49. Молярная концентрация раствора, в 5 л которого содержится 63 г азотной кислоты, равна ___ моль/л.
1) 0,2 2) 0,5 3) 1 4) 2
50. Растворение твердых веществ в воде характеризуется:
1) DH<0,DS<0 3)DH<0,DS=0
2) DH<0,DS>0 4)DH=0,DS<0
51. Сольватирование частиц растворенного вещества является процессом ______
1) Эндотермическим 2) Экзотермическим
3) Физическим 4) Необратимым
52. Растворимость газов в жидкости повышается при___
1) понижении температуры 2) повышении температуры
3) понижении давления газа 4) введении в жидкость электролитов
53. Зависимость растворимости газа от концентрации электролита в растворе описывается законом____
1) Генри 2) Вант-Гоффа
3) Рауля 4) Сеченова
54. Осмотическое давление раствора хлорида натрия с молярной концентрацией 0,1 моль/л (изотонический коэффициент 1,95) при 25 °С равно _____ кПа.
1) 247,6 2) 482,9 3) 20,8 4) 40,5
55.Уравнение π=СRT является математическим выражением закона ___
1) Вант-Гоффа 2) Дальтона
3) Рауля 4) Сеченова
56. Осмолярная концентрация раствора глюкозы, если при температуре 25°С его осмотическое давление равно 247,6 кПа, составляет _____ моль/л.
1) 1,2 2) 0,12 3) 0,1 4) 12
57. Процесс перехода молекул растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией называется___
1) электролитическая диссоциация 2) осмос
3) гидролиз 4) диффузия
58. Растворы хлорида натрия и глюкозы с одинаковой концентрацией имеют:
1) Одинаковое осмотической давление
2) Одинаковое давление пара над раствором
3) Разное осмотическое давление
4) Разный цвет
59. Водный раствор глюкозы с моляльной концентрацией 0,5 моль/кг замерзнет при температуре___°С. Криоскопическая постоянная воды равна 1,86.
1) – 0,93 2) 0,93 3) 0 4) – 3,72
60. Водный раствор глюкозы с моляльной концентрацией 1 моль/кг закипит при температуре ___°С. Эбулиоскопическая постоянная воды 0,516.
1) 0,516 2) 100,516 3) 273,516 4) 298,516
61. Растворы глицерина и глюкозы будут иметь одинаковое осмотическое давление при 25°С если у них ____.
1) Одинаковый объем 2) Разная концентрация
3) Одинаковая концентрация 4) Разный объем
62. В случае равных моляльных концентраций наибольшее понижение температуры будет в растворе
1) С6Н12О62)NaCl3)KCl4)CaCl2
63. Повышение температуры кипения раствора по сравнению с чистым растворителем является следствием
1) Понижения давления пара над раствором
2) Повышения давления пара над раствором
3) Повышения плотности раствора
4) Изменения поверхностного натяжения раствора
64. Суть сольватной теории растворов состоит в том, что…
1) растворитель рассматривается, как химически индифферентная среда
предполагается отсутствие межмолекулярного взаимодействия, как между частицами растворенного вещества, так и между частицами растворенного
2) вещества и растворителя
3) между частицами растворенного вещества и молекулами растворителя происходит взаимодействие с образованием сольватов
4) при растворении веществ понижается энергия активации
65. Изменение энергии Гиббса (DG) равно нулю при образовании ___
1) Разбавленных растворов
2) Насыщенных растворов
3) Растворов неэлектролитов
4) Растворов электролитов
66. Согласно современным представлениям образование растворов является процессом
1) Физическим
2) Химическим
3) Физико-химическим
67. Раствор этилового спирта в воде не подчиняется закону Рауля, потому что спирт ___
1) электролит 2) летучая жидкость
3) неэлектролит 4) органическое вещество
68. Осмотическое давление раствора глюкозы с молярной концентрацией 0,1 моль/л при 25С равно _____ кПа.
1) 61,9 2) 51,6 3) 123,8 4) 247,6
69. Молярная масса
неэлектролита, раствор 9,2 г которого в
400 г воды замерзает при –0,93 °С
![]() , равна _____ г/моль.
, равна _____ г/моль.
60
120
46
23
70. Мольная доля растворенного вещества может быть выражена в …
моль/л
процентах
г/моль
моль/кг
71. Молярная масса вещества, при растворении 2,3 г которого в 100г воды, температура кипения раствора относительно температуры кипения воды повышается на 0,26 градуса(k=0,52 град×кг/моль), составляет
1) 60 2) 180 3) 464)98
72. 500 см3 водного раствора, содержащего 106 г Na2CO3, разбавили дистилированной водой в 2 раза. Молярная концентрация карбоната натрия в полученном растворе составляет____ моль/л
1) 10 2) 2 3) 14) 2,5
73. Водный раствор неэлектролита замерзает при -1,860С. Концентрация вещества в растворе составляет _____ моль/кг. (КН2О=1,86 град×кг/моль)
1) 10 2) 20 3) 14) 2
74. В 500 см3 растворили 105 г фторида натрия. Моляльность раствора составляет_____ моль/кг
1) 50 2) 53) 10 4) 15
75. После растворения нелетучего вещества в растворителе при температуре 200С давление насыщенного пара растворителя над раствором…
1) повышается
2) повышается до критического значения, затем понижается
3) понижается
4) не изменяется
76. К 250 г раствора, содержащего 25 г сульфата калия, добавили 250 см3 дистиллированной воды. Массовая доля растворённого вещества в растворе…
1) увеличилась в 2 раза
2) уменьшилась в 2 раза
3) уменьшилась в 2,1 раза
4) осталась неизменной
77. Что произойдёт с эритроцитами крови при помещении их в гипертонический раствор NaCl?
1) плазмолиз2) гемолиз
3) ничего не произойдёт 4) набухание
78. Каким является по отношению к физиологическому раствору, раствор глюкозы с массовой долей 10%.
1) изотоническим 2) гипертоническим
3) гипотоническим 4) эндотермическим
79. При какой температуре замерзает раствор глюкозы по сравнению с водой?
1) выше 00С 2) выше 100С 3) при 00С 4)ниже 00С
80. В основе, какой болезни лежит закон Генри?
1) почечная недостаточность 2) кессонная болезнь
3) аллергия 4) гипертоническая
81) Растворимость газа в растворе с увеличением концентрации электролитов:
1) увеличивается 2) понижается
3) не изменяется 4) увеличивается частично
4) ПРОТОЛИТИЧЕСКИЕ ПРОЦЕССЫ. БУФЕРНЫЕ РАСТВОРЫ. ГИДРОЛИЗ.
1. Сокращенное молекулярно-ионное уравнение Ва+2+SO42-=BaSO4 соответствует реакции…
1) Ba(NO3)2+SO2® 2) BaCO3+H2SO4®
3) BaCl2+Na2SO4® 4) Ba3(PO4)2+H2SO4®
2. Полному гидролизу подвергаются соли…
1) CrCl32)Al2(SO4)33)Cr2S3 4)Cs2CO3
3. Нейтральную среду имеют растворы солей …
1) RbNO32)HCOOK3)BaCl24)CsF
4. Кислую среду имеют растворы солей…
1) K2SiO32)AlCl33) (NH4)2SO44)CaCl2
5. При разбавлении раствора степень диссоциации слабого электролита…
1) увеличивается 2) уменьшается 3) не меняется 4) меняется неоднозначно
6. Сильными электролитами являются …
1) HI 2) СН3СООН 3) NH4OH 4) Ca3(PO4)2
7. Отношение числа молекул, диссоциирующих на ионы, к общему числу молекул растворенного вещества, называется _____ диссоциации.
1) коэффициентом 2) степенью 3) показателем 4) константой
8. В водном растворе гидролизу не подвергаются соли…
1) K2SiO32) K2SO43) AlCl34) NaNO3
9. Среда водного раствора хлорида аммония
1) слабощелочная 2) кислая 3) нейтральная 4) сильнощелочная
10. Диссоциация по трем ступеням возможна в растворе
1) хлорида алюминия 2) нитрата алюминия
3) фосфата калия 4) ортофосфорной кислоты
11. Ионы I-образуются при диссоциации
1) KIO32)KI3)C2H5I4)NaIO4
12. Лакмус краснеет в растворе соли
1) FeSO42)KNO33)NaCI4)Na2CO3
13. Вещество, при диссоциации которого образуются ионы Na+, H+, а также анионы SO42- является
1) кислотой 2) щелочью 3) средней солью 4) кислой солью
14. Кислую среду имеет водный раствор
1) карбоната натрия 2) нитрата калия
3) иодида калия 4) хлорида алюминия
15. Сокращенное ионное уравнение Fe2+ + 2OH- = Fe(OH)2 соответствует взаимодействию веществ:
1) Fe(NO)3иKOH2)FeSO4иLiOH
3) Na2S и Fe(NO3)2 4) Ba(OH)2 и FeCI3
16. Сокращенное ионное уравнение Ba2+ + SO42-- = BaSO4 соответствует взаимодействию веществ:
1) BaCI2 и K2SO4 2) BaO и H2SO4
3) Ba(OH)2 и H2SO4 4) BaSO4 и FeCI3
17.Среда водного раствора сульфата алюминия
1) щелочная 2) кислая 3) нейтральная 4) слабощелочная
18. Наиболее слабым электролитом является
1) HF 2) HCI 3) HBr 4) HI
19. В качестве анионов только ионы ОН- образуются при диссоциации
1) CH3OH 2) Zn(OH)Br 3) NaOH 4) CH3COOH
20. Щелочную среду имеет водный раствор
1) хлорида меди 2) сульфата натрия
3) хлорида кальция 4) сульфита натрия
21. Одновременно не могут находится в растворе все ионы ряда
1) Fe+3, K+, CI-, SO42- 2) Fe3+, Na+, NO3-, CI-
3) Ca2+, Li+, NO3-, CI- 4) Ba2+, Cu2+, OH-, F-
22. Какие из утверждений о диссоциации оснований в водных растворах верны?
А. Основания в воде диссоциируют на катионы металла (или NH4+) и гидроксид анионы
В. Никаких других анионов кроме ОН-, основания не образуют.
1) верно только А 2) верно только В
3) верны оба утверждения 4) оба утверждения неверны
23. Щелочную и кислую реакцию среды соответственно имеют растворы солей
1) Na2CO3 и Ba(NO3)2 2) Na2SiO3 и CuCI2
3) FeCI3 и ZnSO4 4) BaCI2 и Ca(NO3)2
24. Реакции ионного обмена в водных растворах протекают до конца
1) если один или несколько продуктов выводятся из сферы реакции
2) при растворимости всех исходных веществ
3) при образовании растворимых солей
4) если одно из исходных веществ не растворяется в воде
25. Не будет происходить видимых изменений, если в растворе одновременно окажутся ионы
1) Na+, SO42-, OH-, Ba2+ 2) Na+, SO42-, OH-, K+
3) Mg2+, SO42-, OH-, K- 4) H+, SO42-, HCO3-, K+
26. Наименьшее число ионов в растворе при диссоциации образует
1) Fe2(SO4)32)KNO33)AICI34)ZnCI2
27. Наименьшее число ионов в растворе при диссоциации образует
1) Fe2(SO4)32)KNO33)AICI34)ZnCI2
28. Наибольшее число ионов в растворе при диссоциации образует
1) Na2S2)KCI3)AICI34)CH3COOH
29.Концентрация ионов Н + в чистой дистиллированной воде при 20˚С равно___ моль/л.
7 2) 14 3) 10-7 4) 10-14
30. Взаимодействие ионов соли с водой, в результате, которого образуется слабый электролит, называется …
гидролизом 2) нейтрализацией
3) гидратацией 4) сольватацией
31. Число катионов, образующихся при полной диссоциации одной молекулы сульфата хрома, равно …
4 2) 2 3) 5 4) 3
32. Сильным электролитом является водный раствор…
оксида углерода (IV) 2) хлорида меди (II)
3) оксида углерода (II) 4) этанол
33. Одним из продуктов гидролиза нитрата железа (III) по второй ступени является …
Fe(OH)32)FeOH(NO3)
3) FeOH(NO3)24)Fe(OH)2NO3
34. Уравнение реакции практически осуществимой в водном растворе, имеет вид…
1) Ba(NO3)2 + 2 NaOH = 2NaNO3 + Ba(OH)2
2) NaNO3 + HCl = NaCl + HNO3
3) CuSO4+ 2KOH=K2SO4+Cu(OH)2
4) Fe2(SO4)3 + 6 HNO3 = 2 Fe(NO3)2 + 3 H2SO4
35. Ионное произведение воды при повышении температуры…
Проходит через максимум 2) Уменьшается
3) Проходит через минимум 4) Увеличивается
36. Неверно, что в водных растворах слабых электролитов…
степень диссоциации увеличивается при постоянной температуре
константа диссоциации не зависит от температуры
константа диссоциации зависит от температуры
степень диссоциации уменьшается при разбавлении
37. Гидролизу по катиону подвергается соль, формула которой ...
1) K2SO42) Na2S043) К2СО34) FeCl3
38. Концентрация гидроксид-ионов в растворе с рН=4 составляет ____ моль/л.
1) 10-72) 10-123) 10-44) 10-10
39. В две стадии в водном растворе диссоциирует соединение
1) НNO32)NH4OH3)H3PO44)H2S
40. Для ослабления процесса гидролиза хлорида железа (III) к раствору добавляют
1) HCl3)KOH3)Cl24)H2O
41. Формула соли, водный раствор которой имеет рН>7…
1) KCl2)K2CO33)Fe(NO3)24)CuSO4
42. Гидролиз карбоната натрия можно уменьшить, добавив в водный раствор этой соли…
1) H2O 2) NaCl 3) HCl 4) NaOH
43. Краткому молекулярно-ионному уравнению CO32- + 2H+ = CO2 +H2O соответствует полное уравнение…
Cu(OH)2+ 2H2SO4= 2CuSO4+CO2+ 3H2O
KHCO3+ HNO3= KNO3+ CO2+ H2O
BaCO3+2HNO3=Ba(NO3)2+CO2+H2O
K2CO3 + 2 HNO3 = 2 KNO3 + CO2 + H2O
44. Значение рН сыворотки крови в норме:
1) 7,11 2) 6,86 3) 7,36 4) 4,7
45. В состав буферных растворов крови не входит буфер:
1) гемоглобиновый 2) аммиачный3) гидрокарбонатный 4) белковый
46. Указать роль буферных систем в организме?
1) для повышения рН среды 2) для понижения рН среды
3) для поддержания рН среды4) для ускорения биохимических реакций
47. У какой буферной системы организма самая большая буферная ёмкость?
1) фосфатной 2) белковой
3) гемоглобиновой4) бикарбонатной
48. Алкалоз - это
1) смещение рН крови в кислую область
2) смещение рН желудочного сока в щелочную область
3) смещение рН крови в щелочную область
4) смещение рН желчи в кислую область
49. Ацидоз - это
1)
![]() смещение
рН крови в кислую область
смещение
рН крови в кислую область
2) смещение рН желудочного сока в кислую область
3) смещение рН крови в щелочную область
4) смещение рН желчи в кислую область
50. Укажите формулу бикарбонатного буфера
1) CH3COONa/CH3COOH
2) Na2HPO/NaH2PO4
3) NaHCO3/H2CO3
4) NH4OH/NH4Cl
51. Какая буферная система входит в состав организма:
1) CH3COONa/CH3COOH
2) Na2HPO / NaH2PO4
3) NH4OH/NH4Cl
4) HCOOK / HCOOH
5) ХИМИЧЕСКАЯ КИНЕТИКА
1. При 0С гранула железа растворяется в соляной кислоте за 20 мин. Если температурный коэффициент реакции равным 2, то такой же по массе кусочек железа растворится при 20С за _____ минут.
1) 5 2) 12 3) 60 4) 10
2. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции …
увеличивается в 8 раз 2) уменьшается в 2 раза
3) увеличивается в 6раз 4) уменьшается в 4 раза
3. Температурный коэффициент реакции равен 3. Во сколько раз увеличивается скорость реакции при повышении температуры на 200С
в 1,5 раза 2) в 3 раза
3) в 6 раз 4) в 9 раз
4. Кинетическое уравнение для реакций I-го порядка имеет вид:
1)
![]()
2)
![]()
3)
![]()
4)
![]()
5. Кинетическое уравнение для реакций II-го порядка имеет вид:
1)
![]()
2)
![]()
3)
![]()
4) ![]()
6. Согласно закону Вант-Гоффа при повышении температуры на 10ºС скорость химической реакции возрастет в:
1) 5-6 раз 2) 2-4 раза 3) 10 раз 4) 1,75 раза
7. Энергия активации – это …
1) кинетическая энергия
2) потенциальная энергия
3) энергия, образующаяся при столкновении молекул
4) избыточная энергия, которую необходимо передать 1 моль вещества, чтобы перевести все молекулы в активное состояние
8. Как изменится скорость химической реакции при увеличении температуры на 20ºС, при температурном коэффициенте равном 4
1) возрастет в 16 раз
2) уменьшится в 2 раза
3) сначала увеличится в 3 раза затем уменьшится в 1,5 раза
4) не изменится
9. Катализаторы, ускоряющие скорость химической реакции называются …
1) ингибиторы 2) инициаторы
3) антиоксиданты 4) окислители
10. Принято выделять следующие виды катализа:
1) гомогенный 2) гетерогенный
3) мономолекулярный 4) нулевой
11. В организме роль катализаторов выполняют:
1) жирные кислоты 2) витамины
3) ферменты 4) ДНК и РНК
12. При увеличении температуры на 50ºС скорость химической реакции возрастет в 32 раза. Чему равен температурный коэффициент реакции?
1) ¾ 2) 8×10-23) 2 4) 5,08
13. Реакция разложения Н2О2 в водном растворе протекает как реакция I-го порядка. Период полураспада составляет 15,86 мин. Какое время потребуется для разложения 99% взятого количества Н2О2 – ?
1) 11 часов 2) 1 сутки
3) 50 мин 34 сек 4) 106,96 мин
14. При 60ºС вещество «Х» подвергается термическому разложению по уравнению I-го порядка с константой скорости 0,05 мин-1. Сколько времени нужно нагревать раствор при 60ºС, чтобы исходная концентрация вещества равная 0,1 моль/л уменьшилась до 0,01 моль/л – ?
1) 34 сек 2) 1 час 58 мин 3) 46 мин 4) 2 сут
15. Порядок и молекулярность для простых реакций:
1) совпадают
2) молекулярность в 2 раза больше порядка реакции
3) порядок реакции в 1,5 раза больше молекулярности
4) это зависит от условий процесса
16. Вещество, изменяющее скорость химической реакции и остающееся после этого в неизменном состоянии и количестве называется …
1) промежуточным продуктом реакции 2) восстановителем
3) катализатором 4) продуктом реакции
17. К особенностям ферментативного катализа относят:
1) высокую избирательность
2) высокую каталитическую активность
3) оптимальные значения рН и температуры
4) все предложенные варианты верны
18. Уравнение Михаэлиса-Ментена имеет
вид
![]() и
характеризует:
и
характеризует:
1) зависимость стационарной скорости ферментативной реакции от концентрации субстрата
2) соотношение между величиной константы Михаэлиса и концентрацией субстрата
3) оба утверждения верны
4) ни один из предложенных вариантов
19. Если температурный коэффициент скорости химической реакции равен 2, то при повышении температуры от 200С до 500С скорость реакции …
1) увеличивается в 8 раз 2) уменьшается в 2 раза
3) увеличивается в 6раз 4) уменьшается в 4 раза
20. Температурный коэффициент скорости химической реакции равен 2. При охлаждении системы от 100С до 80С скорость реакции…
не изменяется
увеличивается в 2 раза
уменьшается в 4 раза
увеличивается в 4 раза
21. В состоянии химического равновесия скорость прямой реакции ________ скорости обратной реакции.
1) равна
2) меньше
3) не зависит от
4) больше
22. Для увеличения скорости прямой реакции 2NO(г) + О2(г)↔2NO2(г) в 1000 раз, необходимо увеличить давление в ____раз
500
50
330
10
23. Правило Вант-Гоффа выражает зависимость скорости химической реакции от…
температуры
времени
концентрации
природы реагентов
24. Введение катализатора в систему приводит к ______ реакции.
изменению энтальпии
изменению энтропии
уменьшению энергии активации
увеличению энергии активации
25. Скорость элементарной реакции
![]() при увеличении концентрации Сl2
в 3 раза увеличится в ____раз(а).
при увеличении концентрации Сl2
в 3 раза увеличится в ____раз(а).
3
6
9
2
26. Если скорость реакции увеличилась в 27 раз при повышении температуры на 300С, то температурный коэффициент скорости равен…
1) 32) 9 3) 2,7 4) 2
27. Температурный коэффициент скорости реакции равен 3. Скорость реакции, при повышении t от 3000С до 3400С увеличивается в _____ раз
1) 9 2) 27 3)12 4) 81
28. Скорость реакции между растворами хлорида калия и нитрата серебра, концентрации которых составляют 0,2 и 0,3 моль/л соответственно, а k=1,5×10-3л/моль×с равна ____ моль×л-1×с-1:
1) 9×10-52) ) 6×10-23) 9×10-14) 9×10-3
29. Увеличение скорости реакции под действием катализатора происходит в результате…
1) увеличения концентрации реагентов
2) уменьшения концентрации продуктов
3) увеличения температуры
4) уменьшения энергии активации
30. При увеличении давления в системе в 2 раза скорость элементарной реакции 2SO2+O2↔2SO3 увеличивается в _____раз
1) 82) 6 3) 4 4) 2
31. При повышении давления в 2 раза скорость гомогенной элементарной химической реакции 2NO+Cl2=2NOCl увеличивается в ______ раз
1) 2 2) 4 3) 84) 6
13) В состоянии химического равновесия скорость прямой реакции______ скорости обратной реакции:
1) больше 2) не зависит 3) меньше 4) равна
32. Система, для которой математическое выражение закона действующих масс имеет вид k=[CO], является…
CaO(т) +3 C(т) CaC2(т) + CO(г)
Fe3O4(т) + 4 C(т) 3 Fe(т) + 4 CO(г)
Fe3O4(т) + C(т) 3 FeO(Т) + CO(г)
CaCO3(т) + 4 C(т) CaC(т) + 3 CO(г)
33. При повышении давления в 2 раза
скорость гомогенной элементарной
химической реакции
![]() увеличивается
в ___ раз(–а).
увеличивается
в ___ раз(–а).
8 2) 6 3) 4 4) 2
