
ХИМИЯ 1 Лечебный факультет / Методические указания для студентов / занятие 14
.docЗанятие №14
Методические указания для студентов
ТЕМА: α-Аминокислоты, пептиды
ЦЕЛЬ: Сформировать знания о строении и свойствах важнейших -аминокислот как химических основ структурной организации белковых молекул для дальнейшего изучения биологических функций белков на молекулярном уровне.
Теоретические вопросы
1. Строение аминокислот. Классификация. Основы стереоизомерии.
2. Кислотно-основные свойства аминокислот. Биполярный ион, катионная, анионная формы. Изоэлектрическая точка. рК аминокислот.
3. Химические свойства аминокислот:
а) реакции по аминогруппе;
б) реакции по карбоксильной группе;
в) специфические и биологически важные реакции аминокислот;
г) реакции в радикалах, в других характеристических группах.
4. Образование, строение и свойства пептидной связи. Дипептиды, трипептиды, первичная структура белка.
5. Важнейшие пептиды: глутатион, карнозин, 6-аминопенициллонвая кислота, инсулин, окситоцин, вазопрессин, метионин - энкефалин, лейцин - энкефалин.
6. Первичная, вторичная, третичная, четвертичная структура белков. Функции белков в организме. Денатурация белков. Протеиды и протеины.
7. Свойства растворов высокомолекулярных соединений (ВМС).
Обучающие упражнения
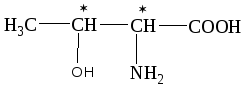
Задание 1. Один из стереоизомеров 2-амино-3-гидроксибутановой кислоты (треонин) входит в состав белков. Какие стереоизомеры возможны для треонина?
Ответ: в молекуле треонина два центра хиральности
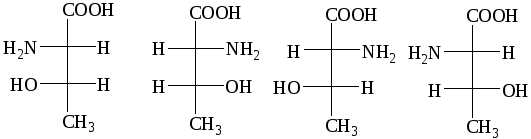
Изобразим возможные стереоизомеры в виде проекционной формулы Фишера
|
I |
II |
III |
IV |
|
L-алло-треонин |
D-алло-треонин |
D-треонин |
L-треонин |
Для отнесения амино- и гидроксикислот к стереохимическим рядам, используется так называемый “гидроксильный ключ”, когда рассматривается конфигурация хирального центра с наименьшим номером.
По этому правилу стереоизомеры I и IV относятся к L ряду, а II и III к D-ряду. В состав белков входит L-треонин IV. Соединения I и II имеют эритроконфигурацию, т.е. заместители находятся в проекции Фишера по одну сторону углеродной цепи, в этом случае еще используется приставка алло-.
Заключение: I и II, III и IV - энантиомеры; I и III; I и IV; II и III; II и IV; диастереомеры.
Задание 2. На примере -аланина и триптофана опишите схему образования биполярной структуры. Получите дипептиды образованные этими аминокислотами. Каковы особенности строения пептидной связи?
Ответ:
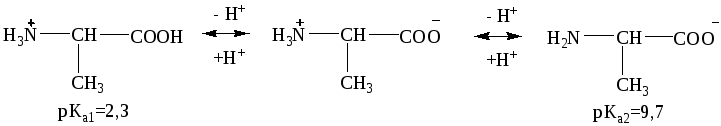
|
катионная форма |
биполярный ион |
анионная форма |
В кислой среде -аминокислоты существуют в виде катионной формы, в щелочной в виде анионной и в изоэлектрической точке в виде биполярного иона, т.е. одинаковое количество катионной и анионной форм.
![]() ,это
формула для определения изоэлектрической
точки
,это
формула для определения изоэлектрической
точки
![]()

|
катионная форма рКа1=2,4 |
биполярный ион pJтри=5,9 |
анионная форма рКа2=9,4 |
При взаимодействии триптофана и -аланина могут образовываться четыре дипептида: Три-Ала, Ала-Три, Ала-Ала, Три-Три.
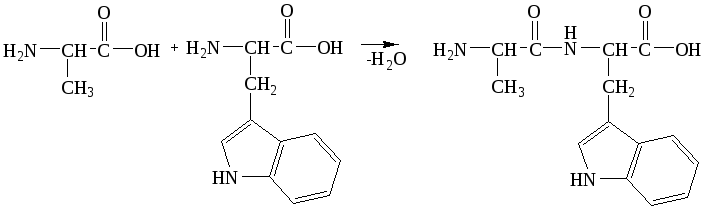
аланилтриптофан Ала-Три
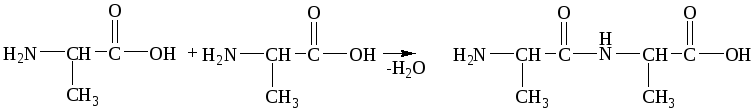
аланилаланин Ала-Ала

триптофанилтриптофан Три-Три
Строение пептидной связи
В составе пептидной (амидной) группы -СО-NH- атом углерода в sp2 гибридном состоянии, атом азота тоже в sp2 состоянии, неподеленная пара электронов атома азота вступает в сопряжение с - электронами двойной связи С=О. Пептидная группа представляет собой трехцентровую - р сопряженную систему, в которой электронная плотность смещена к кислороду, атомы С,О,N находятся в одной плоскости.
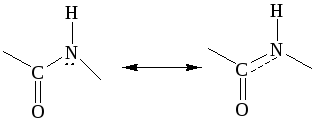
Вращение вокруг связи С-N затруднено, поэтому пептидная группа имеет плоскую, жесткую структуру.
Задание 3. Написать реакции внутри- и межмолекулярной конденсации , и аминокислот.
Ответ:
а) -аминокислоты при нагревании претерпевают межмолекулярную дегидратацию, при этом от двух молекул кислоты отщепляются две молекулы воды:
б) -аминокислоты при нагревании отщепляют аммиак с образованием непредельных кислот:
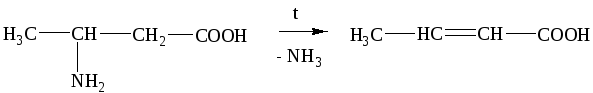
β-аминомасляная кислота кротоновая кислота
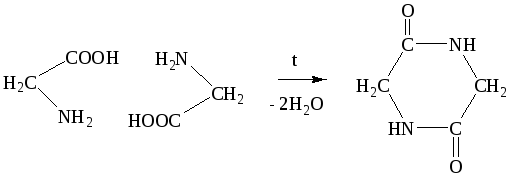
в) - аминокислоты претерпевают внутримолекулярную дегидратацию:
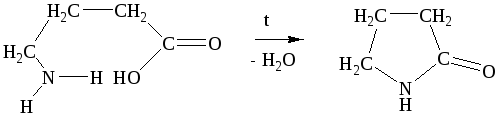
γ-аминомасляная кислота γ-бутиролактон или пирралидон-2
Задания для самостоятельной работы
Задание 1. Напишите основные реакции превращения гистидина в организме человека. Назовите продукты.
Задание 2. Напишите схему метаболизма триптофана в организме человека (окислительное дезаминирование, декарбоксилирование, гидроксилирование), приводящие к образованию -индолилпировиноградной кислоты, -индолилуксусной кислоты, триптамина, серотонина и мелатонина.
Задание 4. На примере фенилаланина напишите уравнения реакций аминокислот с гидроксидом меди, азотной кислотой, формальдегидом. Получите дипептиды фенилаланина с глицином, назовите их.
Задание 5. Напишите реакции, образования дикетопиперазина и дипептида α-аланина.
Задание 6. Реакции гидроксилирования, как способ окисления непредельных и ароматических углеводородов. Продукты гидроксилирования фенилаланина, триптамина. Названия продуктов гидроксилирования.
Задание 7. Приведите уравнение реакции, по которой можно определить наличие в белке остатков аминокислот (цистеина, метионина), содержащих атомы серы.
Задание 8. Напишите структурные формулы цистеинилаланина.
Задание 9. Напишите строение трипептидного фрагмента - валил-глицил-аланина. Изобразите электронное строение пептидной группы.
Задание 10. Приведите строение дипептида гистидилаланина.
Задание 11. Напишите схему образования биполярной структуры аминокислот на примере триптофана и -аланина. Получите дипептиды, образованные этими аминокислотами.
Задание 12. На пример -аланина напишите уравнения реакций аминокислот с уксусным ангидридом, йодистым метилом, формальдегидом, метанолом(Н+).
Тестовые вопросы
1.Укажите формулу цистеина (2-амино3-меркаптопропановая кислота):
А) HSH2C–(NH2)HC–COOH; Б) (H3C)2HC–(NH2)HC–COOH;
В) HОH2C–(NH2)HC–COOH; Г) H2N–CH2–COOH
2. Какие из перечисленных аминокислот относят к ароматическим:
А) метионин (2-амино-3-метилтиопропановая кислота);
Б) лейцин (2-амино-5-метилпентановая кислота);
В) тирозин (2-амино-3-гидроксифенилпропановая кислота;
Г) пролин (2-карбоксипирролидин)
3. Изоэлектрическая точка белка рI=4,8. Какой заряд имеет этот белок в растворе с рН=6,7?
А) положительный -;
Б) отрицательный
-
![]() ;
;
В) нулевой
Г) не имеет заряда
![]()
4.Какое соединение образуется при декарбоксилировании серина
HO–H2C–(NH2)HC–COOH
А) 2-аминопропановая кислота; Б) пропановая кислота;
В) 3-гидроксипропановая кислота; Г) 2-аминоэтанол
5.По аминогруппе глицин H2N–CH2–COOH взаимодействует:
А) с метиламином Н2N - СН3; Б) с уксусным ангидридом (СН3СОО)2О;
В) с пентахлоридом фосфора РCI5; Г) с этанолом С2Н5ОН
6. В результате окислительного дезаминирования α-аланина образуется:
![]()
А) молочная кислота (2-гидроксипропановая кислота);
Б) этанол;
В) пропановая кислота;
Г) пировиноградная кислота (2-оксопропановая кислота)
7. Качественной реакцией обнаружения белков является:
А) реакция с нингидрином; Б) биуретовая реакция;
В) ксантопротеиновая реакция; Г) реакция серебрянного зеркала
8. Молекулы природных аминокислот являются:
А) L-стереоизомерами; Б) D- стереоизомерами;
В) рацемической смесью D и L-стереоизомеров Г) оптически неактивными
9. Какая аминокислота не участвует в образовании трипептида глутатион:
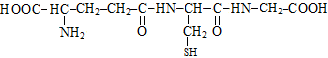
А) α-аланин; Б) глицин;
В) цистеин; Г) глутаминовая кислота
10. Название дипептида карнозин (содержится в мышечной ткани животных и человека) соответствует:
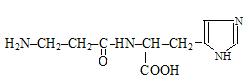
А) α-аланилгистидин; Б) гистидилаланин;
В) глицилгистидин; Г) β-аланилгистидин
Методические указания составлены профессором Сторожок Н.М. 8.11.2011
Зав. кафедрой общей и
биоорганической химии, профессор Н.М.Сторожок
