
- •Нижегородская государственная медицинская академия
- •Содержание
- •Фенолы, хиноны и их производные как лекарственные препараты
- •Лекарственные вещества
- •Испытание на подлинность
- •Количественное определение фенолов
- •1. Методы галогенирования.
- •2. Метод ацетилирования.
- •3. Фотоколориметрический метод с использованием цветных реакций.
- •Производные нафтохинонов к-витаминного действия (противогеморрагического и коагуляционного)
- •Фитол широко распространен в природе, он содержится в растениях и составляет основную часть растворимого пигмента хлорофилла.
- •Производные пара-аминофенола
- •Парацетамол.
- •Количественное определение парацетомола
- •Ароматические кислоты и их производные
- •Получение
- •Производные фенолокислот
- •Амиды салициловой кислоты
- •Подлинность:
- •Чистота. Определяют примесь n-аминофенола в водном извлечении без предварительного гидролиза.
- •Производные n-аминобензойной кислоты.
- •Синтез амидов пабк
- •Производные орто-аминобензойной кислоты.
- •Лекарственные средства - производные арилалкиламина и оксифенилалкиламина
- •Очистка
- •Количественное определение
- •Адреномиметические вещества.
- •Производные замещенных гидроксипропаноламидов – бета-адреноблокаторы
- •Является наиболее эффективным препаратом этого ряда
- •Чистота
- •Количественное определение
- •Хранение. По списку б, в хорошо укупоренной таре, предохраняющей от действия света.
- •Хранение: По списку б, в хорошо укупоренной таре, предохраняющей от действия света.
- •Биохимические предпосылки получения лекарственных веществ в ряду фенилалкиламинов.
- •Нитрофенилалкиламины
- •Чистота
- •Количественное определение
- •Бензолсульфаниламиды и их производные
- •Сульфаниламидные препараты
- •Классификация по химическому строению
- •Получение
- •Литература
Производные пара-аминофенола
Анилин – жаропонижающее вещество, токсичен. Молекула анилина в организме окисляется до n-аминофенола, который менее ядовит.
В организме анилин связывается с кислотами типа глюкуроновой, образуя хорошо растворимые соединения, которые с мочой выводятся из организма.
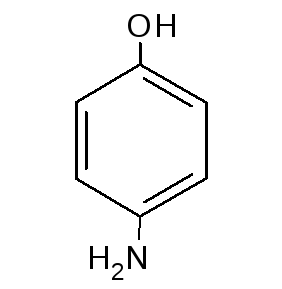
Однако, n-аминофенол, в отличие от анилина, не обладает жаропонижающим свойством и при этом разрушает эритроциты.
Устранение этих недостатков возможно, если «защитить» гидроксильную и аминогруппу в ароматическом кольце. Пример – фенацетин.
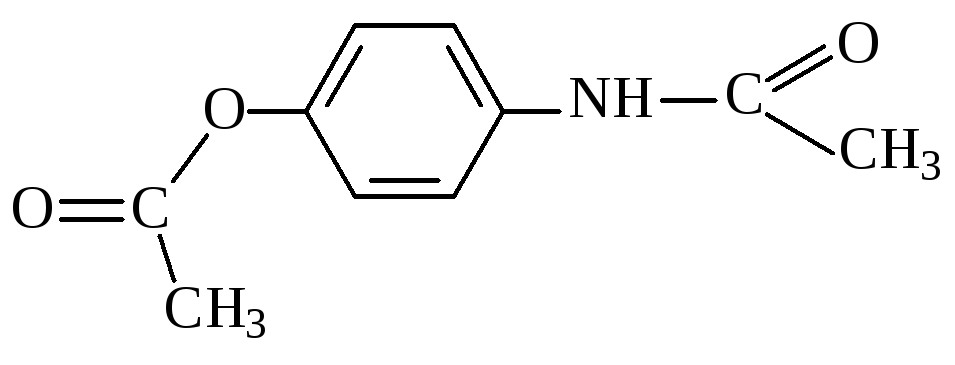
Фенацетин обладает жаропонижающим и легким наркотическим действием (анальгетик).
Создание физиологически активных веществ путем преобразования молекулы анилина называется «принципом фенацетина».
Парацетамол.
Paracetamolum, n-ацетаминофенол
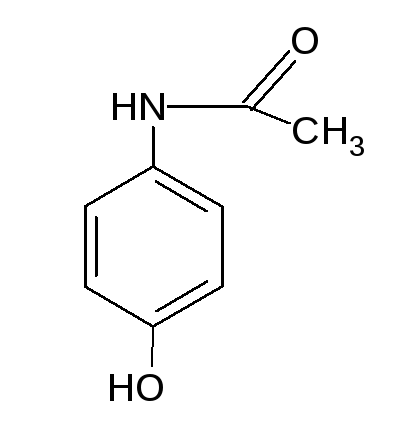
Описание.
Белый или белый с кремоватым или розовым оттенком кристаллический порошок, без запаха. Т.пл. = 167-172 °С. Мало растворим в воде, легко растворим в спирте, практически не растворим в эфире, легко растворим в растворах гидроксидов щелочных металлов. рКа =9,92.
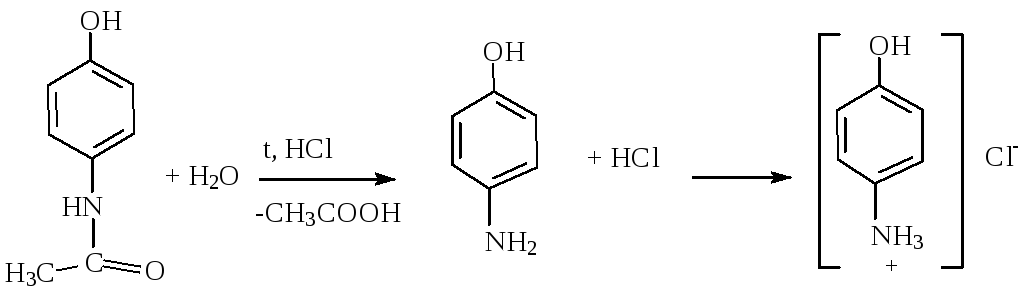
Получение
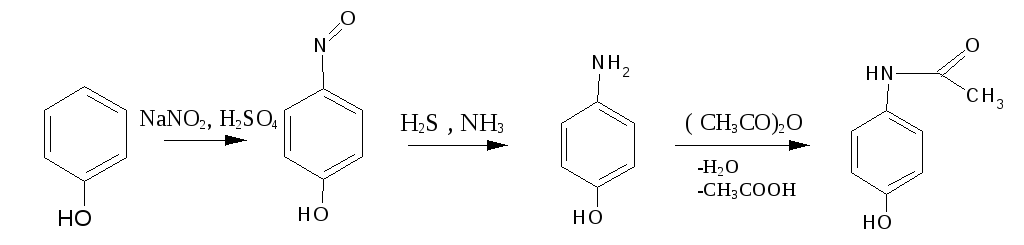
Фенол нитрозируется нитритом натрия в кислой среде, n-нитрозофенол восстанавливается сероводородом в аммиачной среде до n-аминофенола, который затем ацетилируется.
Подлинность
МФ: УФ- спектр в метаноле : λmax= 249 нм
УФ- спектр в 0,001 М NaOH: λ max = 255нм
λ max = 273 нм
Т.пл. = 168 – 172°С
Реакция по фенольному гидроксилу, образование комплексного соединения с FeCl3
Реакция на ароматическую аминогруппу, проводят кислотный гидролиз
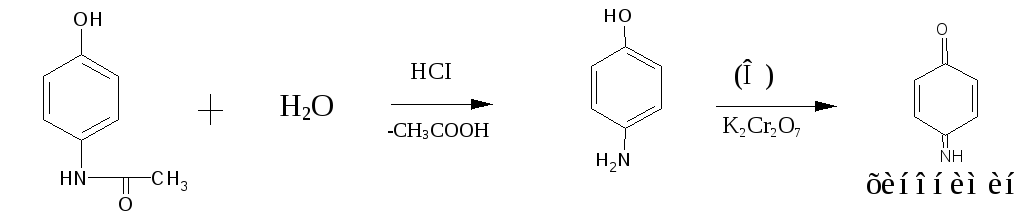
Продукт гидролиза окисляют K2Cr2O7 до хинонимина. Непрореагировавший n-аминофенол при взаимодействии с хинонимином образует индофенол.
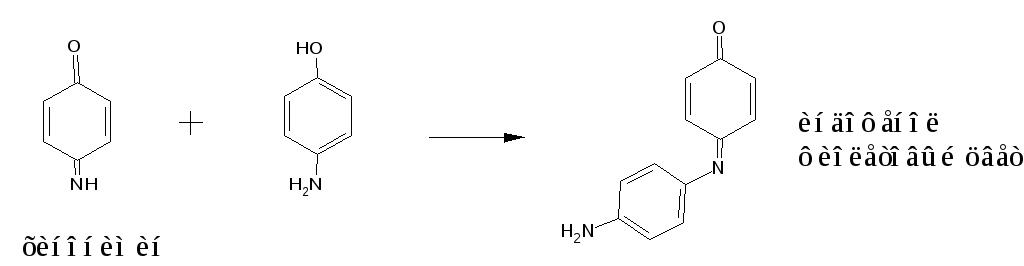
Гидролиз в среде серной кислоты, выделяется уксусная кислота, которую определяют по запаху
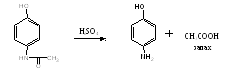
Чистота
Устанавливают примесь свободного n-аминофенола нитритометрическим методом.
Количественное определение парацетомола
Определяют по продукту кислотного гидролиза n-аминофенолу, используя нитритометрический метод.
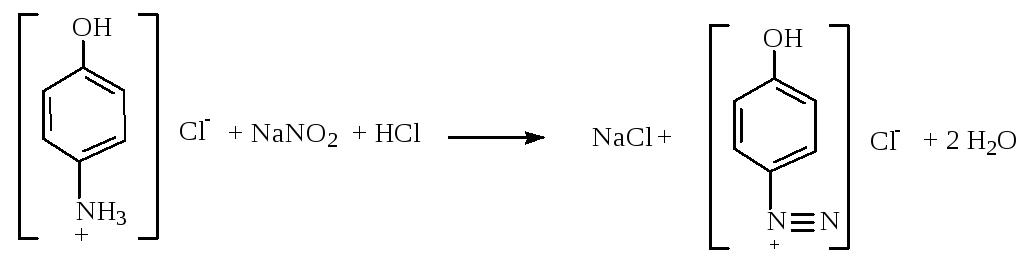
Эквивалентную точку устанавливают потенциометрически или с помощью йодкрахмальной бумаги, которая синеет от выделившегося йода.
NaNO2 +HCI → NaCI +HNO2
KI +HCI → KCI +HI
2 HNO2 +2HI → I2 + 2NO↑ + 2H2O
Эквивалентную точку при нитритометрическом определении парацетамола можно также установить со смешанным индикатором, содержащим 0,1%-ный раствор тропеолина 00 и 0,15%-ный раствор метиленового синего.
Хранение
Список Б. В хорошо укупоренной таре, предохраняющей от света, сухом месте (не допускается гидролиз)
Применение
Используется как жаропонижающее и болеутоляющее средство (0,2-0,5 г.). Панадол.
Ароматические кислоты и их производные
Это ароматические углеводороды, у которых в бензольном кольце один или несколько атомов водорода замещены на карбоксильную группу.
Ароматические кислоты обладают всеми свойствами кислот.
Кислотно-основные свойства.
Образуют растворимые соли при взаимодействии с гидроксидами, карбонатами и гидрокарбонатами щелочных металлов (К+, Na+) и NH4+.
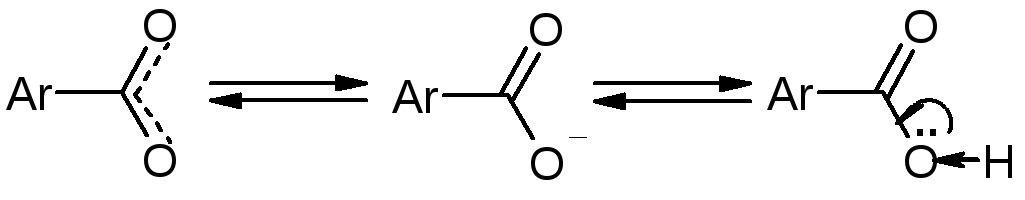
В ионизированной форме образуют соли с тяжелыми металлами (Fe, Cu, Co) - слабое основание ArCOO— взаимодействует со слабой кислотой Льюиса (Fe3+, Cu2+, Co2+). Ароматическое кольцо усиливает кислотность вещества.
Ка бензойной к-ты=6,3·10-5,
Ка СН3СООН=1,8·10-5.
Кислотность возрастает, если карбоксилат-ион стабилизирован внутримолекулярными водородными связями.
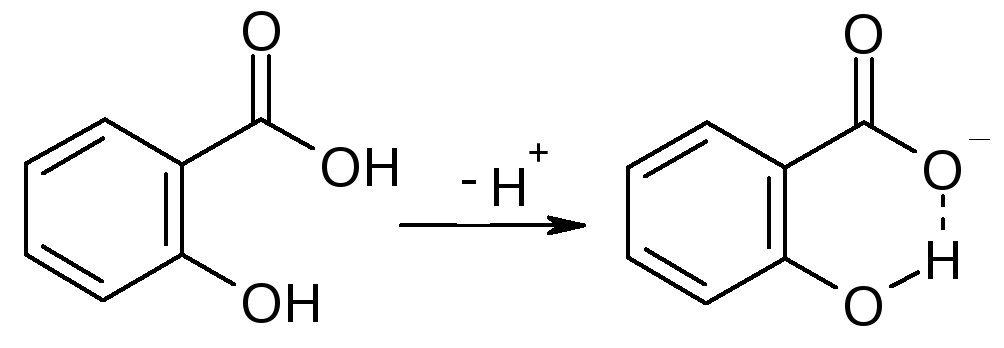
Салициловая кислотаСалицилат-ион
рКа=2,98; Ка=1,06·10-3
Анион не стабилизирован внутримолекулярной водородной связью.
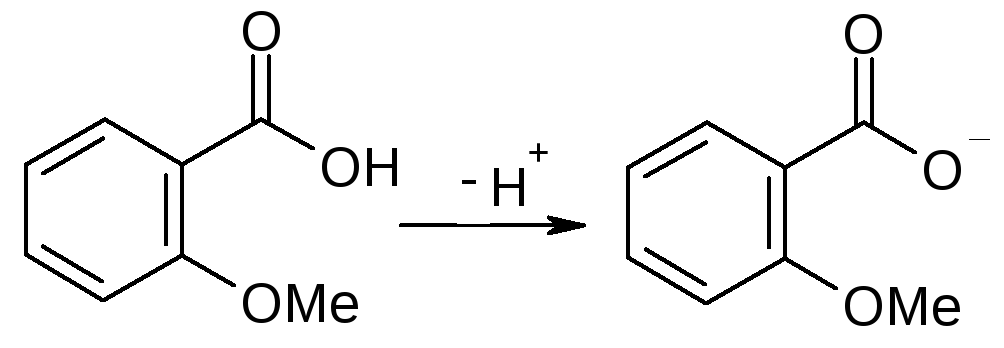
о-метоксибензойная кислота рКа=3,09
Образование амидов ароматических кислот по реакции с аминами.
Реакции с участием водорода карбоксильной группы: образование сложных эфиров, ангидридов, хлорангидридов и других производных.
Лекарственные препараты на основе ароматических кислот.
1. Бензойная кислота, Acidum benzoicum.
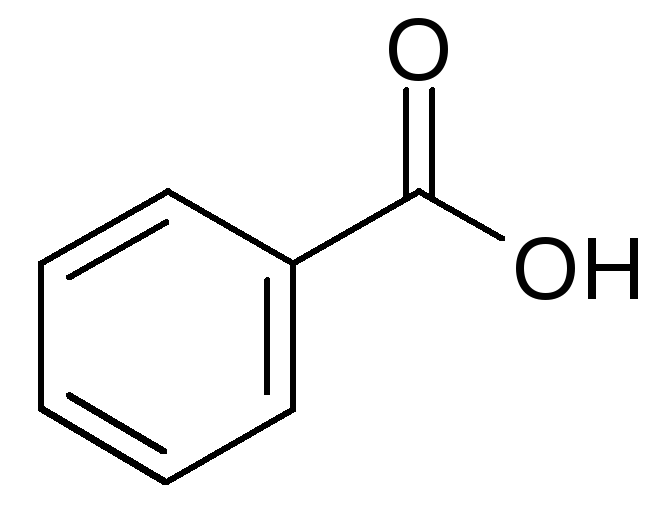 Бесцветные
игольчатые кристаллы или мелкокристаллический
порошок. Тпл=122-124,5°С.
Мало растворим в воде, легко в спирте,
хлороформе, маслах, в кипящей воде
(1:25), возгоняется при нагревании.
Бесцветные
игольчатые кристаллы или мелкокристаллический
порошок. Тпл=122-124,5°С.
Мало растворим в воде, легко в спирте,
хлороформе, маслах, в кипящей воде
(1:25), возгоняется при нагревании.
Содержится в некоторых смолах, бальзамах, в перуанском и толуанском бальзаме, клюкве, бруснике и других ягодах. В природе встречается иногда в связанном виде.
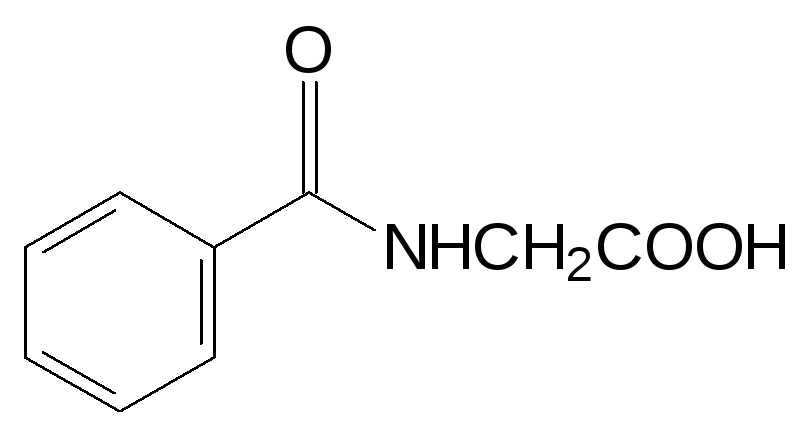
гинпуровая кислота
Получение.
1) Из толуола - окислением:

2) Из толуола – хлорированием с последующим омылением:

3) Из фталевой кислоты - декарбоксилированием:
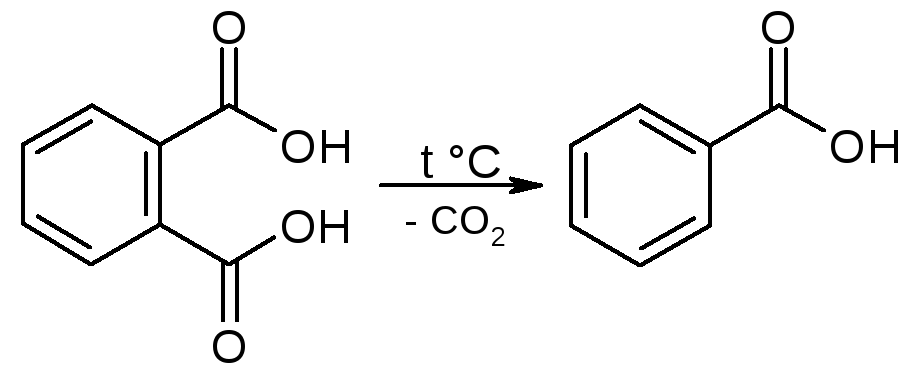
Кислота салициловая, Acidum salicylicum.
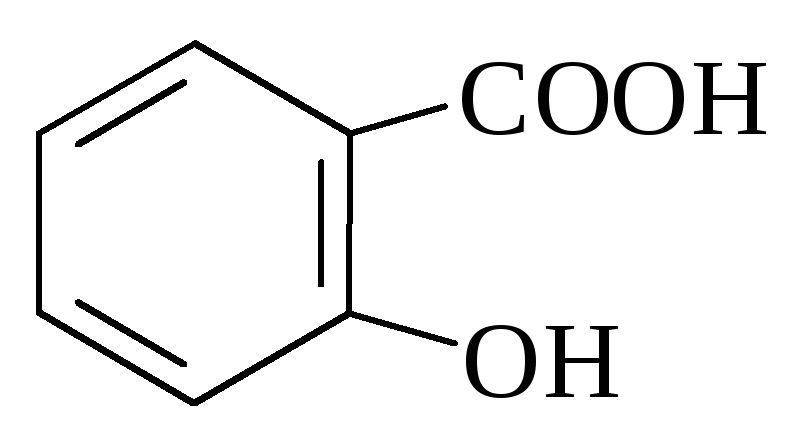
Орто-оксибензойная кислота.
Белые мелкие игольчатые кристаллы или кристаллический порошок без запаха. Тпл=158-161°С. Мало растворим в воде, растворим в кипящей воде, легко растворим в этаноле и эфире, трудно растворим в хлороформе.
Салициловая кислота широко распространена в природе, в листьях некоторых растений, в цветках ромашки. В виде метилового эфира салициловая кислота содержится во многих маслах, в том числе в масле гвоздики, туберозы, иве. В растениях метиловый эфир салициловой кислоты связан с сахарами в виде гликозидов, легко гидролизующихся под влиянием ферментов. Летуча с водяным паром, возгоняется. Относится к фенолокислотам.
Получение.
Карбоксилированием фенола по реакции Кольбе – Шмидта.
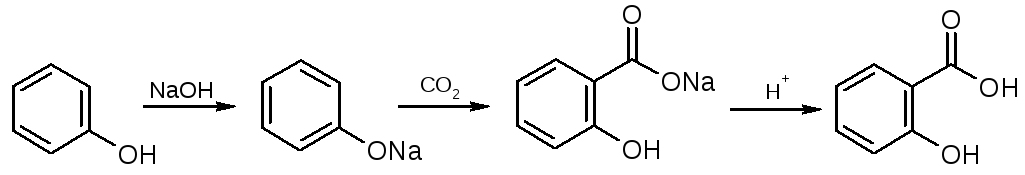
салицилат натрия
Выпаренную досуха смесь фенола и NaOH нагревают в автоклаве (130°С) с СО2 под давлением 450 –500кПа (4,5-5 атм). Продукт реакции растворяют в воде, подкисляют HCl и перекристаллизовывают. Побочный продукт реакции – оксидифенил.
Натрия бензоат. Natrii benzoas.
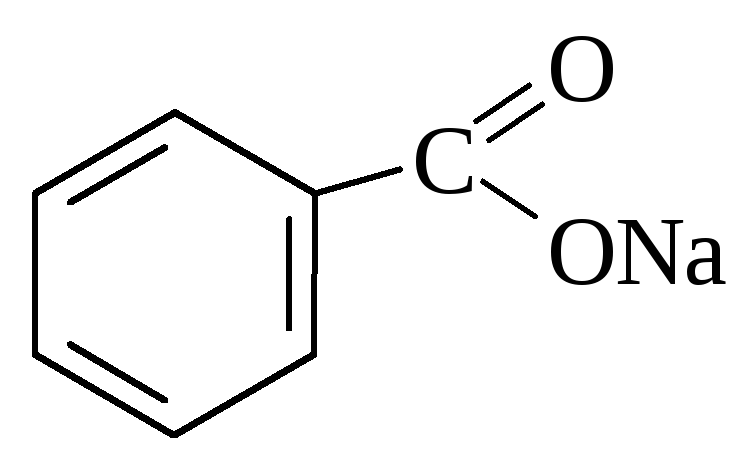
Белый кристаллический порошок без запаха или с очень слабым запахом, сладковато – соленого вкуса. Легко растворим в воде, трудно растворим в этаноле.
Натрия салицилат. Natrii salicylas.
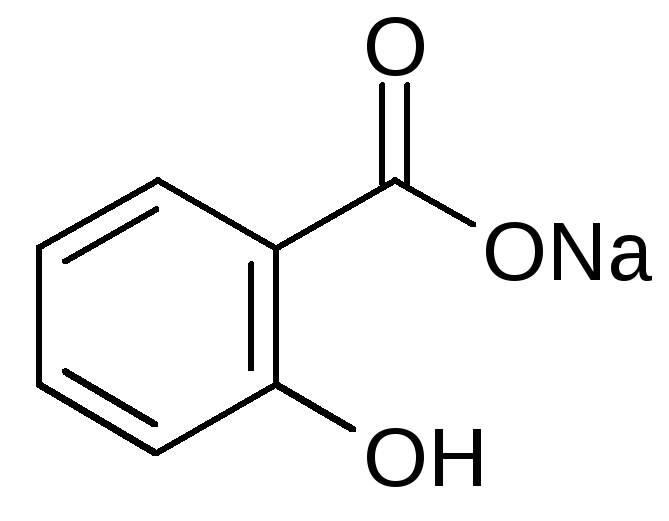
Белый кристаллический порошок или мелкие чешуйки без запаха, сладковато-соленого вкуса. Легко растворим в воде, растворим в этаноле.
