
- •Основные понятия химии
- •Основные законы химии
- •НЕОРГАНИЧЕСКАЯ ХИМИЯ
- •Основные классы неорганических соединений
- •Оксиды
- •Кислоты
- •Основания
- •Соли
- •Классификация химических реакций
- •Химическая кинетика
- •Скорость химической реакции
- •Химическое равновесие
- •Периодический закон и периодическая система химических элементов Д. И. Менделеева
- •Химическая связь и строение вещества
- •Растворы
- •Теория электролитической диссоциации (С. Аррениус, 1887 г.)
- •Металлы
- •Общие свойства металлов
- •Подгруппа щелочных металлов (главная подгруппа I группы)
- •Железо и его соединения
- •Общие сведения о неметаллах
- •Водород и его соединения
- •Подгруппа галогенов (главная подгруппа VII группы)
- •Хлор и его свойства
- •Соединения хлора
- •Фтор, бром, иод
- •Кислород и его свойства
- •Сера как простое вещество и химический элемент
- •Соединения серы
- •Подгруппа азота (главная подгруппа V группы)
- •Оксиды азота
- •Соединения фосфора
- •Подгруппа углерода (главная подгруппа IV группы)
- •Соединения углерода
- •Кремний как простое вещество
- •Соединения кремния
- •ОРГАНИЧЕСКАЯ ХИМИЯ
- •Теория химического строения органических соединений (А. М. Бутлеров)
- •Углеводороды
- •Насыщенные углеводороды (алканы)
- •Циклоалканы, или циклопарафины (СnH2n)
- •Кислородосодержащие органические соединения
- •Спирты
- •Карбоновые кислоты
- •Углеводы
- •АЗОТОСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- •Амины
- •Аминокислоты
- •Белки
- •Ряд электроотрицательности неметаллов
- •Электрохимический ряд активности металлов
- •Относительные молекулярные массы некоторых неорганических соединений
- •Качественные реакции на катионы и анионы
- •Относительные молекулярные массы некоторых органических соединений
- •Качественные реакции на органические вещества
- •Растворимость кислот, оснований и солей в воде

Химия |
75 |
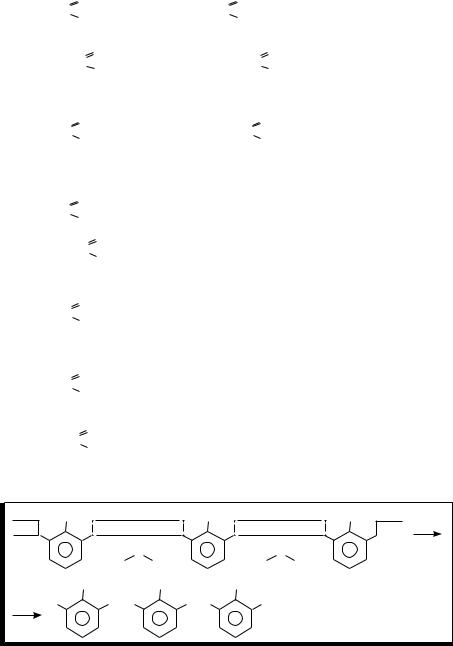
Природные источники углеводородов — это разные виды топлива..
|
Топливо |
|
|
|
|
|
|
твёрдое: |
жидкое: |
газообразное: |
|
уголь, горючие сланцы, |
нефть |
природный газ, |
|
древесина, торф |
|
|
сопутствующие газы нефти |
|
|
|
|
Нефть — это смесь парафиновых, циклопарафиновых (нефтеновых) и ароматических углеводородов..
Природный газ — на 90–95 % состоит из метана..
Сопутствующие газы нефти — это растворённые в нефти углеводороды (метан, этан, пропан, бутан), которые при поднятии нефти на поверх
ность выделяются из неё..
Переработка нефти
Первичная |
|
Вторичная |
|
(перегонка) |
(расщепление углеводородов) |
||
Бензин (t ° кип.. от 40 °С до 200 °С) содержит |
Термический крекинг |
||
углеводороды С5–С10.. |
(450–550 °С, 2–7 МПа) |
||
Используется как моторное, авиационное |
С16Н34 |
→ С8Н18 + С8Н16 |
|
и автомобильное горючее; растворитель масел.. |
С8Н18 |
→ С4Н10 |
+ С4Н8 |
Лигроин (t ° кип.. от 120 °С до 240 °С) содержит |
С4Н10 |
→ С2Н6 |
+ С2Н4 |
углеводороды С8–С14 |
Каталитический крекинг (450 °С, |
||
Используется как горючее для тракторов; рас- |
101 КПа).. |
|
|
творитель в лакокрасочной промышленности.. |
Расщепление и изомеризация |
||
Керосин (t ° кип.. от 180 °С до 300 °С) содержит |
углеводородов в присутствии |
||
углеводороды С12–С18 |
катализаторов — алюмосили- |
||
Применяется как горючее для реактивных |
катов.. |
|
|
двигателей и тракторов.. |
Ароматизация углеводородов (ка- |
||
Газойль (t ° кип.. от 270 °С до 350 °С) содержит |
тализаторы Pt, Mo, повышен- |
||
углеводороды С18–С25 |
ная t °).. |
|
|
Горючее для дизелей.. |
Алканы, циклоалканы → Аре- |
||
Мазут (t ° кип.. от 300 °С и выше) содержит уг- |
ны.. |
|
|
леводороды С20 и выше.. |
|
|
|
Используется в производстве парафина, вазе- |
|
|
|
лина, смазочных масел и т.. д.. |
|
|
|
Кислородосодержащие органические соединения
К кислородосодержащим органическим соединениям относятся спир-
|
|
ОН |
|
|
|
ты R – (ОН)n, фенолы |
|
, простые эфиры R1 – О – R, альдеги- |
|||
О |
|
–R1, карбоновые кислоты R–C |
О |
||
ды R–C , кетоны R– |
, сложные |
||||
H |
О |
|
|
|
ОH |
|
CH –O–CO–R |
|
|||
|
О |
2 |
|
1 |
|
эфиры R–C |
, жиры |
– |
|
|
|
CH–O–CO–R |
2 |
|
|||
|
O |
– |
|
|
|
|
|
|
|
||
|
|
CH2–O–CO–R3, |
|
||
76 |
Все для школьника |
Спирты
Спиртами называют органические соединения, в состав молекул которых входят одна или несколько функциональных гидроксильных групп
–ОН, соединённых с углеводородным радикалом..
Их можно рассматривать как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами..
Спирты
по типу радикала |
|
|
|
|
|
по положению групп –OH |
|||||||||||
насыщенные |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ароматические |
|
|
|
|
первичные |
|
|||||||||
CH3–CH2–OH |
|
|
|
|
CH2–OH |
|
|
4 |
3 |
2 |
|
|
1 |
|
|||
этанол |
|
|
|
|
|
|
|
|
|
|
CH3–CH2–CH2–CH2–OH |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
бутанол-1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
ненасыщенные |
|
|
|
|
|
|
|
|
|
|
|
вторичные |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH2=CHOH |
|
|
|
|
|
|
|
|
|
4 |
3 |
2 |
1 |
|
|||
виниловый |
|
|
по числу групп –OH |
|
CH3–CH2–CH–CH3 |
||||||||||||
спирт, этенол |
|
|
|
|
|
|
|
ОН |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
бутанол-2 |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||
одноатомные |
двухатомные |
|
трехатомные |
третичные |
|||||||||||||
CH3OH |
|
CH2–CH2 |
CH2–CH–CH2 |
|
CH3 |
||||||||||||
|
|
|
|
|
|
1 |
2 |
3 |
|
|
|
|
|
|
|||
метанол |
|
|
|
|
|
|
|
|
|
|
|
|
|
– |
|
|
|
|
|
ОН ОН |
ОН |
ОН ОН |
|
|
|
|
|||||||||
|
|
CH3–C–CH |
|||||||||||||||
|
этандиол 1, 2 |
пропантриол 1, 2, 3 |
|
|
|
|
3 |
|
|||||||||
|
|
|
ОН |
|
|
||||||||||||
|
этиленгликоль |
|
глицерин |
|
|
|
|
||||||||||
|
|
2-метилпропанол-2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Изомерия и номенклатура
спиртов
СН3 – СН2 – СН2 – СН2 – ОН бутанол-1
1) изомерия углеродного скелета
3 |
2 |
1 |
C Н3– C Н2– C Н2–ОН |
||
|
СН |
2-метилпропанол-1 |
|
|
3 |
2) изомерия положения функциональной группы
3 |
2 |
1 |
СН3– C Н2– C Н– C Н3 |
||
|
ОН 2-бутанол |
|
3)межклассовая изомерия
СН3–СН2–О–СН2–СН3
диэтиловый эфир
Чтобы дать название спирту, нужно:
1)пронумеровать самую длинную цепочку атомов углерода, начиная с того конца, к которому ближе группа –ОН;
2)указать цифрами положение заместителей, дать им название;
3)указать цифрой положение группы
–ОН;
4)приписать название углеводорода, у которого в молекуле столько же атомов углерода, сколько их в пронумерованной цепи;
5)дописать суффикс -ол..
Химия |
|
|
|
|
|
77 |
||
|
Гомологический ряд насыщенных одноатомных спиртов CnH2n + 1ОН |
|||||||
|
СН3ОН |
метиловый |
|
метанол |
|
t ° кип.. увеличива- |
||
|
С2Н5ОН |
этиловый |
|
этанол |
|
|
ется, растворимость |
|
|
С3Н7ОН |
пропиловый |
|
пропанол |
|
в воде уменьшается; |
||
|
|
|
до С12 — жидкости, |
|||||
|
С4Н9ОН |
бутиловый |
|
бутанол |
|
|||
|
|
|
далее — твёрдые ве- |
|||||
|
С5Н11ОН |
амиловый |
|
пентанол |
|
|||
|
|
|
щества |
|||||
|
С6Н13ОН |
гексиловый |
|
гексанол |
|
|
||
|
С7Н15ОН |
гептиловый |
|
гептанол |
|
|
||
|
С8Н17ОН |
октиловый |
|
октанол |
|
|
||
|
С9Н19ОН |
нониловый |
|
нонанол |
|
|
||
|
С10Н21ОН |
дециловый |
|
деканол |
|
|
||
|
Среди спиртов нет газообразных веществ, потому что молекулы спиртов |
|||||||
ассоциированы возникающими между ними водородными связями: |
||||||||
|
|
…О–Н…О–Н…О–Н… |
||||||
|
|
R |
R |
|
R |
|
||
|
Низшие спирты хорошо растворяются в воде, потому что между моле- |
|||||||
кулами спирта и молекулами воды тоже возникает водородная связь: |
||||||||
|
|
…О–Н…О–Н…О–Н…О–Н… |
||||||
|
|
R |
|
H |
R |
|
H |
|
1) |
горят С2Н5ОН + 3О2 → 2СО2↑ + 3Н2О |
|
Химические |
|||||
2) |
взаимодействуют с активными металлами |
|||||||
свойства |
||||||||
|
2С2Н5ОН + 2Na → 2C2H5ONa + H2↑ |
|
||||||
|
|
|
||||||
|
|
этилат натрия |
|
|
|
|||
3) |
вступают в реакции окисления |
O |
|
|
||||
|
|
t ° |
|
CH3C |
+ Cu + H2O |
|||
|
СН3–СН2ОН + CuO → |
|
H |
|||||
|
этанол |
|
этаналь, |
|
|
|||
|
|
уксусный альдегид |
|
|
||||
! ЭТО КАЧЕСТВЕННАЯ РЕАКЦИЯ НА ЭТАНОЛ
4) взаимодействуют с галогеноводородами (HCl, HBr и др..)
C2H5OH +HBr t °→ C2H5Br + H2O
бромэтан
5)вступают в реакции дегидратации а) внутримолекулярная дегидратация
С2Н5ОН |
160°C |
|
|
С2Н4 + Н2О |
|
|
|
|
|
|
|
|
|
|
||||||||||
→ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
H2SO4 |
|
|
этен |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
конц. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
б) межмолекулярная дегидратация |
|
|
|
|
|
|
|
|
|
|||||||||||||||
С |
|
Н |
|
ОН + НОС |
Н |
|
140°C |
|
Н |
–О–С |
Н |
|
+ Н |
О |
|
|||||||||
|
|
|
→ С |
|
|
|||||||||||||||||||
|
2 |
|
|
5 |
|
|
2 |
|
5 |
H2SO4 |
2 |
5 |
|
|
2 |
|
5 |
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
конц. |
диэтиловый эфир |
|
|
|
||||||||||
6) вступают в реакции эстерификации |
|
|
|
|
|
|
|
|
||||||||||||||||
СН |
|
|
– С |
O |
+ НО–С |
Н |
|
|
t° |
|
|
|
– С |
O |
+ Н |
О |
||||||||
|
|
|
|
→ СН |
|
|
||||||||||||||||||
|
|
|
3 |
|
|
H |
|
|
|
2 |
|
5 |
|
H2SO4 |
|
3 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
конц. |
|
|
|
|
|
|
C2H5 |
|
|||
уксусно-этиловый эфир, этилацетат

78 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Все для школьника |
||||
|
|
|
|
|
|
|
Получение спиртов: |
|
|
|
|
|||||||
|
|
Получение |
|
|
|
|
|
|
||||||||||
|
|
|
1) щелочной гидролиз галогенопроизводных углеводо- |
|||||||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
родов C |
H |
|
|
|
|
|
t° |
|
C |
H |
OH + HBr |
|
|
|
|
|
|
|
Br + HOH → |
|
|
|
||||||||||||
2) |
2 |
5 |
|
|
|
|
|
KOH |
2 |
5 |
|
|
|
|
|
|||
восстановление альдегидов |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
СН |
–С O + Н |
|
t° |
|
|
ОН |
||||||
|
|
|
|
|
|
→ СН –СН |
||||||||||||
|
|
|
|
|
|
|
3 |
|
|
H |
|
2 |
Ni |
3 |
2 |
|
|
|
|
|
|
|
|
|
|
этаналь |
|
|
|
|
этанол |
|
|
||||
3) |
гидратация алкенов |
|
|
|
|
|
t °,P |
|
|
|
|
|||||||
|
|
|
|
|
|
СН =CН |
|
+ НОН |
|
|
|
|
ОН |
|||||
|
|
|
|
|
|
|
→ СН –СН |
|||||||||||
|
|
|
|
|
|
|
2 |
|
2 |
|
|
|
H3PO4 |
3 |
|
2 |
|
|
|
|
|
|
|
|
|
этен |
|
|
|
|
|
|
этанол |
|
|||
4) |
спиртовое брожение глюкозы С6Н12О6 → 2С2Н5ОН + 2СО2↑ |
|||||||||||||||||
5) |
синтез СО + 2Н2 |
|
400°C |
СН3ОН |
|
|
|
|
|
|||||||||
|
ZnO |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
→ |
|
|
|
|
|
|
|
|
|||
метанол
Метанол СН3ОН — бесцветное, легкоподвижное вещество, сильный яд, t ° кип.. — 64,7 °С.. Имеет ещё названия карбинол, древесный спирт, по скольку его можно получить сухой перегонкой дерева.. Используется как растворитель, а также для получения формальдегида, некоторых красителей, фотореактивов, фармацевтических препаратов..
Этанол С2Н5ОН — бесцветное, легко подвижное вещество; кипит при 78,3 °С, замерзает при –114 °С.. Применяется для получения каучука, пласт масс, как растворитель, в производстве красителей, лекарственных препаратов, уксусной кислоты и др..
Этиленгликоль — представитель насыщенных двухатомных спиртов — гликолей.. Общая формула ряда CnH2n(ОН)2.. Этиленгликоль (1,2-этанди- ол) — сиропообразное вещество, без запаха, сладкое на вкус, ядовитое.. Хорошо смешивается с водой и спиртом, гигроскопично.. Структурная формула этиленгликоля СН2–СН2 или СН2ОН–СН2ОН..
|
|
ОН ОН |
|
|
|
|
|
1) реагирует со щелочными металлами |
|
||
|
Химические |
|
|||
|
CH2–OH |
|
CH2–ONa |
|
|
|
свойства |
2Na → 2 |
+H2 |
||
|
|
2 |
|
||
|
|
|
|||
|
|
CH2–OH |
|
CH2–OН |
|
|
|
CH2–OH |
2Na → |
CH2–ONa |
+H2 |
|
|
CH2–OH |
CH2–ONa |
||
2)реагирует с гидроксидом меди(II) — это качественная реакция на многоатомные спирты
2 CH2–OH |
Сu(OH)2↓ t ° CH2–O |
Сu O–CH2 |
+ 2H2O |
CH2–OH |
CH2–O |
O–CH2 |
|
|
|
гликолят меди(II) |
|
(ярко-синий)

Химия |
|
|
|
|
|
|
79 |
|||||||||
3) |
реагирует со щелочами |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
CH2–OH + 2NaOH →CH2–ОNa + 2H2O |
||||||||||
|
|
|
|
|
|
CH2–OH |
|
|
|
|
|
CH2–ОNa |
||||
4) |
реагирует с азотной кислотой |
|
|
|
|
|
|
|
||||||||
|
|
|
|
CH2–OH + 2HO–NO2 |
→ CH2–O–NO2 + 2H2O |
|||||||||||
|
|
|
|
CH2–OH |
|
|
|
|
|
|
CH2–O–NO2 |
|||||
|
Получают этиленгликоль: |
|
|
|
|
динитрогликоль |
||||||||||
|
|
|
|
|
|
|
|
|||||||||
|
СН2=СН2 |
+ Н2О + [O] |
KMnO4 |
|
|
|
|
СН2– |
|
СН2 |
||||||
|
→ |
|
|
|||||||||||||
|
|
|
|
|
|
СН2 + 2NaOH → |
|
|
|
|
|
|
ОН |
|
ОН |
|
|
или |
|
СН2– |
|
|
СН2– |
|
СН2 + 2NaCl |
||||||||
|
Cl |
Cl |
ОН |
ОН |
||||||||||||
Используется как антифриз, в производстве лавсана..
Глицерин С3Н8О3 (1,2,3-пропантриол) — простейший представитель трёхатомных спиртов.. Это бесцветная, вязкая, очень гигроскопичная жидкость, сладкая на вкус.. По химическим свойствам подобен этиленгликолю:
|
|
|
H |
|
CH2–OH |
CH2–O |
Cu |
О–CH2 |
|
|
t ° |
O–CH + 2H2O |
||
|
|
|||
2 СH–OH + Сu(OH)2↓ → CH–O |
H |
|||
CH2–OH |
CH2–OH |
HO–CH2 |
||
|
||||
купрум(ІІ) глицерат
CH2–OH CH2–O–NO2
СH–OH + 3HO–NO2 → CH–O–NO2 + 3H2O
CH2–OH CH2–O–NO2
нитроглицерин
В реакции с высшими карбоновыми кислотами образует жиры и масла:
CH2–OH |
CH2–O–CO–R |
О |
|
– |
→ CH–O–CO–R + 3H2O |
СH–OH + 3R–C |
|
– |
|
OH |
|
CH2–OH |
CH2–O–CO–R |
Глицерин используется в производстве нитроглицерина (взрывчатое вещество), для приготовления антифризов, в производстве косметических средств, кожаных изделий, лекарственных препаратов..
80 |
Все для школьника |
Фенолы
OH OH
 CH3
CH3
фенол ортометилфенол, или ортокрезол
Фенолы — это органические ароматические соединения, в молекулах которых гидроксильные группы непосредственно связаны с бензоль ным кольцом..
Фенол (или карболовая кислота) — бесцвет-
ное кристаллическое вещество с резким запахом.. Плавится при 42,3 °С, кипит при 182 °С; частично растворяется в воде (6 г в 100 г воды), имеет сильные антисептические свойства..
Химические свойства фенола объясняются взаимным влиянием гидроксильного радикала –ОН и радикала фенила (С6Н5–).. Это взаимное влияние состоит в том, что
водород гидроксильной группы более подвижный, чем у спиртов, поэтому фенолы, в отличие от спиртов, реагируют не только со щелочными металлами, а и со щелочами:
O H 2С6Н5ОН + 2Na → 2С6Н5ОNa + Н2↑
фенолят натрия
С6Н5ОН + NaОН → С6Н5ОNa + Н2О
Одновременно в ароматическом ядре замещение происходит иначе, чем в молекуле бензола, при этом образуются трёхзамещенные производные:
OH |
OH |
|
Br |
Br |
это качественная реакция |
|
|
|
+ 3Br2 → |
+ 3HBr |
на фенол |
|
Br (белый) |
|
2,4,6-трибромфенол |
|
|
OH |
|
OH |
|
O2N |
NO2 |
|
+ 3HO–NO2 → |
+ 3H2O |
|
2,4,6-тринитрофенол, |
NO2 |
пикриновая кислота |
Получают фенол из каменноугольной смолы, а также синтетически из бензола и пропилена:
CH3
 CH–CH3
CH–CH3
+ CH2=CH–CH3 →
изопропилбензол, кумол

Химия |
81 |
CH3 OH
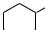 CH–CH3 + О2 →
CH–CH3 + О2 →  + CH3–CH–CH3
+ CH3–CH–CH3
О
фенол ацетон
Альдегидами называют органические соединения,
в молекулах которых карбонильная группа –С |
O |
свя- |
|||||||
зана с углеводородным радикалом.. |
H |
|
|||||||
|
|
||||||||
5 |
4 |
3 |
2 |
1 |
|
O |
|
|
|
C Н – C Н – C Н – C Н – C |
|
|
|
||||||
3 |
|
|
2 |
2 |
2 |
|
H |
|
|
|
|
пентаналь |
|
|
|
|
|||
|
|
|
|
|
|
|
|||
1) изомерия углеродного скелета |
|
|
|||||||
4 |
3 |
2 |
1 |
O |
3-метилбутаналь |
|
|
||
C Н3– |
C Н– C Н2– C |
H |
|
|
|||||
|
|
|
|
||||||
|
СН3 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
2)межклассовая изомерия СН3–СН2–С–СН2–СН3 диэтилкетон
О
СН3–С–СН2–СН2–СН3 метилпропилкетон
О
Чтобы дать название альдегиду, нужно:
Альдегиды
Изомерия
иноменклатура
альдегидов
O
R–C H R–C–R
О
альдегиды кетоны
1)пронумеровать самую длинную цепочку атомов углерода, начиная с углерода функциональной группы;
2)цифрами указать положение заместителей, дать им названия;
3)написать название углеводорода, в молекуле которого столько атомов углерода, сколько их в пронумерованной цепочке;
4)дописать суффикс -аль.
Гомологический ряд альдегидов
Н–С  O муравьиный альдегид, формальдегид, метаналь (газ)
O муравьиный альдегид, формальдегид, метаналь (газ)
H
СН –С O |
уксусный альдегид, ацетальдегид, этаналь (жидкость) |
|
3 |
H |
|
|
|
|
СН3–СН2–С  O пропионовый альдегид, пропаналь (жидкость)
O пропионовый альдегид, пропаналь (жидкость)
 H
H
СН3–СН2–СН2–С  O масляный альдегид, бутаналь (жидкость)
O масляный альдегид, бутаналь (жидкость)
 H
H
СН3–СН2–СН2–СН2–С  O валериановый альдегид, пентаналь H (жидкость)
O валериановый альдегид, пентаналь H (жидкость)
СН3–СН2–СН2–СН2–СН2–С  O капроновый альдегид, гексаналь H (жидкость)
O капроновый альдегид, гексаналь H (жидкость)
t ° возрастает кип..
82 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Все для школьника |
|||
|
|
|
|
|
|
|
|
|
|
|
|
Химические свойства альдегидов: |
|||||||||||||||
|
|
Химические |
|
|
1) |
|
|||||||||||||||||||||
|
|
|
|
|
реакции окисления: |
|
|
|
|||||||||||||||||||
|
|
|
свойства |
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
– реакция «серебряного зеркала».. |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
t° |
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
R–C |
+ Ag2O |
→ |
|
R–C |
|
+ 2Ag↓ |
|
|||||||||||||||||
|
|
|
H |
|
|
NH+4 |
|
ОH |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
альдегид |
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
t ° |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
СН3–C |
+ Ag2O |
→ |
|
СН3–C |
|
+ 2Ag↓ |
||||||||||||||||||
|
|
|
H |
|
NH+4 |
|
|
|
|
|
|
ОH |
|||||||||||||||
|
|
|
уксусный |
|
|
|
|
|
|
|
|
|
|
|
|
уксусная |
|
|
|||||||||
|
|
|
альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
|
|||||
|
|
|
– реакция со свежеосаженным Cu(OH)2↓ |
|
|
||||||||||||||||||||||
|
|
|
R–C |
O |
|
|
|
|
|
|
|
|
t° |
|
|
R–C |
|
O |
+ 2CuOH↓ + H2O |
||||||||
|
|
|
H |
+ 2Cu(OH)2↓ → |
|
|
ОH |
||||||||||||||||||||
|
|
|
|
|
|
|
|
синий |
|
|
|
|
|
|
|
|
|
|
|
жёлтый |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
t° |
|
|
Cu2O↓ + H2O |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
2CuOH → |
|
|
|
|
|
|
|
|
|
|||||||||||||||
2) |
реакция восстановления |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
R–C |
O |
+ Н |
|
|
t ° |
R–CН –ОН |
|
|
|
|
|
|||||||||||||
|
|
|
|
→ |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
2 |
|
Ni |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
спирт |
|
|
|
|
|
|
||||||
|
|
|
альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
O |
|
|
|
|
|
t ° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
СН |
3 |
–C |
|
|
+ Н |
2 |
|
→ |
|
СН |
–CН |
ОН |
|
|
||||||||||
|
|
|
|
|
|
H |
|
|
|
|
Ni |
|
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|||
|
|
|
этаналь |
|
|
|
|
|
|
|
|
|
|
|
|
этанол |
|
|
|
|
|
||||||
3) |
присоединение синильной кислоты |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
||||
|
|
|
R–C |
+ НCN → R–C |
|
|
–CN |
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОН |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
4) |
присоединение гидросульфита натрия |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
ОН |
|
|
|
|
|
|
|
||||
|
|
|
R–C |
+ НSO3Na → R–C |
|
–SO3Na |
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Формальдегид полимеризуется: |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
nН–C O → –CH –O–CH |
–O –… → (–CH |
–O–)n |
||||||||||||||||||||||
|
|
|
|
|
|
H |
|
|
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полиформальдегид |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Вступает в реакцию поликонденсации с фенолом с образованием фе- |
|||||||
нолоформальдегидной смолы: |
|
|
|
|
|||
|
OH |
|
OH |
|
|
|
OH |
+H |
H |
O |
H |
H |
O |
H |
H+ |
|
+ |
– |
+ |
+ |
– |
+ |
+ ..... |
|
C |
C |
|||||
|
|
H |
H |
|
H |
H |
|
|
OH |
|
OH |
OH |
|
|
|
..... |
СH2 |
СH2 |
|
..... |
+ nH2O |
|
|
