
- •Домашние задания по химии и методические указания по их выполнению для студентов дневной формы обучения
- •Содержание
- •Введение
- •Раздел 1. Основные классы неорганических соединений
- •Раздел 2. Газовые законы. Закон Авогадро и следствия из него. Уравнение Клапейрона-Менделеева. Моль. Молярный объём газов.
- •Примеры решения задач 71-82.
- •Раздел 3. Эквиваленты. Нахождение формул вещества. Стехиометрические расчеты.
- •Раздел 4. Строение атома и периодическая система д.И. Менделеева.
- •Раздел 5. Химическая связь и строение молекул
- •Относительная электроотрицательность атомов
- •Типовые задачи с решениями по разделу 5.
- •Раздел 6 Термохимия. Элементы химической термодинамики.
- •Раздел 7. Окислительно-восстановительные реакции.
- •Раздел 8 Скорость химической реакции. Химическое равновесие.
- •Примеры решения задач к разделу 8:
- •Раздел 9. Концентрации растворов. Коллигативные свойства растворов
- •Раздел 10. Растворы электролитов. Константа и степень диссоциации. Водородный показатель. Реакции ионного обмена. Произведение растворимости.
- •Типовые задачи с решениями по разделу 10:
- •Раздел 11. Гидролиз солей. Обменные реакции в растворах электролитов
- •Раздел 12. Электродные потенциалы. Химические источники электрической энергии.
- •Типовые задачи к разделу 12.
- •Раздел 13. Комплексные соединения.
- •Содержание
- •Литература
Примеры решения задач к разделу 8:
Пример 1. (задачи 421-430)
Константа равновесия гомогенной системы:
-
С
 О(г)
+ Н2О(г)
О(г)
+ Н2О(г)СО2(г) + Н2(г)
при некоторой температуре равна 1. Вычислить равновесные концентрации всех реагирующих веществ, если исходные концентрации (моль/л): [CO]исх = 0,1; [H2O]исх = 0,4.
![]()
Предположим, что к моменту равновесия образовалось Х моль/л СО2. Согласно уравнению реакции число молей образовавшегося водорода к моменту равновесия также будет Х моль/л. При этом расходуется Х моль/л СО и Х моль/л Н2О. Следовательно, равновесные концентрации всех четырех веществ будут следующие:
[CO2]равн = [H2]равн = х моль/л
[CO]равн = (0,1 – х ) моль/л
[H2О]равн = (0,4 – х) моль/л
Зная Кр, находим значение x, а затем исходные концентрации всех веществ:
![]()
x2 = 0,04 – 0,4x – 0,1x + x2
0,5x = 0,04
x = 0,08 моль/л
Искомые равновесные концентрации:
[CO2]равн = [H2]равн = 0,08 моль/л
[CO]равн = (0,1 – 0,08) = 0,02 моль/л
[H2О]равн = (0,4 – 0,08) = 0,32 моль/л
Пример 2. (задачи 431-440)
В какую сторону сместится равновесие реакции при уменьшении температуры, если энергии активации прямой и обратной реакций составляют Е1 и Е2 соответственно10 ккал/моль и 20000 кал/моль?
Поскольку,
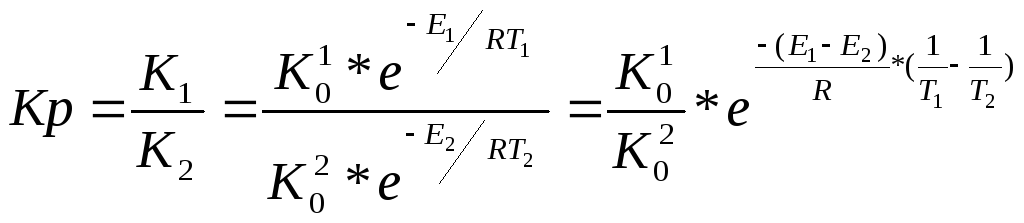
и
![]() ,
то
,
то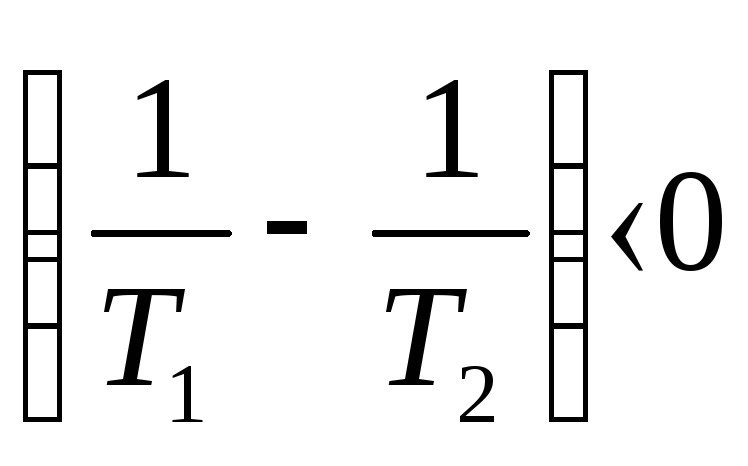
Е1 = 10 ккал/моль; Е2 = 20 ккал/моль;
(Е1
– Е2)
![]() 0;
0;![]() ;
;
![]() , где А – натуральное
число
, где А – натуральное
число
![]() 0.
0.
Т.е. Кр =
![]()
![]() 0, константа равновесия возрастает,
равновесие сместится вправо.
0, константа равновесия возрастает,
равновесие сместится вправо.
Пример 3. (задачи 441-450)
В какую сторону
сместится равновесие при увеличении
давления, если константа равновесия
выражается уравнением:
![]() , а значения a, b, c, d соответственно равны
2, 1, 0, 1?
, а значения a, b, c, d соответственно равны
2, 1, 0, 1?
Данному выражению
константы равновесия системы
![]() соответствует реакция 2А + В =D.
соответствует реакция 2А + В =D.
С увеличением давления равновесие смещается вправо
Раздел 9. Концентрации растворов. Коллигативные свойства растворов
Какую массу гидроксида натрия необходимо взять для приготовления 125 мл 0,15 М раствора?
Чему равна молярность раствора, содержащего в 0,75 л 4,41 г хлорида натрия?
К 300 г раствора гидроксида натрия с массовой долей NaOH 15% прибавим 300 г воды. Определить массовую долю гидроксида натрия в полученном растворе.
Чему равна молярная концентрация соляной кислоты, если массовая доля соляной кислоты равна 18% (плотность раствора 1,09 г/мл)?
Чему равна массовая доля серной кислоты в ее 10 н растворе (плотность раствора 1,29 г/мл)?
Смешали 800 мл 3 н КОН и 1,2 л 12% раствора гидроксида калия (плотность раствора 1,10 г/мл). Чему равна молярная концентрация полученного раствора гидроксида калия?
Сколько миллилитров фосфорной кислоты H3PO4 с массовой долей Н3РО4 49% и плотностью 1,33 г/мл потребуется для приготовления 2 л 0,1 н Н3РО4?
Вычислите молярность и нормальность фосфорной кислоты Н3РО4, если массовая доля Н3РО4 равна 40%. Плотность раствора 1,25 г/мл.
К 950 г воды прибавили 50 мл раствора Н2SO4 с массовой долей 48% (плотность 1,38 г/мл). Вычислите массовую долю H2SO4 в полученном растворе.
Определите нормальность 0,8 М сульфата железа (III), если плотность раствора равна 1 г/мл.
Титр раствора гидроксида бария равен 1,71 мг/мл. Какова молярная концентрация и эквивалентная концентрация данного раствора?
Какой объем 5 н раствора NaOH можно приготовить из 4 л раствора гидроксида натрия с массовой долей NaOH 50% (плотность раствора 1,525 г/мл)?
Чему равна молярность концентрированной соляной кислоты, имеющей плотность 1,19 г/мл и содержащей 38% по массе HCl.
Из 10 кг раствора с массовой долей растворенного вещества 20% при охлаждении выделилось 400 г соли. Чему равна массовая доля вещества в охлажденном растворе?
Титр раствора гидроксида бария равен 1,71мг/мл. Вычислить молярную и эквивалентную концентрации, и данного раствора?
Образец поташа содержит 85% К2СО3. Какую массу этого образца необходимо взять для приготовления 200 мл 0,5 н раствора карбоната калия?
На нейтрализацию 25 мл раствора соляной кислоты неизвестной концентрации израсходовано 24,4 мл 1 н гидроксида натрия. Вычислите титр соляной кислоты.
На нейтрализацию 40 мл раствора щелочи пошло 24 мл 0,5 н раствора серной кислоты. Какова эквивалентная концентрация щелочи? Сколько 0,5 н соляной кислоты потребовалось бы для той же цели?
Какой объем 0,2 н раствора гидроксида калия требуется, чтобы осадить в виде гидроксида железа (III) все железо, содержащееся в 0,028 л 1,4 н раствора хлорида железа (III)?
Смешали 0,7 л бензола С6Н6 и 0,8 л толуола С6Н5СН3. вычислите мольные доли каждого из веществ в полученном растворе. Плотности бензола и толуола соответственно равны 0,879 г/мл и 0,867 г/м3.
Какой объем 0,5 М сульфата алюминия требуется для реакции с 0,03 л 0,15 М раствора нитрата кальция?
Чему равен титр 0,02 н раствора ортофосфорной кислоты?
На нейтрализацию 25 мл хлороводородной кислоты неизвестной концентрации пошло 30 мл 0,1 н раствора NaOH. Вычислите молярную концентрацию и титр раствора хлороводородной кислоты.
Какой объем воды нужно прибавить к 500 мл раствора азотной кислоты с массовой долей HNO3 40% плотностью 1,25 г/см3 для получения раствора азотной кислоты с массовой долей 10%? Какова молярная концентрация полученного раствора?
На нейтрализацию 20 мл раствора серной кислоты израсходовано 25 мл 0,05 н раствора гидроксида натрия. Определите молярную концентрацию и титр раствора серной кислоты.
Вычислите осмотическое давление раствора при 17 0С, если 1 л его содержит 18,4 г глицерина С3Н5(ОН)3.
Осмотическое давление раствора неэлектролита при 0 0С равно 600мм.рт.ст. Чему равно осмотическое давление того же раствора при 27 0С?
Осмотическое давление раствора, содержащего 5 г гемоглобина на 100 мл раствора, при 27 0С равно 13,65 мм. рт. ст. Вычислите молярную массу гемоглобина.
Раствор сахара С12Н22О11 при 0 0С имеет осмотическое давление равное 114 мм.рт.ст. Сколько граммов сахара содержится в 1л такого раствора?
При какой температуре осмотическое давление раствора, содержащего 18,6 г анилина С6Н5NH2 в 3л раствора, достигнет 2,84 · 105 Па?
Какую массу метилового спирта СН3ОН должен содержать 1 л раствора, чтобы его осмотическое давление было таким же, как и раствора, содержащего в 1 л при той же температуре 9 г глюкозы С6Н12О6?
Раствор, содержащий 3,2 г СН3ОН в 1 л воды при 18 0С, изотоничен с раствором анилина С6Н5NH2. Какая масса анилина содержится в 1 л раствора?
Давление пара воды при 50 0С равно 12,334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды.
Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 100 0С равно 98775,3 Па.
Давление пара воды при 100 0С равно 1,0133 · 105 Па. Вычислите давление водяного пара, если массовая доля мочевины (NH2)2CO в растворе 10%.
Давление пара чистого ацетона (СН3)2СО при 20 0С равно 179,6 мм.рт.ст. Вычислите давление пара раствора 2,5 г камфоры С10Н16О в 100г ацетона при той же температуре.
Давление пара водного раствора глюкозы С6Н12О6 при 75 0С равно 250 мм.рт.ст. Вычислите массовую доля глюкозы в растворе, если давление насыщенного пара воды при 75 0С равно 289 мм.рт.ст.
Давление пара раствора эфира (С2Н5)2О при 30 0С равно 647,9 мм. рт. ст.; давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре равно 643,58 мм. рт. ст. Вычислите молярную массу анилина.
Вычислите температуру замерзания водного раствора спирта С2Н5ОН с массовой долей 40 %. Криоскопическая константа воды равна 1,860С.
Вычислите массу этиленгликоля С2Н4(ОН)2, которую необходимо прибавить на каждый килограмм воды для приготовления антифриза с точкой замерзания -150С.
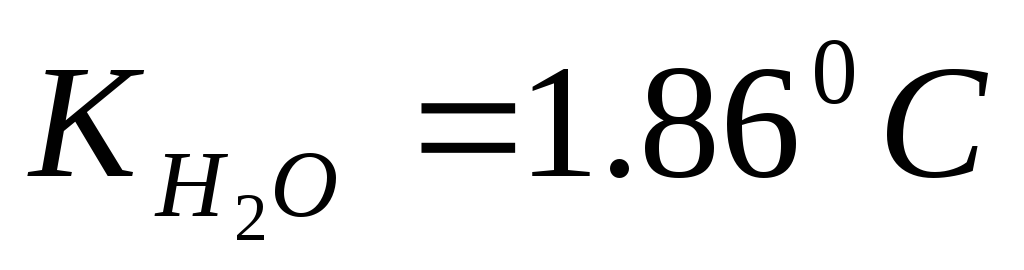 .
.Раствор 0,502 г ацетона (СН3)2СО в 100 г уксусной кислоты обнаруживает понижение точки замерзания на 0,339 0С. Вычислите криоскопическую константу уксусной кислоты.
Какова массовая доля водного раствора свекловичного сахара С12Н22О11, если этот раствор замерзает при -0,96 0С.
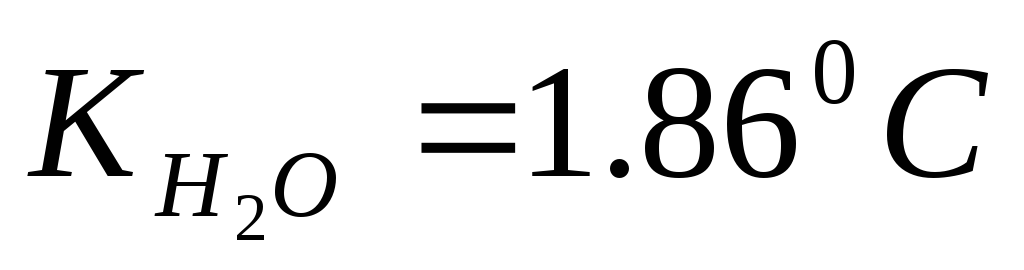 ?
?Какова температура замерзания раствора неэлектролита, содержащего 2,02 · 1023 молекул в 1 л воды? К
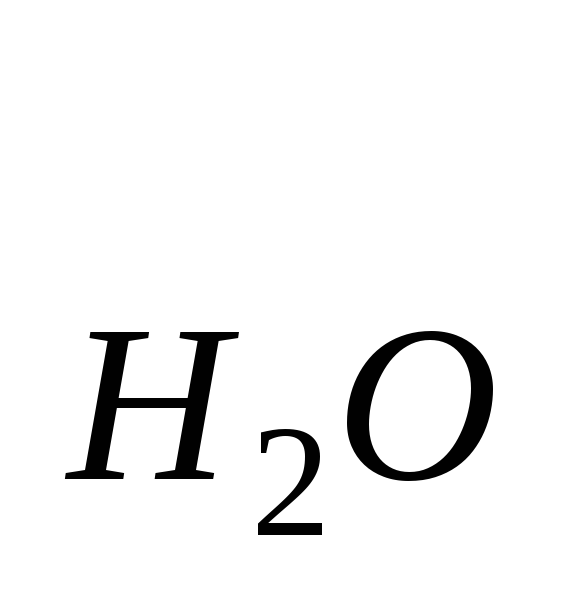 =
1,86 ºС.
=
1,86 ºС.
Учитывая, что температура кипения этилового спирта 78,3 0С и его эбуллиоскопическая константа 1,16 0С, определить, сколько атомов входит в состав молекулы йода, если раствор, состоящий из 6,57 г йода в 100г спирта, закипает при 78,6 0С.
Раствор, состоящий из 4,6 г глицерина С3Н5(ОН)3 и 200 г ацетона, кипит при 56,73 0С. Чистый ацетон закипает при 56,3 0С. Вычислите эбуллиоскопическую константу ацетона.
Вычислите повышение температуры кипения раствора, содержащего 0,244 г бензойной кислоты С7Н6О2 в 25 г хлороформа. Ехлороформа = 3,88 ºС
Вычислите понижение температуры замерзания раствора, содержащего 0,20 моль растворенного вещества в 800 г бензола. Кбензола = 5,12 ºС.
Сколько молей неэлектролита было растворено в 500 г воды, если температура кипения такого раствора равна 102,58 0С? Эбуллиоскопическая константа воды 0,52 0С
Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить раствор с температурой кипения 106 0С? Эбуллиоскопическая константа воды 0,52 0С.
При какой температуре будет кипеть раствор, содержащий 500 мл глицерина С3Н5(ОН)3 в 4 л воды? Плотность глицерина равна 1,26 г/см3, эбуллиоскопическая константа воды 0,52 0С.
