
- •Кафедра фізики в.В.Соловйов, л.П.Давиденко Конспект лекцій із фізики
- •Полтава 2004
- •Тема: елементи кінематики
- •Лекція іі тема: динаміка частинок план
- •Лекція ііі тема: закони збереження. Тверде тіло план
- •Повний імпульс ізольованої (замкненої) механічної системи не змінюється при будь-яких взаємодіях у ній.
- •Трохи про консервативні системи
- •Швидкість зміни момента імпульсу відносно нерухомої точки о дорівнює результуючому моменту сил усіх зовнішніх сил.
- •Лекція IV тема: механічні коливання
- •Лекція V тема: механічні хвилі
- •Лекція vі тема : елементи механiки суцiльних середовищ
- •Лекція VII тема: макроскопічний стан
- •Лекція viiі тема: статистичний розподіл. Явища переносу
- •Лекція IX тема: основи термодинаміки
- •Лекція X тема: тверді тіла та рідини
- •Лекція XI тема: електростатика план
- •Механізм взаємодії
- •Лекція хii тема: постійний струм план
- •Можна показати, що
- •Лекція хш тема: електричне поле в діелектриках план
- •Лекція х IV тема: магнітне поле план
- •Правило свердлика
- •Лекція XV
- •Тема: електромагнітна індукція.
- •Рівняння максвелла
- •Лекція XVI оптика тема: фотометрія. Інтерференція світла
- •Лекція XVII тема: дифракція
- •Лекція XVIII тема: електромагнітні хвилі в речовині
- •Лекція XIX квантова фізика тема: теплове випромінювання
- •Лекція хх тема: квантова природа світла
- •Лекція ххi тема: будова атома. Теорія бора
- •Лекція ххii тема: елементи квантової механіки
- •Лекція ххiii
- •Лекція ххiv тема: атомне ядро
Лекція X тема: тверді тіла та рідини
ПЛАН
1. Молекулярна будова рiдини. Поверхневий натяг.
2. Явище змочування. Формула Лапласа.
3. Капiлярнi явища. Формула Жюрена.
4. Твердi тiла та їх будова. Закон Дюлонга i Птi.
1. Розглянемо характер мiжмолекулярної взаємодiї у рiдинi.








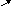









 Fp
Fp






 Fp.=
0
Fp.=
0



Рiвнодiюча всiх сил, які дiють на молекулу у серединi рiдини, дорiвнює 0. На молекулу в поверхневому шарi дiє рiвнодiюча сила, яка направлена у середину рiдини (оскільки ця молекула взаємодiє з бiльшою кiлькістю молекул у рiдинi та з меншою над поверхнею).
Тому при переходi молекул із глибини рiдини у поверхневий шар необхiдно витратити роботу проти сил, дiючих у поверхневому шарi.
Унаслiдок цього поверхневий шар рiдини буде мати додаткову енергiю при Т = const. В умовах рівноваги система завжди намагається мати найменшу потенціальну енергію, тому рідина буде приймати форму, відповідну мінімумові потенціальної енергії.
Сили, дiючi на поверхнi рiдини, якi прагнуть зменшити величину її поверхнi, називають силами поверхневого натягу.
Для
кiлькiсної оцiнки цих сил уводять поняття
коефіцієнта поверхневого натягу
![]() .
.
![]() це
величина, яка чисельно дорiвнює вiдношенню
роботи
це
величина, яка чисельно дорiвнює вiдношенню
роботи
![]() iзотермiчного утворення поверхнi рiдини
до площi цiєї поверхнi
iзотермiчного утворення поверхнi рiдини
до площi цiєї поверхнi
![]() .
.
![]() (1)
(1)
![]() чисельно
дорiвнює силi поверхневого натягу F, яка
припадає на одиницю граничної лiнiї на
поверхнi рiдини
чисельно
дорiвнює силi поверхневого натягу F, яка
припадає на одиницю граничної лiнiї на
поверхнi рiдини
![]() (2)
(2)
l довжина граничної лiнiї.
![]()
2. У випадкові контакту рiдини з твердим тiлом можуть простежуватися два наслiдки ефекту взаємодiї:
а) змочування;
б) незмочування.
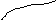 Hg
(ртуть)
Hg
(ртуть)






незмочування:
![]()


 Н2О
(вода)
Н2О
(вода)


повне
змочування:

Ефект
змочування або незмочування поверхнi
твердого тiла рiдиною приводить до
викривлення поверхнi рiдини , а будь-яка
викривлена поверхня чинить на рiдину
додатковий тиск
![]() порiвняно з таким у випадкові контакту
рiдини з плоскою
поверхнею.
порiвняно з таким у випадкові контакту
рiдини з плоскою
поверхнею.
Кiлькiсну
оцiнку величини
![]() дав
Лаплас :
дав
Лаплас :
![]() (3)
(3)
- формула Лапласа.
R1, R2 радiуси кривизни поверхнi у двох взаємно перпендикулярних перерiзах, проведених через одну й ту ж саму точку.
Для сферичної поверхнi R1 = R2:
![]()
3. Ефект змочування або незмочування визначає поведiнку рiдини у капiлярах:
змочування приводить до пiднiмання рiдини в капiлярi;
незмочування – до опускання.

















![]()























![]()















 Н2О
(вода) Hg
(ртуть)
Н2О
(вода) Hg
(ртуть)





















Змiна рiвня рiдини h у капiлярах визначається формулою Жюрена:
![]() (4)
(4)
![]() густина
рідини;
густина
рідини;
r радіус капіляра;
![]() коефіцієнт
поверхневого
натягу;
коефіцієнт
поверхневого
натягу;
![]() крайовий
кут змочування;
крайовий
кут змочування;
4. Визначальна особливiсть твердих тiл - наявнiсть кристалiчної решiтки, у вузлах якої частинки звершують тепловий (коливальний) рух.
Тверді тiла подiляються на:
а) монокристали,
б) полiкристали.
Монокристали це такі тверді тiла, для яких характерна єдина кристалiчна решiтка зі сталими кутами мiж гранями.
Полiкристали – це сукупнiсть великої кiлькостi хаотичноорiєнтованих малих кристалічних зерен.
Залежно вiд типу частинок у вузлах решiтки та характеру сил взаємодiї мiж цими частинками, кристали розподiляються на чотири основнi типи:
1) іоннi (KCl, NaCl),
2) aтомнi,
3) металеві,
4) молекулярнi.
Iоннi у вузлах решiтки є чергування позитивних та негативних iонiв.
Атомнi у вузлах кристалічної решiтки знаходяться нейтральнi атоми.
Металiчнi у вузлах знаходяться позитивнi iони, а в промiжках мiж вузлами iснує електронний газ.
Це дуже добрi провiдники електрики (Cu, Fe).
Молекулярнi у вузлах кристалічної решiтки знаходяться нейтральні молекули.
Коротко спинимось на теплоємностi твердих тiл.
Закон Дюлонга i Птi констатує:
Молярна теплоємнiсть усiх хімічних простих кристалiв дорiвнює 3R при високих температурах.
![]()
![]()

 Закон
Дюлонга і Пті
Закон
Дюлонга і Пті
Т3 (Дебая)

3








 R
R





~ 300 K
Т,К
