
- •Учебное пособие
- •Содержание
- •1. Физические основы механики
- •1.1. Основные формулы
- •1.2. Примеры решения задач к разделу «Механика»
- •1.3. Базовые задачи для самостоятельного решения
- •1.4. Контрольные вопросы
- •2. Основы молекулярной физики и термодинамики
- •2.1. Основные формулы
- •2.2. Примеры решения задач к разделу «Молекулярная физика и термодинамика»
- •2.3. Базовые задачи для самостоятельного решения
- •2.4. Контрольные вопросы
- •Библиографический список
- •Приложения
- •1. Основные физические постоянные (округленные значения)
- •2. Некоторые астрономические величины
2. Основы молекулярной физики и термодинамики
При изучении основ молекулярной физики и термодинамики следует уяснить следующее. Существует два способа описания процессов, происходящих в макроскопических телах (т.е. телах, состоящих из очень большого числа частиц - атомов или молекул), - статистический и термодинамический.
Статистическая (молекулярная) физика пользуется вероятностными методами и истолковывает свойства тел, непосредственно наблюдаемых на опыте (такие, как давление и температура), как суммарный, усредненный результат действия отдельных молекул. Молекулярно-кинетическая теория позволяет раскрыть глубинный смысл экспериментальных закономерностей, например, таких как уравнение Менделеева-Клапейрона. При решении задач на эту тему основное внимание уделено таким вопросам программы, как уравнение Менделеева-Клапейрона, закон Дальтона для смеси газов, уравнение молекулярно- кинетической теории (в контрольной работе это задачи.
Следует обратить внимание на статистические законы. Распределение молекул идеального газа по скоростям описывает распределение Максвелла, а в потенциальном поле энергии - распределение Больцмана. Зависимость давления от высоты для изотермической атмосферы описывается барометрической формулой.
При изучении явлений переноса, к которым относятся теплопроводность, диффузия и внутреннее трение, следует уяснить, что эти явления сходны между собой. В основе этого сходства лежит одинаковый молекулярный механизм перемешивания молекул в процессе их хаотического движения и столкновений друг с другом.
Важно усвоить, что термодинамика, в отличие от молекулярной физики, не изучает конкретные взаимодействия, происходящие с отдельными атомами или молекулами, а рассматривает взаимопревращения и связь различных видов энергии, теплоты и работы.
При изучении основ термодинамики нужно четко усвоить такие понятия как термодинамическая система, термодинамический процесс, внутренняя энергия, энтропия и т.д. Задачи контрольной работы охватывают такие важные соотношения и понятия как первое начало термодинамики, внутренняя энергия, работа при различных изопроцессах.
Второе начало термодинамики формулируется как закон возрастания энтропии. Этот закон определяет направление протекания термодинамических процессов.
2.1. Основные формулы
Количество вещества1тела (системы)
![]() ,
,
где N– число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему);
NA– постоянная Авогадро (NA= 6.021023моль-1).
Молярная масса вещества
![]() ,
,
где m– масса однородного тела (системы);
– количество вещества этого тела.
Количество вещества смеси газов
![]() ,
,
где i, mi, μi– соответственно количество вещества, масса, молярная массаi-го компонента смеси.
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
![]() ,
,
где m– масса газа;
μ– молярная масса газа;
R– универсальная газовая постоянная;
– количество вещества;
T– термодинамическая температура.
Основные газовые законы, являющиеся частными случаями уравнения Менделеева-Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс: T=const,m=const),PV=const,
или для двух состояний газа P1V1=P2V2;
б) закон Гей-Люссака
(изобарный процесс: P=const;m=const),![]() =const,
=const,
или для двух
состояний
![]() ;
;
в) закон Шарля
(изохорный процессе: V=const,m=const),![]() =const,
=const,
или для двух
состояний
![]() ;
;
г) объединенный газовый закон (m=const)
![]() =const,
или
=const,
или
![]() ,
,
где P1, V1, T1– давление, объем и температура газа в начальном состоянии;
P2, V2, T2– те же величины в конечном состоянии.
Концентрация молекул
![]() ,
,
где N – число молекул, содержащихся в данной системе;
– плотность вещества;
V – объем системы.
Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
Основное уравнение молекулярно-кинетической теории идеальных газов:
 ,
или
,
или
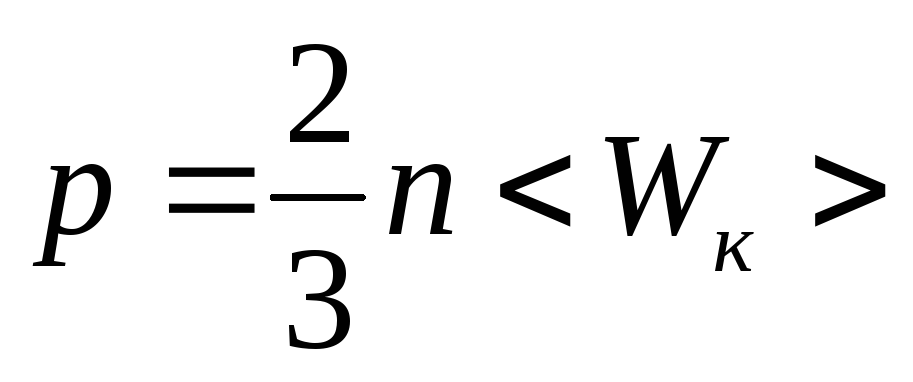 ,
илиp=nkT,
,
илиp=nkT,
где n– концентрация молекул;
k– постоянная
Больцмана (![]() );
);
mo– масса одной молекулы;
<![]() кв>
– средняя квадратичная скорость молекул;
кв>
– средняя квадратичная скорость молекул;
<Wк> – средняя кинетическая энергия поступательного движения молекулы газа.
Средняя кинетическая энергия молекулы газа:
![]()
где i- число степеней свободы молекулы. (i=iпост+iвращ)
Скорости молекул:
а)
![]() -
средняя арифметическая;
-
средняя арифметическая;
б)
![]() -
средняя квадратичная;
-
средняя квадратичная;
в)
![]() -
наиболее вероятная,
-
наиболее вероятная,
где mo– масса одной молекулы.
Среднее число соударений, испытываемых молекулой газа за 1 секунду:
![]() ,
,
где d– эффективный диаметр молекулы;
n– концентрация молекул;
<![]() >– средняя арифметическая скорость
молекул.
>– средняя арифметическая скорость
молекул.
Средняя длина свободного пробега молекул газа
 .
.
Закон диффузии (закон Фика):
![]()
где
![]() – коэффициент диффузии.
– коэффициент диффузии.
Закон теплопроводности (закон Фурье):
![]() .
.
Для
идеального газа
![]() ,
коэффициент теплопроводности,
,
коэффициент теплопроводности,
где cν– удельная теплоемкость газа при постоянном объеме,плотность газа.
Закон Ньютона для внутреннего трения (вязкости):
![]() ,
,
где F– сила внутреннего трения между движущимися слоями газа (жидкости) площадьюS;
![]() –градиент скорости;
–градиент скорости;
– коэффициент внутреннего трения (динамическая вязкость).
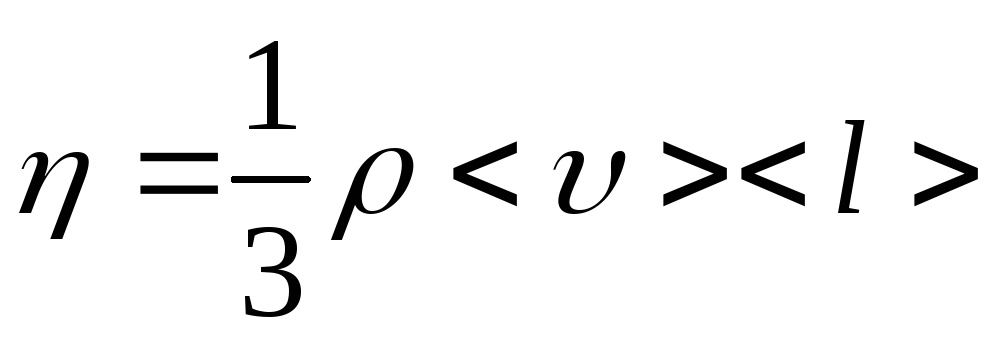 .
.
Коэффициенты переноса связаны между собой соотношениями:
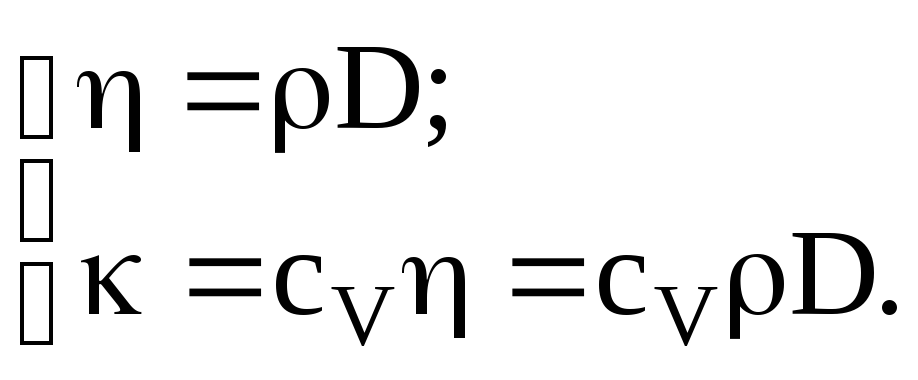
Молярные теплоемкости газа при постоянном объеме (CV) и постоянном давлении (CP):
![]() ,
,
![]() .
.
Связь между удельной cи молярной Cтеплоемкостями
![]() ,
,
![]() ;
;![]() ,
,![]() .
.
Уравнение Майера для молярных теплоемкостей газа
CP – CV = R .
Внутренняя энергия идеального газа
![]() ,
,
где CV– молярная теплоемкость газа при постоянном объеме.
Первое начало термодинамики
Q = U + A,
где Q– количество теплоты, сообщенное системе (газу) или отданное ею;
U– изменение внутренней энергии системы;
A– работа, совершенная системой против внешних сил.
Изменение внутренней энергии идеального газа:
![]() .
.
Полная работа при
изменении объема газа:
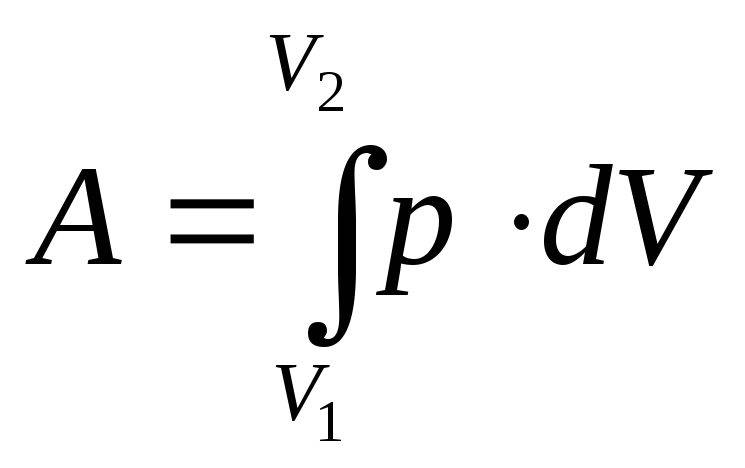 ,
,
где V1иV2– соответственно начальный и конечный объемы газа.
Работа газа:
а) в изобарном процессе
![]() ,
или
,
или
![]() ;
;
б) в изотермическом процессе
![]() ,
или
,
или
![]() ;
;
в) в адиабатическом процессе
![]() ,
или
,
или
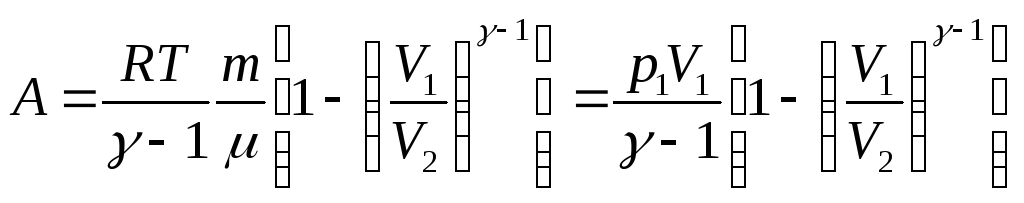 ,
,
где T1, T2и V1, V2– соответственно начальные и конечные температуры и объемы газа;
![]() –показатель
адиабаты.
–показатель
адиабаты.
Уравнение адиабатического процесса (уравнение Пуассона):
PVγ=const;TV-1=const;TP1-=const.
Термический КПД для кругового процесса (цикла)
![]() ,
,
где Q1 – количество теплоты, полученное системой от нагревателя;
Q2– количество теплоты, отданное системой холодильнику;
A– работа, совершаемая за цикл.
Термический КПД цикла Карно
![]() ,
,
где T1– температура нагревателя;
T2– температура холодильника.
Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2:
![]() .
.
