
- •Некоторые сведения из специальной теории относительности Эйнштейна.
- •Эффект Комптона.
- •Соотношение неопределенностей Гейзенберга.
- •Оценка с помощью соотношения неопределенностей основного состояния.
- •Волновая функция и её статистический смысл.
- •Частица в глубокой одномерной прямоугольной яме с бесконечно высокими стенками.
- •Потенциальная ступень.
- •Потенциальный барьер конечной ширины.
- •Линейный квантовый гармонический осциллятор.
- •Потенциал Морзе.
- •Уравнение Шредингера для жёсткого ротатора.
- •Двухатомная молекула как квантовый жёсткий ротатор. Вращательный спектр двухатомной молекулы.
- •Атом водорода по теории Бора.
- •Атом водорода в квантовой механике.
- •1Sсостояние электрона в атоме водорода.
- •Орбитальный момент импульса электрона. Орбитальный магнитный момент. Орбитальное гиромагнитное отношение.
- •Спин-орбитальное взаимодействие(сов).
- •Одноэлектронный атом. Сложение векторов момента импульса в квантовой механике. Полный момент импульса электрона в атоме. Внутренне квантовое число электрона.
- •Многоэлектронный атом. Виды связей в атоме. Полный механический момент атома. Атомные термы.
- •Магнитный момент атома. Фактор Ланде (g-фактор). Квантование магнитного момента атома. Магнитное квантовое число. Кратность вырождения. Снятие вырождения по магнитному квантовому числу.
- •Атом в магнитном поле. Сильные и слабые магнитные поля. Энергетические состояния в сильном и слабом магнитных полях.
- •Простой (нормальный) эффект Зеемана.
- •Квантовая статистика.
- •Статистика Бозе-Эйншиейна.
- •Статистика Ферми-Дирака.
- •Понятие о квантовой теории теплоёмкости.
Двухатомная молекула как квантовый жёсткий ротатор. Вращательный спектр двухатомной молекулы.
Если пренебречь изменением межъядерных расстояний, которое возникает при энергетических переходах, в качестве модели двухатомной молекулы можно принять жёсткий ротатор.
Зная, что Lγ=
Ћ![]()
Lz=mЋ
из аналогии:T=p2/2m=L2/2I
, где μ–приведённая масса двухатомной молекулы.
μd2-приведённый момент инерции двухатомной молекулы, тогда:
E= Ћ2·γ(γ+1)/2 μd2, у каждой молекулыЋ2/2 μd2=const
B= Ћ2/2 μd2(Дж)- имеет размерность энергии и называется вращательной постоянной. выражается в мЭв.
Для квантового числа существует правило отбора, т.е. ∆γ=±1 (всегда), поэтому энергетические переходы могут происходить только между соседними энергетическими уровнями.
Eγ=B·γ(γ+1)
Eγ+1,γ=E γ+1-E γ=B(γ+1)(γ+2)-Bγ(γ+1)=2B(γ+1), т.е. даже если на меньшем вращательном уровне получим разность 2В.
Спектр двухатомной молекулы как жёсткого ротатора.
Если есть переход с одного уровня на другой, то энергия фотона, поглощенного или испущенного двухатомной молекулой при изменении вращательной энергии выражается так:
E= Ћωизлуч.=∆Eγ+1,γ=2B(γ+1)
ωизлуч.=(2B/Ћ)(γ+1)
Спектральные линии чисто вращательного спектра поглощения и (или) излучения какого-либо химического соединения отстают друг от друга на 2В по шкале энергий. |2B|2B|2B|2B|2B|…
Излучать или поглощать электромагнитные волны( в инфракрасной части спектра) могут только молекулы типа, т.е. молекулы с отличным от нуля дипольным моментом.
Молекулы типа Н2,дипольный момент которых равен нуля излучать или поглощать электромагнитные волны не могут, и в этих молекулах энергетических энергетически далеко происходит безысключательно. И в этом случае энергии
При переходе квантовой энергии из одного энергетического состояния(например Е2) в другое энергетическое состояние (например Е1) излучается всегда фотон:
E2-E1=Ћωф
Вид спектра определяется:
1)энергетическим спектром системы;
2)правилом отбора;
3)вероятностью возможных переходов.
Атом водорода по теории Бора.
1913 г. Резерфорд в Кембридже установил, что каждый атом состоит из атома и электронной оболочки.
Постулаты Бора (постулаты стационарных состояний):
В атоме существуют не изменяющиеся во времени состояния, при которых атом не излучает и не поглощает энергию, в этом состоянии электрон, двигаясь по круговой орбите, имеет дискретные квантовые значения момента импульса, удовлетворяющие условию:
mvnrn=nЋ, гдеn=1,2,3,4,…
vn-скорость электрона наn-ой орбите
rn-радиусn-ой орбите
Второй постулат правило частот:
при переходе электрона с одной стационарной орбиты на другую излучается один фотон:
En-Em=Ћω
с энергией, равной разности энергий, соответствующих стационарным состояниям.
Набор значений ω
ω=( En-Em)/π
даёт линейчатый спектр атома водорода в соответствии с теорией Бора.
Электрон в атоме водорода и водородоподобных частицах, содержащих ядро и 1 электрон(это ионы) вращается(или будет вращаться) по орбите радиуса , если центростремительная сила, удерживающая электрон на орбите будет равна кулоновской силе.
Fкул=Fцентр
Ze2/4πε0rn2=m v2n/ rn (1)
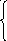 mvnrn=nЋ
(2)
mvnrn=nЋ
(2)
Если взять (1) и (2) и выразить неизвестные vn и rn:
rn=(4πε0Ћ²/Ze²m)·n² (3)
При z=1 иn=1 получаемr1=a=52,2 пм
подставив (3) найдём vn:
vn=Ze²/4πε0nЋ v≈106 м/с
U=eφ
Потенциальная энергия заряда, находящегося в некоторой точке электрического поля равна произведения этого заряда на потенциал поля в этой точке. Поле создаётся положительного заряда и на расстоянии от ядра.
Тогда потенциал поля в точке, где есть электрон, будет равен:
φe=Ze/4πε0rn, тогдаU=-Ze²/4πε0rn²
Потенциальная энергия электрона в поле ядра отрицательна, значит максимальное значение потенциальной энергии электрона будет равна нулю при r→∞
кинетическая энергия электрона на n-ой орбите:
T=mvn²/2=(m/2)·Z2e4/16π2ε02n2Ћ2
U= - Z2e4/16π2ε02n2Ћ2
Полная энергия электрона на орбите:
E=T+U=(m/2)·Z2e4/16π2ε02n2Ћ2-Z2e4/16π2ε02n2Ћ2 =-Z2e4m/32π2ε02n2Ћ2
(полная энергия отрицательна)
Знак “-” в полной энергии означает, что электрон в атоме находится в связанном состоянии. Из (*) следует, что энергетическое состояние атома водорода представляет собой последовательность уровней, изменяющихся в зависимости от квантового числа nи это целое числоn, определяющее энергетический уровень называется главным квантовым числом . Энергетическое состояние электрона сn>1 называется возбужденными состояниями приn=2 наблюдаем низшее возбужденное состояние
E1= -13,55 Эв, т.е. если мы приложим к электрону энергию 13,55 Эв, то он покинет поле ядра
E2= -3,38Эв (это всё приZ=1)
E3= -1,52Эв (у гелияZ=2, т.е. все энергии в 4 раза больше, у литияZ=3, т.е. все энергии в 9
E4= -0,83Эв раз больше).
E5= -0,54Эв
E6= -0,38Эв
Схема энергетических переходов в атоме водорода.
En= -Z2e4m/32π2ε02n2Ћ2
Для водорода:
E1= -13,6Эв
E2= -3,38ЭвE3= -1,5Эв
E4= -0,84Эв
E5= -0,53Эв
E6= -0,38Эв
E7≈ 0
Энергия атомов возрастает вместе со значением n(уменьшается отрицательная величина) энергетические уровни сближаются к границе, соответствующейn→∞ и атом водорода обладает минимальной энергиейE1= -13,6Эв и максимальной энергиейE∞=0 приn→∞. Это происходит(последний случай) при удалении электрона из атома, следовательно эта энергия соответствует ионизации атома. Если атому водорода, который находится в основном состоянии, сообщить энергию в +13,6Эв, то это и будет его энергии ионизации, когда электрон покинет атом. согласно второму постулату Бора пи переходе электрона с одной стационарной орбиты на другую излучается или поглощается 1 фотон, т.е. получаем:
Ћω=En2-En1= [Z2e4m/32π2ε02n2Ћ2](1/n12-1/n22)
2πЋc/λ=[Z2e4m/64π3ε02n2Ћ3c](1/n12-1/n22)
R=1,1·107 1/м –постоянная ридберга
1/λ=Z²R(1/n12-1/n22)-сериальная формула
Если атом возбуждается полностью, т.е. электрон ушёл и осталось ядро, у нас возбуждается полный спектр.
Кроме Лаймана все волны в инфракрасном спектре.
Согласно второму постулату Бора атом излучает свет при переходе электрона с одной орбиты на другую, расположенную ближе к ядру. Все линии спектра, получающиеся при переходе электрона на первую орбиту( со 2,3 и т.д.) представляют собой линии одной серии, отвечающие значению n1=1 и все эти линии принадлежат УФ части спектра.
При переходе на орбиту с n=2( с 3,4,5, и т.д. орбит) получаются линии серии Бальмера и это видимый свет во всём оптическом диапазоне.
Линии, приходящиеся на третий уровень( с 4,5,6 и т.д.) лежат в инфракрасной части спектра электромагнитных волн.
Спектр поглощения также является линей чатым, но он содержит всегда только серию Лаймана. Так как свободные атомы водорода обычно находятся в основном состоянии (n=1), то при сообщении этим атомам энергии извне могут наблюдаться только переходы из основного состояния в возбужденное и поэтому появляется только серия Лаймана.
Теория Бора позволила точно определить спектр атома водорода.
Теория Бора обладает внутренним противоречием, т.к. в ней использованы с одной стороны все законы классической физики, а с другой стороны начальные элементы квантовой физики, поэтому эта теория не могла ответить на вопрос: откуда берутся переходы и не смогла описать спектр атома гелия, т.е. простейшего атома, следующего сразу за водородом в таблице Менделеева.
