
- •Конспект лекцій з фізики
- •Конспект лекцій з фізики
- •Частина 2
- •Кінетична теорія газів
- •Рівняння стану ідеального газу
- •Основне рівняння молекулярно-кінетичної теорії ідеального газу
- •Розподіл молекул за швидкостями
- •Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •Фізичні основи термодинаміки
- •Внутрішня енергія системи
- •Робота при зміні об’єму
- •Ступені вільності
- •Принцип рівнорозподілу енергії за ступенями вільності
- •Теплоємність
- •Перший закон термодинаміки
- •Застосування першого закону термодинаміки до газових процесiв
- •Iзобаричний процес
- •Iзотермiчний процес
- •Iзохоричний процес
- •Адіабатний процес
- •Другий закон термодинаміки
- •Ентропія
- •Розрахунок зміни ентропії у процесах ідеального газу
- •Середня довжина вільного пробігу молекул газу
- •Явища переносу
- •Дифузія в газах
- •Внутрішнє тертя у газах
- •Теплопровідність газів
- •Реальні гази
- •Внутрішня енергія реального газу
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Завдання для самостійного контролю знань
- •1. 2. 3. 4.
- •1. Ізобаричного 2. Адіабатичного 3. Ізотермічного 4. Ізохоричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •Задачі для самостійного розв’язування
- •Рекомендована література
Ентропія
Із нерівності Клаузіуса випливає, що сума зведених кількостей теплоти, отриманих системою при оборотному переході з одного стану в інший, не залежить від шляху, за яким виконується перехід, а залежить тільки від початкового і кінцевого станів (рис.2.15):
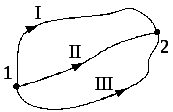
Рис. 2.15
 . (2.44)
. (2.44)
Звідси
випливає, що при оборотному переході
величина
![]() /T
є приростом деякої функції стану. Ця
функція позначається S
і називається
ентропією системи:
/T
є приростом деякої функції стану. Ця
функція позначається S
і називається
ентропією системи:
![]() . (2.45)
. (2.45)
Таким чином, ентропія – це функція стану системи, приріст якої при оборотному процесі дорівнює зведеній кількості теплоти, отриманої системою:
![]() , (2.46)
, (2.46)
де S1 – значення ентропії у початковому стані, S2 – у кінцевому.
Фізичний зміст ентропії випливає із статистичного визначення ентропії, яке вивів Больцман:
S = k lnW, (2.47)
де k – стала Больцмана; W – термодинамічна ймовірність системи, що характеризує кількість різних способів, якими може бути реалізований даний стан системи.
Властивості ентропії. З урахуванням необоротних процесів формула (2.44) переписується у вигляді нерівності
![]() , (2.48)
, (2.48)
де знак рівності береться для оборотних процесів, а нерівності – для необоротних. Для ізольованої системи
![]() =0
і d
S
0.
=0
і d
S
0.
З цього випливає, що: 1) ентропія ізольованої системи тільки збільшується, якщо процеси в ній необоротні (закон збільшення ентропії); 2) ентропія ізольованої системи залишається сталою, якщо процеси в ній оборотні (закон збереження ентропії).
Розрахунок зміни ентропії у процесах ідеального газу
Оскільки
![]() ,
,
![]() ,
то
,
то
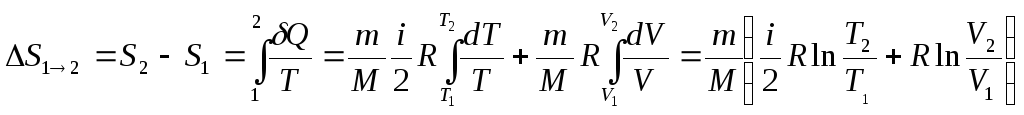 (2.49)
(2.49)
Зміна
ентропії ідеального газу при переході
із стану 1 у стан 2 не залежить від виду
процесу переходу 1![]() 2
.
2
.
При адіабатному процесі
![]() =0
і d
S
0.
(2.50)
=0
і d
S
0.
(2.50)
Для оборотного адіабатного процесу зміна ентропії дорівнює 0, для необоротного S2>S1 – ентропія тіла зростає. Оборотний адіабатний процес –ізоентропійний процес.
При ізотермічному процесі Т1=Т2 і
![]() ,
(2.51)
,
(2.51)
при ізохоричному процесі V1= V2 і
![]() .
(2.52)
.
(2.52)
Середня довжина вільного пробігу молекул газу
Мінімальна
відстань, на яку наближаються при
співударі центри двох молекул, називається
ефективним діаметром молекули ( рис.
2.16). Величина
![]() – ефективний переріз молекули. Ефективний
діаметр молекули зменшується із
зростанням температури, бо при цьому
зростають швидкості теплового руху
молекул газу. Середнє число зіткнень
молекули
за
одиницю часу
– ефективний переріз молекули. Ефективний
діаметр молекули зменшується із
зростанням температури, бо при цьому
зростають швидкості теплового руху
молекул газу. Середнє число зіткнень
молекули
за
одиницю часу
![]() ,
(2.53)
,
(2.53)
де
n-концентрація
молекул, <![]() >
-
середня арифметична швидкість,d
- ефективний діаметр молекули.
>
-
середня арифметична швидкість,d
- ефективний діаметр молекули.
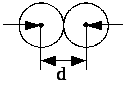
Рис.2.16
Середній шлях між двома послідовними співударами молекули називається середньою довжиною вільного пробігу < > і визначається за формулою
![]() . (2.54)
. (2.54)
Оскільки р= nkT , то
![]() .
.
При T=const кількість молекул в одиниці об’єму n p, то 1/p, тобто із зниженням тиску середня довжина вільного пробігу збільшується.
Явища переносу
Невпорядкованiсть теплового руху молекул газу, безперервнi зiткнення мiж ними приводять до постiйного перемiшувания частинок i змiни Iх швидкостей i енергiї.
Якщо в газi iснує просторова неоднорiднiсть густини, температури або швидкостi впорядкованого переміщення окремих шарiв газу, то рух молекул вирiвнює цi неоднорiдностi. При цьому в газi вiдбуваються особливi процеси, об’єднанi загальною назвою явищ переносу. До цих явищ належать дифузiя, теплопровiднiсть і внутрiшнє тертя.
