
- •Конспект лекцій з фізики
- •Конспект лекцій з фізики
- •Частина 2
- •Кінетична теорія газів
- •Рівняння стану ідеального газу
- •Основне рівняння молекулярно-кінетичної теорії ідеального газу
- •Розподіл молекул за швидкостями
- •Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •Фізичні основи термодинаміки
- •Внутрішня енергія системи
- •Робота при зміні об’єму
- •Ступені вільності
- •Принцип рівнорозподілу енергії за ступенями вільності
- •Теплоємність
- •Перший закон термодинаміки
- •Застосування першого закону термодинаміки до газових процесiв
- •Iзобаричний процес
- •Iзотермiчний процес
- •Iзохоричний процес
- •Адіабатний процес
- •Другий закон термодинаміки
- •Ентропія
- •Розрахунок зміни ентропії у процесах ідеального газу
- •Середня довжина вільного пробігу молекул газу
- •Явища переносу
- •Дифузія в газах
- •Внутрішнє тертя у газах
- •Теплопровідність газів
- •Реальні гази
- •Внутрішня енергія реального газу
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Завдання для самостійного контролю знань
- •1. 2. 3. 4.
- •1. Ізобаричного 2. Адіабатичного 3. Ізотермічного 4. Ізохоричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •Задачі для самостійного розв’язування
- •Рекомендована література
Iзотермiчний процес
Характеристика процесу: Т = соnst , dТ = О.
Робота газу. Щоб визначити роботу газу iнтегруванням виразу елементарної роботи, зведемо спочатку цей вираз до однiєї змiнної. Визначивши з рiвняння Клапейрона—Менделєєва Р i пiдставивши його значення у формулу для об-числення роботи, дiстанемо
![]() ,
,
проiнтегрувавши останнiй вираз, знайдемо
![]() (2.27)
(2.27)
![]() Замiсть
вiдношення об’ємiв у вираз (2.27) можна
пiдставити за законом Бойля—Марiотта
обернене до нього вiдношення тискiв.
Замiсть
вiдношення об’ємiв у вираз (2.27) можна
пiдставити за законом Бойля—Марiотта
обернене до нього вiдношення тискiв.
![]() (2.28)
(2.28)
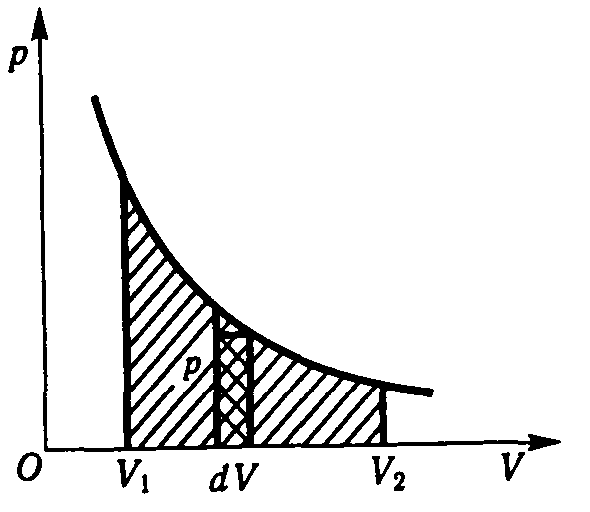
Рис.2.10
Графiчно на дiаграмi р,V (рис. 2.10) робота газу в iзотермiчному процесi дорiвнює площi фiгури, обмеженої графiком стану газу (iзотермою), вiссю об’ємiв та ординатами, що вiдповiдають початковому i кiнцевому тискам газу.
Кiлькiсть теплоти. Для iзотермiчного процесу dТ = 0; тому dU = 0, тобто внутрiшня енергiя iдеального газу в цьому процесi залишається сталою. Застосувавши до цього процесу перший закон термодинамiки, дiстанемо
![]() ,
Q
=А.
(2.29)
,
Q
=А.
(2.29)
Отже, в iзотермiчному процесi вся теплота, яку дiстає газ, витрачається на виконання роботи.
Молярна теплоємність при ізотермічному процесі
 (2.30)
(2.30)
Отже , поняття теплоємності при ізотермічному процесі не має сенсу.
Iзохоричний процес
Характеристика процесу: V =соnst , dV = 0.
Робота газу. Оскiльки для iзохоричного процесу dV = 0, елементарна робота газу дорiвнюс нулю:
![]() =0
=0
i робота газу для всього процесу дорiвнює нулю:
А =0. (2.31)
Кiлькiсть
теплоти.
Застосувавши вираз першого закону
термодинамiки до iзохоричного процесу
та врахувавши, що в цьому процесi
![]() ,
отримаємо
,
отримаємо
![]() (2.32)
(2.32)
Проiнтегрувавши цей вираз, знайдемо
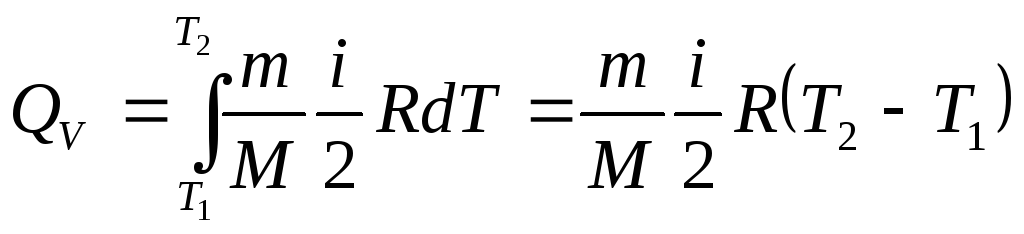 (2.33)
(2.33)
В ізохоричному процесі вся теплота, яку дістає газ, витрачається на збільшення його внутрішньої енергії; при цьому температура газу підвищується.
Молярна теплоємність при ізохоричному процесі
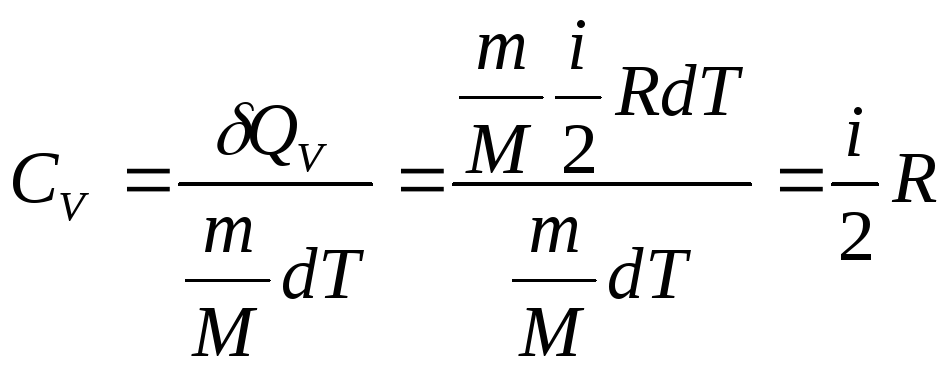 (2.34)
(2.34)
Адіабатний процес
Адіабатний
процес– це процес, який протікає без
теплообміну газу із зовнішнім середовищем
(тобто
![]() ).
Якщо покласти
).
Якщо покласти
![]() у рівнянні першого закону термодинаміки
у рівнянні першого закону термодинаміки
![]() , (2.35)
, (2.35)
то отримаємо рівняння адіабати ідеального газу:
pV =const, (2.36)
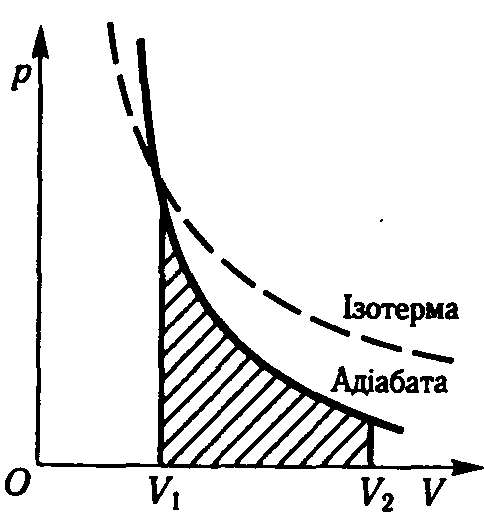
Рис.2.11
де = Cp / CV = (i+2)/i, – коефіцієнт адіабати, який визначається кількістю ступенів вільності i молекули. Формула (2.36) має назву рівняння Пуассона.
Графiчно на дiаграмi рV адiабатний процес зображується кривою, яка називається адiабатою (рис. 2.11). Тому рiвняння (2.36) iнакше називають рiвнянням адiабати. Порiвняно з iзотермою адiабата є гiперболою вищого порядку, вона крутiша вiд iзотерми.
Наведемо формули для обчислення роботи газу в адiабатному процесi.
За першим законом термодинамiки для адiабатичного процесу iдеального газу маємо
![]() .
(2.37)
.
(2.37)
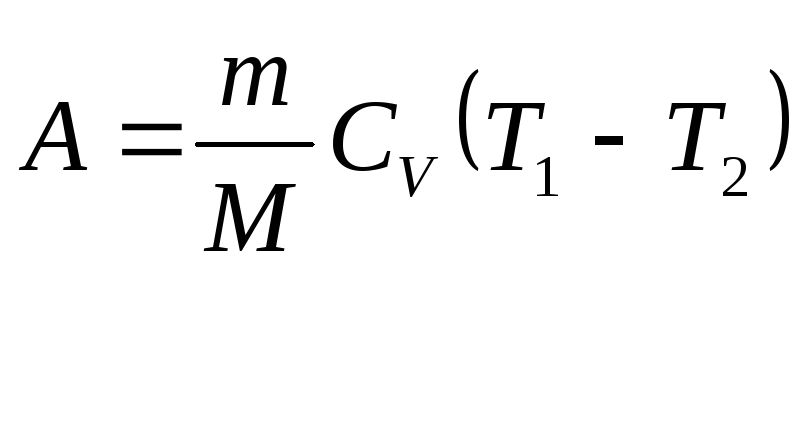 .
(2.38)
.
(2.38)
Якщо за рівнянням Клапейрона-Менделєєва визначити температуру і підставити її у вираз (2.38),то дістанемо
![]() .
(2.39)
.
(2.39)
Графiчно робота газу в адiабатному процесi визначається площею так само, як i в iнших процесах ( рис. 2.11).
