
- •Конспект лекцій з фізики
- •Конспект лекцій з фізики
- •Частина 2
- •Кінетична теорія газів
- •Рівняння стану ідеального газу
- •Основне рівняння молекулярно-кінетичної теорії ідеального газу
- •Розподіл молекул за швидкостями
- •Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •Фізичні основи термодинаміки
- •Внутрішня енергія системи
- •Робота при зміні об’єму
- •Ступені вільності
- •Принцип рівнорозподілу енергії за ступенями вільності
- •Теплоємність
- •Перший закон термодинаміки
- •Застосування першого закону термодинаміки до газових процесiв
- •Iзобаричний процес
- •Iзотермiчний процес
- •Iзохоричний процес
- •Адіабатний процес
- •Другий закон термодинаміки
- •Ентропія
- •Розрахунок зміни ентропії у процесах ідеального газу
- •Середня довжина вільного пробігу молекул газу
- •Явища переносу
- •Дифузія в газах
- •Внутрішнє тертя у газах
- •Теплопровідність газів
- •Реальні гази
- •Внутрішня енергія реального газу
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Завдання для самостійного контролю знань
- •1. 2. 3. 4.
- •1. Ізобаричного 2. Адіабатичного 3. Ізотермічного 4. Ізохоричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •Задачі для самостійного розв’язування
- •Рекомендована література
Робота при зміні об’єму
Газ знаходиться в циліндричній посудині з поршнем (рис. 2.5). Якщо газ, розширюючись , переміщує поршень на нескінченно малу відстань dl , то він виконує над ним роботу
![]() ,
(2.13)
,
(2.13)
де S- площа поршня, Sdl=dV- зміна об’єму газу. Повну роботу А, яка виконана газом при зміні його об’єму від V1 до V2 , знайдемо інтегруванням:
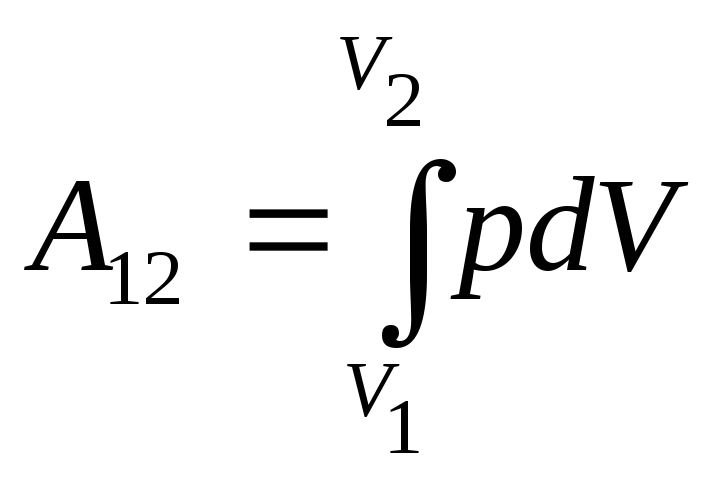 (2.14)
(2.14)

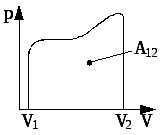
Рис. 2.5 Рис. 2.6
Тобто, щоб визначити роботу системи при зміні об’єму, потрібно тиск проінтегрувати за об’ємом від початкового V1 до кінцевого V2 значень.
На координатній площині ( p, V ) робота дорівнює площі криволінійної трапеції, яка зверху обмежена графіком залежності p = f (V ), знизу – віссю V, ліворуч і праворуч прямими V = V1 і V =V2 (рис. 2.6).
Величина роботи залежить не тільки від початкового і кінцевого станів,а й від того , яким є термодинамічний процес. Якщо процес відбувається по замкненій кривій і газ повернувся до початкового стану , то повна робота , виконана газом, не дорівнює нулю.
Кількість теплоти. Під кількістю теплоти розуміють лише ту частину енергії, яка передається у процесі теплообміну і яка не може визначати ні теплової, ні внутрішньої енергії тіла в цілому. Робота і теплота тісно пов’язані між собою і мають ту спільну властивість , що вони існують лише в процесі передавання енергії, а їх числові значення залежать від виду цього процесу.
Ступені вільності
Числом ступенів вільності системи називають найменшу кількість незалежних координат, що визначають положення системи у просторі. Наприклад , положення матеріальної точки у просторі повністю визначається трьома координатами: x,y,z у декартовій системі та r, , -у сферичній (рис. 2.7).
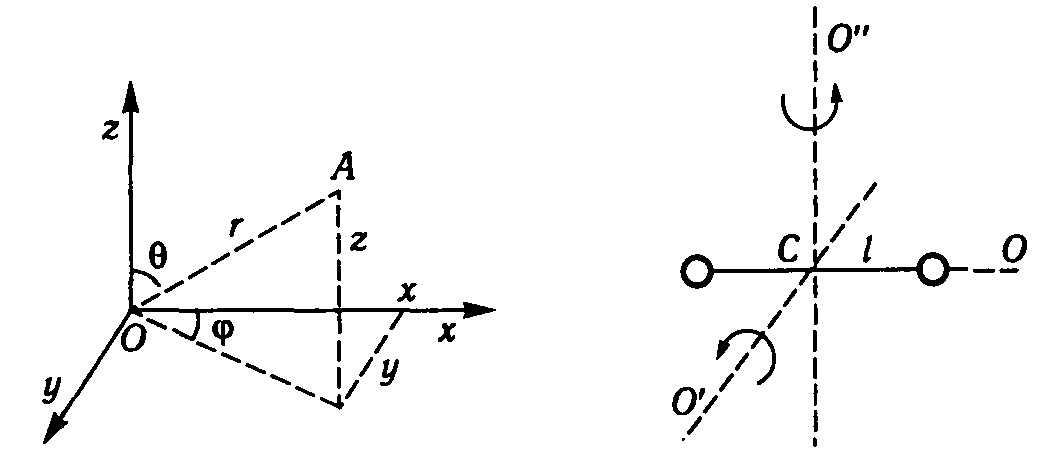
Рис. 2.7 Рис. 2.8
Ступені вільності двох жорстко зв’язаних точок зводяться до трьох поступальних рухів центра мас С системи і двох обертальних рухів навколо взаємно перпендикулярних осей СО та СО´ , нормальних до l (рис. 2.8).
Визначаючи ступені вільності молекул газу , атом слід розглядати як матеріальну точку. Молекули можна вважати системою жорстко зв’язаних матеріальних точок – атомів. Тому одноатомна молекула газу має три ступені вільності поступального руху , двохатомна - п’ять, три ступені вільності поступальні , та дві – обертальні , багатоатомна – шість ступенів вільності: три поступальні і три обертальні.
Принцип рівнорозподілу енергії за ступенями вільності
Ні один з видів руху молекули не має переваги перед іншими, тому на будь-яку ступінь вільності молекули у середньому припадає однакова енергія:
![]() . (2.15)
. (2.15)
Тоді середня енергія теплового руху молекул:
![]() , (2.16)
, (2.16)
де i = nпост + nоб + 2nкол , (2.17)
nпост – кількість поступальних ступенів вільності; nоб – обертальних, nкол – коливальних (коливальні ступені вільності мають вдвічі більшу енергоємність, ніж поступальні й обертальні, і тому у формулу (2.17) вони входять подвійно). При невисоких температурах коливальні ступені вільності не збуджені і число ступенів вільності дорівнює: i = 3– для одноатомних молекул; i = 5 – для двохатомних молекул; i = 6 – для трьох (і вище) атомних молекул.
