
- •Конспект лекцій з фізики
- •Конспект лекцій з фізики
- •Частина 2
- •Кінетична теорія газів
- •Рівняння стану ідеального газу
- •Основне рівняння молекулярно-кінетичної теорії ідеального газу
- •Розподіл молекул за швидкостями
- •Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •Фізичні основи термодинаміки
- •Внутрішня енергія системи
- •Робота при зміні об’єму
- •Ступені вільності
- •Принцип рівнорозподілу енергії за ступенями вільності
- •Теплоємність
- •Перший закон термодинаміки
- •Застосування першого закону термодинаміки до газових процесiв
- •Iзобаричний процес
- •Iзотермiчний процес
- •Iзохоричний процес
- •Адіабатний процес
- •Другий закон термодинаміки
- •Ентропія
- •Розрахунок зміни ентропії у процесах ідеального газу
- •Середня довжина вільного пробігу молекул газу
- •Явища переносу
- •Дифузія в газах
- •Внутрішнє тертя у газах
- •Теплопровідність газів
- •Реальні гази
- •Внутрішня енергія реального газу
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Розв’язання
- •Завдання для самостійного контролю знань
- •1. 2. 3. 4.
- •1. Ізобаричного 2. Адіабатичного 3. Ізотермічного 4. Ізохоричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •1. Ізотермічного 2. Адіабатичного 3. Ізохоричного 4. Ізобаричного
- •Задачі для самостійного розв’язування
- •Рекомендована література
Кінетична теорія газів
У молекулярно – кінетичній теорії користуються моделлю ідеального газу, що задовільняє таким умовам :
1) власний об’єм молекул нехтовно малий порівняно з об’ємом посудини;
2) між молекулами газу відсутні сили взаємодії;
3) зіткнення молекул газу між собою і з стінками посудини абсолютно пружні.
Рівняння стану ідеального газу
Рівняння стану ідеального газу називають рівнянням Клапейрона-Менделєєва. У розрахунку на 1 моль ідеального газу рівняння Клапейрона –Менделєєва записують так:
PV=RT, ( 2.1)
а для будь-якої маси m–так:
PV=![]() RT,
(2.2)
RT,
(2.2)
де М-маса , яку має моль газу,
Р - тиск газу,
V - об’єм газу,
Т - температура газу,
R-універсальна
газова стала,
R=8,
31![]() .
.
Основне рівняння молекулярно-кінетичної теорії ідеального газу
Тиск газу на стінки посудини обумовлений співударами молекул зі стінками і передачею їм імпульсу. При цьому виникає тиск газу на стінки, який дорівнює
![]() , (2.3)
, (2.3)
де n
– кількість молекул в одиниці об’єму,
m0
–маса однієї молекули,<![]() кв>
- середня
квадратична
швидкість,
кв>
- середня
квадратична
швидкість,
![]() .
(2.4)
.
(2.4)
Рівняння (2.3) називають основним рівнянням МКТ ідеального газу. Перепишемо рівняння (2.3) у вигляді:
![]() ,
,
де
![]() -
середня кінетична енергія поступального
руху однієї молекули газу,
-
середня кінетична енергія поступального
руху однієї молекули газу,
![]() =
=![]() .
.
Оскільки
![]() ,то
,то
![]() =
=![]() ,
,
де Т-абсолютна температура, к-стала Больцмана, к=1,38*10-23Дж/моль*К.
Отже, середня кінетична енергія поступального руху молекул ідеального газу залежить тільки від його абсолютної температури. Абсолютна температура є міра середньої кінетичної енергії поступального руху молекул.
Розподіл молекул за швидкостями
Молекули газу рухаються з різними швидкостями. При цьому величини і напрямки швидкостей кожної молекули безперервно змінюються через зіткнення. Можливі значення швидкості молекул лежать у межах від 0 до ∞. Дуже великі і дуже малі порівняно з середніми швидкості мало ймовірні.
Розподіл молекул газу за швидкостями визначається функцією розподілу Максвелла, яка має вигляд:
![]() . (2.5)
. (2.5)
(тут
m
– маса молекули,
![]() – її швидкість,А
– стала, яка залежить від m
та T ).
– її швидкість,А
– стала, яка залежить від m
та T ).
![]() (2.6)
(2.6)
Функція
розподілу f (![]() )
визначає густину ймовірності, тобто
ймовірність того, що швидкість молекул
лежить у заданому одиничному інтервалі
швидкостей. Тодіf (
)
визначає густину ймовірності, тобто
ймовірність того, що швидкість молекул
лежить у заданому одиничному інтервалі
швидкостей. Тодіf (![]() )d
)d![]() визначає
ймовірність того, що швидкість молекул
лежить в інтервалі швидкостей від
визначає
ймовірність того, що швидкість молекул
лежить в інтервалі швидкостей від![]() до
до![]() +d
+d![]() . Одночасноf (
. Одночасноf (![]() )d
)d![]() визначає відносну кількість молекул
визначає відносну кількість молекул![]() ,
швидкості яких лежать в інтервалі
швидкості від
,
швидкості яких лежать в інтервалі
швидкості від![]() до
до![]() +d
+d![]() ,
чисельно дорівнює площі заштрихованої
ді-
,
чисельно дорівнює площі заштрихованої
ді-
лянки dS на рис.2.1.

Рис.2.1
Вся площа, обмежена кривою розподілу і віссю абсцис , чисельно дорівнює числу молекул, швидкості яких мають різні значення від 0 до ∞ . Оскільки цій умові задовільняють всі n молекул , то площа дорівнює одиниці:
![]() (2.7)
(2.7)
Швидкість,
що відповідає максимуму функції
розподілу f (![]() ),
називається найбільш ймовірною швидкістю
(див. рис. 2.1)
),
називається найбільш ймовірною швидкістю
(див. рис. 2.1)
![]() , де
m0
– маса молекули, k
–
стала Больцмана, T
– абсолютна температура. Знаючи розподіл
молекул за швидкостями, можна визначити
середнє значення швидкості молекул
газу:
, де
m0
– маса молекули, k
–
стала Больцмана, T
– абсолютна температура. Знаючи розподіл
молекул за швидкостями, можна визначити
середнє значення швидкості молекул
газу:
![]() . (2.8)
. (2.8)
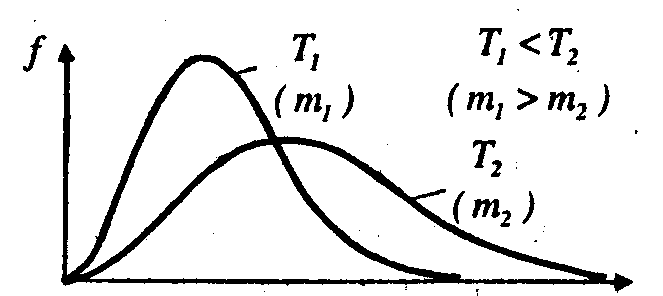
При
збільшенні температури (або зменшенні
маси молекул ) максимум кривої
f (![]() )
зміщується у бік більших швидкостей ,
а його абсолютна величина зменшується,
причому площа ,яка охоплена кривоюf (
)
зміщується у бік більших швидкостей ,
а його абсолютна величина зменшується,
причому площа ,яка охоплена кривоюf (![]() )
і віссю
)
і віссю![]() ,
залишається незмінною(рис.2.2).
,
залишається незмінною(рис.2.2).
![]()
Рис.2.2
Функція (2.5) розподілу молекул газу за швидкостями одночасно є і функцією розподілу молекул газу за кінетичними енергіями:
![]() , (2.9)
, (2.9)
де k– кінетична енергія молекул, А – стала, що залежить від m та T .
