
10. ЕлектроліТична дисоціація
Мета вивчення теми:
- навчитися складати рівняння дисоціації сильних і слабких електролітів у водних розчинах;
- давати порівняльну характеристику сили електролітів за допомогою ступеня дисоціації і константи дисоціації Кд;
- складати вирази констант дисоціації слабких електролітів;
- складати рівняння реакцій обміну між електролітами у молекулярному і іонному вигляді;
- виконувати розрахунки концентрацій іонів в розчинах електролітів; уявних ступенів дисоціації сильних електролітів на основі експериментальних даних (тиску насиченої пари над розчином, температури кипіння і замерзання розчину); ступенів дисоціації слабких електролітів за їх константою дисоціації;
- використовуючи поняття добутку розчинності, розраховувати можливість утворення осаду і розчинність малорозчинних електролітів.
Речовини, розчини або розплави яких проводять електричний струм, називають електролітами. Характеристикою сили електролітів є ступінь електролітичної дисоціації , яка показує долю молекул, що розпались на заряджені частинки – іони. Залежно від величини електроліти умовно поділяють на сильні (0,3 при с=0,1 моль/л), слабкі (0,03) та середньої сили. Із відомих вам кислот сильними електролітами є HCI, H2SO4, HNO3, слабкими – H2CO3, H2SO3, H2S, HCN, H2SiO3, CH3COOН, HNO2, H3PO4 та інші. Зверніть увагу, що H2О – дуже слабкий електроліт. Сильними електролітами серед основ є ті, що утворені лужними і лужноземельними металами. До слабких відносяться розчинна основа гідроксид амонію NH4OH і всі нерозчинні (Fe(OH)2, Fe(OH)3 і т.д.).
Усі солі, навіть погано розчинні, є сильними електролітами.
Сильні електроліти в розчинах дисоційовані практично повністю і необоротно, а слабкі електроліти дисоціюють частково і оборотно. Це слід враховувати при складанні рівнянь дисоціації. Наприклад:
H2SO4 2Н++SO42- (сильний електроліт);
H2SO3Н+ + НSO3(слабкий електроліт)
НSO3 Н+ +SO32 .
НSO3- це залишок слабкогоелектроліту, який в свою чергу є ще більш слабким електролітом.Отже, в розчині слабкого електроліту встановлюється одна або декілька іонних рівноваг, кількісною мірою яких є константи дисоціації Кд – константа рівноваги процесу дисоціації.
Наприклад, константа дисоціації сірчистої кислоти за першим ступенем має вигляд:
![]()
а за другим ступенем:
![]()
Чим менша Кд, тим слабкіший електроліт. За стадіями, тобто ступінчато, дисоціюють такі речовини:
а) Слабкі багатоосновні кислоти, наприклад:
Н2СО3 Н+ + НСО3
НСО3 Н+ + СО32
Напишіть
вирази для
![]() і знайдіть у довіднику їх значення.
Запамятайте,
що дисоціація за кожним наступним
ступенем протікає слабкіше чим за
попереднім.
і знайдіть у довіднику їх значення.
Запамятайте,
що дисоціація за кожним наступним
ступенем протікає слабкіше чим за
попереднім.
б) Слабкі багатокислотні основи, наприклад:
Fe(OH)2 FeOH+ + OH
FeOH+ Fe2+ + OH-
Напишіть
вирази для
![]() .
.
в) Основні солі, утворені слабкими основами, наприклад:
CuOHCI CuOH+ + CI-
CuOH+ Сu2+ + OH
г) Кислі солі, утворені слабкими кислотами, наприклад:
KHS K+ + HS
HS Н+ + S2
У випадках в) і г) дисоціація за першим ступенем протікає практично необоротно, і рівновага дисоціації визначається величиною Кд для другої стадії.
Іонні рівноваги, які встановлюються в розчинах слабких електролітів, можна, згідно з принципом Ле Шательє, зміщувати, додаючи розчин сильного електроліту, який містить однойменний іон:

NH4OH NH4+ + OH (слабкий електроліт)
NH4CI NH4++CI (сильний електроліт, який
містить однойменний іон NH4+)
Внаслідок додавання NH4CI в розчині збільшується концентрація NH4+. При збільшенні концентрації продуктів рівновага зміщується ліворуч (стрілка над рівнянням показує напрямок зміщення рівноваги), в бік недисоційованих молекул NH4ОН.
Суть реакцій, які відбуваються в розчинах електролітів, відбивають молекулярно-іонні рівняння. Для їх складання треба памятати наступні правила:
а) у виді іонів записуються сильні електроліти (із солей тільки розчинні);
б) у виді молекул записуються слабкі електроліти, осади (малорозчинні і нерозчинні речовини) і гази.
Наприклад: 2HNO3+ Mg(OH)2 Mg(NO3)2 + 2H2O,
HNO3 і Mg(NO3)2 – сильні електроліти, тому при складанні молекулярно-іонного рівняння записуємо їх у виді іонів, Mg(OH)2 і Н2О – слабкі електроліти, залишаємо їх в молекулярному вигляді:
2H++ 2NO3 + Mg(OH)2 Mg2+ + 2NO3 + 2H2O
2H+ + Mg(OH)2 Mg2+ + 2H2O
Зі скороченого іонного рівняння видно, що нітрат-іони NO3 не приймають участі у реакції. Ця реакція гетерогенна, реагують малорозчинна речовина Mg(OH)2і іони Н+ у розчині.
Приклад1. Складіть декілька молекулярних рівнянь, які відповідають молекулярно-іонному:
Ba2+ + SO42- BaSO4
Розв’язання. При складанні молекулярного рівняння Ba2+потрібно взяти у вигляді розчинної речовини, яка є сильним електролітом, це може бути основа чи сіль. Аналогічна вимога для SO42-, але це вже може бути кислота або сіль.
Ba(NO3)2+H2SO4 BaSO4 + 2HNO3
BaCI2 +Na2SO4 BaSO4 + 2NaCI
Ba(OH)2 +K2SO4 BaSO4 + 2KOH і т.д.
Покажіть, що задача розвязана вірно, склавши молекулярно-іонне рівняння для кожного з написаних трьох молекулярних.
Концентрацію іонів в розчині можна обчислити за формулою:
см(іон) = см(розчин)n,
де см(іон) і см(розчин) – молярні концентрації іона і розчину відповідно; - ступінь дисоціації; n – число іонів даного виду, що утворюються при дисоціації однієї молекули електроліту.
Приклад 2. Розрахуйте концентрацію катіонів і аніонів в 0,01М розчині сульфату заліза(III) Fe2(SO4)3, якщо ступінь дисоціації солі 80%.
Розв’язання .Складаємо рівняння дисоціації цієї солі:
Fe2(SO4)3 2Fe3+ + 3SO42-
Розраховуємо концентрацію іонів Fe3+( = 0,8;n = 2):
cм(Fe3+) = 0,010,82 =1,610-2моль/л.
Розраховуємо концентрацію іонів SO42-( = 0,8;n = 3):
cм(SO42-) = 0,01 0,8 3 = 2,410-2моль/л.
Кількість частинок (іонів і молекул) в розчині електроліту завжди більше кількості розчинених молекул.
Число, яке показує, у скільки разів збільшується кількість частинок в розчині електроліту (внаслідок дисоціації) в порівнянні з кількістю розчинених молекул, називається ізотонічним коефіцієнтом і:
![]() .
.
Оскільки такі експериментальні властивості розчинів електролітів, як Р, Tк, Tз пропорційні загальній кількості частинок у розчині (дивись розд.9), то значення цих властивостей для електролітів більше в і раз ніж для розчинів неелектролітів тієї ж концентрації:
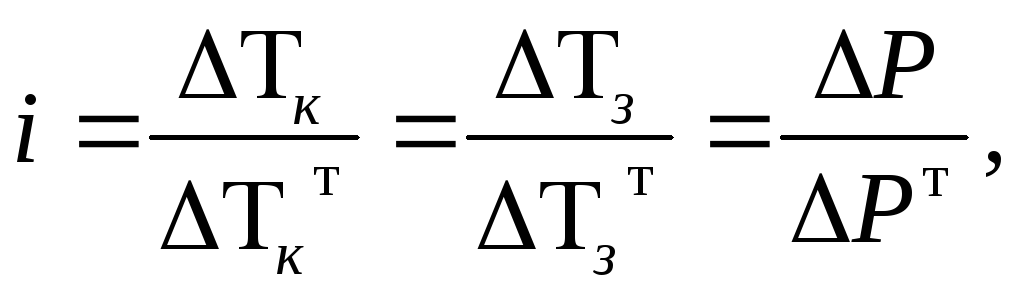
де верхній індекс "т" позначає теоретичне значення для розчину неелектроліту тієї ж концентрації.
Один із методів визначення – через ізотонічний коефіцієнт за формулою:
![]()
де n – кількість іонів, на які розпадається одна молекула електроліту.
Приклад 3. Розчин, який містить 16,2 г FeCI3в 930 г води, кристалізується при –0,68 0С. Визначте ступінь дисоціації цієї солі.
Розв’язання. FeCI3 – це сіль, вона є електролітом. Спочатку знайдемо для її розчину теоретичну величину Tзт, що можна очікувати для розчину неелектроліту тієї ж моляльної концентрації:
T зт = Ккр сm = Kк m2 / (M2m1),
де Кк – кріоскопічна константа Н2О, Kк = 1,86 (градкг)/моль,
сm – моляльна концентрація розчину, m2 – маса розчиненої речовини (FeCI3), M2 – молярна маса розчиненої речовини, m1- – маса розчинника в кг. Розраховуємо:
Tз т = 1,8616,2/(162,50,93) = 0,20 0С
Знаходимо значення ізотонічного коефіцієнту і:
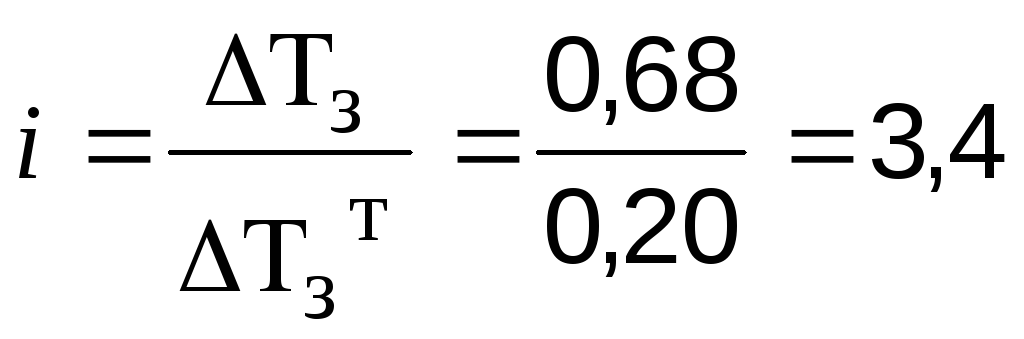
З рівняння дисоціації хлориду заліза (III) видно, що кожна молекула солі розпадається начотириіони:
FeCI3 Fe3+ + 3CI
За формулою розраховуємо значення ступеня дисоціації:
![]() або
80%.
або
80%.
У розчині слабкого бінарного електроліту ступінь дисоціації можна розраховувати за формулою закону розбавлення Оствальда:
![]()

=
Кд
/см
![]()
Приклад 4. Розрахуйте молярну концентрацію іонів водню і молекул, які не продисоціювали, у 0,01М розчині азотистої кислоти HNO2.
Розв’язання.Азотиста кислота – слабкий електроліт і дисоціює оборотно:
HNO2 H+ + NO2.
З рівняння видно, що з однієї молекули кислоти при дисоціації утворюється один іон водню, n = 1. Із довідника знаходимо значення константи дисоціації: Кд = 410-4.
Розраховуємо ступінь дисоціації:
![]()
 =(410-4)/(110-2)
= 0,2 .
=(410-4)/(110-2)
= 0,2 .
Знаходимо молярну концентрацію іонів водню у розчині:
см(Н+) =110-2 моль/л 0,2 1 = 210-3 моль/л.
Розраховуємо молярну концентрацію молекул кислоти, які не продисоціювали, за формулою:
см(HNO2) = cм(розчин)(1-) = 110-1(1-0,2) = 810-2 моль/л.
Для характеристики малорозчинних електролітів використовується величина, яка називається добутком розчинності (ДР).
Добуток розчинності є константою рівноваги для дисоціації малорозчинної речовини. ДР дорівнює добутку концентрацій іонів малорозчинної речовини у її насиченому розчині у ступенях, що дорівнюють коефіцієнтам в рівнянні дисоціації.
Так, для сульфату срібла: Ag2SO4(к) 2Ag+(р) + SO42-(р)
ДР = [Ag+]2 [SO42-] = 210-5.
Чим менший ДР, тим менша розчинність речовини. Останню можна обчислити за значенням ДР.
Приклад 5. Добуток розчинності йодиду свинцю(II)при 200С дорівнює 8 10-9. Розрахуйте розчинність солі (в моль/л і в г/л) при вказаній температурі.
Розв’язання.Запишемо рівняння дисоціації цієї солі у водному розчині:
PbI2(т) Pb2+ + 2I
1 моль 1 моль 2 моль
З рівняння видно, що при розчиненні кожного моля PbI2 в розчин переходять 1 моль іонів Pb2+ і 2 моль іонів I. Позначимо розчинність цієї солі через х, тоді у насиченому розчині PbI2 містяться х моль/л іонів Pb2+ і 2х моль/л іонів I. Отже: ДР = [Pb2+] [I]2 = x(2x)2 = 4x3, звідки:
![]() .
.
Щоб розрахувати розчинність цієї солі в г/л, потрібно помножити цю молярну концентрацію на молярну масу солі М(PbI2) = 461 г/моль:
х =1,2610-3моль/л461 г/моль = 0,58 г/л.
Добуток розчинності дуже зручно використовувати для визначення умов розчинності або навпаки випадання осаду малорозчинних речовин. Умова випадання осаду така:добуток реальних концентрацій іонів у розчині повинен бути більшим за значення ДР.
Приклад 6. До 50 мл 0,001н розчину НCIдодано 450 мл 0,0001н розчинуAgNO3. Чи випаде в осад хлорид срібла в цих умовах? ДР(AgCI) = 1,810-10. Ступені дисоціації НCIіAgNO3прийняти рівними 100%.
Розв’язання. Умовою випадання осаду в даному разі є [Ag+][CI] 1,810-10. Далі послідовно розраховуємо концентрації іонів у розчині. Маса НCIв 50 млвихідного 0,001н розчину:
m(НCI) = c(1/1НCI) M(1/1НCI) V(л) =
=110-3моль/л 36,5 г/моль 0,05 л = 1,82510-3 г .
Сумарний обєм розчину після зливання вихідних розчинів:
V = 50 + 450 = 500 мл = 0,5 л.
Молярна концентрація НCI після зливання розчинів:
![]() Концентрація
іонів CI
в отриманому після зливання розчині:
Концентрація
іонів CI
в отриманому після зливання розчині:
с(CI) = 110-4моль/л 1 1 = 110-4 моль/л.
МасаAgNO3в 450 мл вихідного 0,0001н розчину:
m(AgNO3) = c(1/1 AgNO3) M(1/1 AgNO3) V(л) =
= 110-4 моль/л 170 г/моль 0,45л = 7,6510-3 г
Молярна концентрація AgNO3після зливання розчинів:
![]() Концентрація
іонів срібла після зливання розчинів:
Концентрація
іонів срібла після зливання розчинів:
с(Ag+) = 0,910-4моль/л11 = 0,910-4моль/л.
Розрахуємо фактичний добуток концентрацій іонів у новому розчині: [Ag+][CI] = 0,910-4 110-4 = 0,910-8
Порівнюємо одержане числове значення с ДР:
[Ag+][CI]1,81010.
Таким чином, в заданих умовах AgCIвипадаєвосад.
ДОМАШНЄ ЗАВДАННЯ
1. Вкажіть, які з перелічених нижче речовин відносяться до
сильних і які до слабких електролітів: HCN, Sr(OH)2, K2SO4, H2SiO3, Mg(OH)2, HNO3, CH3COOH, KOH, NH4OH, NaF, H2S.
2. Напишіть рівняння дисоціації наступних електролітів: HNO3, H2S, Ba(OH)2, Zn(OH)2, Fe(OH)2NO3, NaHSO4.
3. Складіть у молекулярному і молекулярно-іонному виді рівняння реакцій між: а) гідроксидом цинку і соляною кислотою; б) гідрокарбонатом калію і гідроксидом калію;
в) гідроксохлоридом міді(II) і соляною кислотою.
4. На основі кожного з наведених нижче молекулярно-іонних рівнянь складіть по два молекулярних:
ZnS + 2H+ Zn2+ + H2S, AI(OH)2+ + H+ AIOH2+ + H2O,
PbS + 2OH Pb(OH)2 + S2-, H2PO4 + OH HPO42- + H2O.
5. Розрахуйте концентрації катіонів і аніонів в 0,1М розчині подвійної солі NH4Fe(SO4)2, якщо ступінь дисоціації цієї солі 70 %. Відповідь: с(NH4+)=0,07моль/л;
с(Fe3+)=0,07моль/л; с(SO42-)=0,14моль/л.
6.Розрахуйте молярні концентрації іонів Н+ і недисоційованих молекул Н2SO3в 0,02М розчині сірчистої кислоти. Дисоціацією кислоти за другим ступенем знехтуйте.
Відповідь: 1,7310-2 моль/л; 2,110-3 моль/л.
7. У насиченому розчині йодиду свинцю(II) встановилася рівновага: PbI2(т) (Pb2++ 2I)розчин . Яка речовина випаде в осад при додаванні йодиду калію КI? Як буде впливати на розчинність малорозчинного електроліту додавання в насичений розчин малорозчинної солі сильного електроліту, який містить однойменний іон?
8. Розчин, який містить 11,1 г СaCI2в310 г води, кристалізується при -1,680С. Визначте уявну ступінь дисоціації солі. Відповідь: = 90 %.
9. Розчинність СаСО3 при 35 0С дорівнює 6,910-5 моль/л. Розрахуйте добуток розчинності цієї солі при вказаній
температурі. Відповідь: ДР(СаСО3) = 4,810-9.
10. Розрахуйте, чи буде утворюватися осад малорозчинного хромату кальцію СаCrО4 (ДР = 7,1104) при зливанні рівних обємів 0,1М розчинів CaCI2 і K2CrO4.
Відповідь: осад випаде.
