
Serov_ch_1 / !poz049
.pdf
31
h = 2αρgRcosθ
где θ - краевой угол ( θ = 0 при полном смачивании стенок трубки жидкостью; θ = π при полном несмачивании); R - радиус канала трубки; ρ - плотность жидкости; g -
ускорение свободного падения.
Высота подъема жидкости между двумя близкими и параллельными друг другу
плоскостями |
h = |
2αcosθ |
|
ρgd |
|||
|
|
где d - расстояние между плоскостями.
Изменение энтропии при переходе из состояния 1 в состояние 2
2 dQ S2 − S1 = ∫1 T .
Примеры решения задач
Пример 1. Определить для серной кислоты: 1) относительную молекулярную массу Mr , 2) молярную массу М.
Решение. 1. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, атомы которых входят в состав молекулы данного вещества, и определяется по формуле
Mr = ∑ni Ar,i , |
( 1) |
где ni - число атомов i −го элемента, |
входящих в молекулу; Ar ,i - относительная |
атомная масса i -го элемента. |
|
Химическая формула серной кислоты имеет вид H2 SO4 . Так как в состав молекулы
серной кислоты входят атомы трех элементов, то стоящая в правой части равенства
(1) сумма будет состоять из трех слагаемых и эта формула примет вид :
Mr = n1 Ar ,1 + n2 Ar ,2 + n3 Ar ,3 . |
(2) |
Из формулы серной кислоты далее следует, что n1 = 2 |
(два атома водорода), n2 = 1 |
(один атом серы) и n3 = 4 (четыре атома кислорода).
Значения относительных атомных масс водорода, серы и кислорода найдем в таблице Д. И. Менделеева или в табл. 9 Приложения:
A r,1 =1, |
A r,2 =32, |
A r,3 =16. |
Подставив значения ni и |
Ar ,i в формулу (2), |
найдем относительную молекулярную |
массу серной кислоты: |
Mr = 2 1 +1 32 + 4 16 = 98 . |
|
|
||
2. Зная относительную молекулярную массу |
Mr , найдем молярную массу серной |
|
кислоты по формуле: |
M = Mr k |
(3) |
где k = 10−3 кг/моль. Подставив в (3) значения величин, получим M = 98 10−3 кг/моль.
Пример 2. В сосуде объемом 2 м3 находится смесь 4 кг гелия и 2 кг водорода при температуре 27 °С. Определить давление и молярную массу смеси газов.
32
Дано: V = 2м3 , m1 = 4 кг, M1 = 4 10−3 кг/моль, m2 = 2 кг, M2 = 2 10−3 кг/моль, T = 300 К. Найти: Р; М.
Решение. Воспользуемся уравнением Клапейрона — Менделеева, применив его к гелию и водороду:
P1V = m1RT / M1 |
(1) |
p2V = m2 RT / M 2 |
(2) |
где p1 — парциальное давление гелия; m1 — масса гелия;
M1 — его молярная масса; V — объем сосуда; Т — температура газа;
R = 8,31 Дж/(моль К) — молярная газовая постоянная; p2 — парциальное давление водорода; m2 — масса водорода; М2 — его молярная масса. Под парциальным давлением p1 и p2 понимается то давление, которое производил бы газ, если бы он
только один находился в сосуде. По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси:
|
|
p = p1 + p2 |
|
|
|
|
|
|
|
(3) |
|||
Из уравнения (1) и (2) выразим p1 и p2 и подставим в уравнение (3). Имеем |
|||||||||||||
|
m1RT |
|
m2 RT |
|
m1 |
|
m2 |
|
RT |
(4) |
|||
p = |
+ |
= |
+ |
|
|||||||||
M V |
M V |
|
|
V |
|||||||||
|
|
|
M |
1 |
|
M |
2 |
|
|
||||
1 |
2 |
|
|
|
|
|
|
|
|||||
Молярную массу смеси газов найдем по формуле
|
|
|
|
|
|
|
|
|
|
|
|
M = |
m1 + m2 |
|
|
|
|
|
(5) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v + v |
2 |
|
|
|
|
|
|
|
||
где ν1 и ν2 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|||||
|
— число молей гелия и водорода соответственно. Число молей газов |
|||||||||||||||||||||||
определим по формулам: |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
ν1 |
= m1 / M1 ; |
|
|
|
|
|
|
(6) |
|||||
|
|
|
|
|
|
|
|
|
|
|
ν2 |
= m2 / M 2 . |
|
|
|
|
|
|
(7) |
|||||
Подставляя (6) и (7) в (5), найдем |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
M = |
|
m1 + m2 |
|
|
|
|
(8) |
||||||
|
|
|
|
|
|
|
|
|
|
|
m / M |
1 |
+ m |
2 |
/ M |
2 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
||||
Подставляя числовые значения в формулы (4) и (8), получаем |
||||||||||||||||||||||||
|
4 |
|
|
|
|
|
2 |
|
8,31 300 |
|
|
|
|
|
|
|
6 |
Па = 2,493МПа. |
||||||
p = |
|
|
|
+ |
|
|
|
|
|
|
|
= 2,493 |
10 |
|
||||||||||
4 10-3 |
2 10−3 |
|
2 |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
М = |
4 |
|
|
+ 2 |
|
|
|
= 3 10−3 кг/ моль |
|
|
|
|
|
|||||||||||
|
4 |
|
|
+ |
|
2 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
4 10−3 |
|
2 |
10−3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Ответ: р= 2,493 МПа, М = 3 10-3 кг/моль. |
||||||||||||||||||||||||
Пример 3. Определить число |
|
N молекул, содержащихся в объеме V = 1мм3 воды, и |
||||||||||||||||||||||
массу m1 молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекул.
Решение. Число N молекул, содержащихся в некоторой системе массой m, равно произведению постоянной Авогадро N A на количество вещества ν:

33
Так как ν = m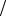 M , где M - молярная масса, то N = mNMA . Выразив в этой формуле
M , где M - молярная масса, то N = mNMA . Выразив в этой формуле
массу как произведение плотности на объем V, получим
N = ρV N A 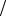 M .
M .
Произведем вычисления, учитывая, что M = 18 10−3 кг/моль (см. табл. 9 Приложения для H2O):
N = |
103 |
10−9 |
6,02 1023 молекул = 3,34 1019 молекул. |
|||||||||
|
18 |
10−3 |
|
|||||||||
|
|
|
|
|
|
|
||||||
Массу m1 одной молекулы можно найти по формуле |
|
|||||||||||
|
m1 = M N A . |
|
|
|
(1) |
|||||||
Подставив в (1) значения M и N A |
|
найдем массу молекулы воды: |
||||||||||
|
|
|
m |
= |
|
18 |
|
10−3 |
кг = 2,99 10−26 |
кг. |
||
|
|
|
6,02 |
1023 |
||||||||
|
|
|
1 |
|
|
|
|
|||||
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на
каждую молекулу приходится объем (кубическая ячейка) |
V = d 3 |
, где d - диаметр |
|||
|
|
|
|
1 |
|
молекулы. Отсюда |
d = 3 |
|
(2) |
|
|
V |
|
|
|||
|
1 |
|
|
|
|
Объем V1 найдем, разделив молярный объем Vm на число молекул в моле, т. е. на N A :
|
V1 =Vm N A |
|
|
|
(3) |
||||
Подставим выражение (3) в (2): |
|
|
|
|
|||||
d = 3 |
|
|
|
. |
|
|
|
|
|
V |
N |
A |
|
|
|
|
|||
|
m |
|
|
|
|
|
|
|
|
где V = M ρ. Тогда |
|
|
d = 3 |
|
|
|
. |
(4) |
|
|
|
M (ρN |
A |
) |
|||||
m |
|
|
|
|
|
|
|
||
Проверим, дает ли правая часть выражения (4) единицу длины:
|
[M ] |
|
13 |
|
|
|
1кг моль |
|
13 |
||||
|
|
|
|
|
= 1м · |
||||||||
|
[ |
|
][ |
A ] |
|
|
|
|
|
||||
|
ρ |
|
N |
|
|
= 1кг моль 1моль-1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
||||
Произведем вычисления: |
|
|
|
|
|
|
|
|
|
|
|
||
d = |
3 |
|
18 10 |
−3 |
м = 3,11 10-10 м = 311пм . |
||||||||
103 |
6,02 |
1023 |
|||||||||||
|
|
|
|
|
|
|
|||||||
Пример 4. В баллоне объемом 10 л находится гелий под давлением p1 =1МПа и при температуре T1 =300 К. После того как из баллона было взято m =10г гелия, температура в баллоне понизилась до T2 =290К. Определить давление p2 гелия,
оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева - Клапейрона , применив его к конечному состоянию газа:
p V = |
m2 |
RT . |
(1) |
|
|||
2 |
M |
2 |
|
|
|
|
где m2 - масса гелия в баллоне в конечном состоянии; М - молярная масса гелия; R - молярная газовая постоянная. Из уравнения (1) выразим искомое давление:
p2 = m2 R T2 ( MV ) . |
(2) |
Массу m2 гелия выразим через массу m1 , соответствующую начальному состоянию, и массу т гелия, взятого из баллона:

34
|
|
|
|
|
|
m2 |
= m1 − m . |
(3) |
|||||||
Массу m1 |
гелия найдем также из уравнения Менделеева - Клапейрона, применив его к |
||||||||||||||
начальному состоянию: |
m1 = Mp1 V (RT1 ) . |
(4) |
|||||||||||||
|
|
|
|
|
|
||||||||||
Подставив выражение массы m1 |
в (3), а затем выражение m2 в (2), найдем |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
RT2 |
|
|
|||
|
p |
2 |
= |
Mp1V |
|
− m |
|
, |
|
||||||
|
|
|
|
|
|
||||||||||
|
|
|
RT |
|
|
|
|
|
MV |
|
|||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
или |
p |
2 |
= |
T2 |
p − |
m |
|
RT2 |
· |
(5) |
|||||
|
|
|
|||||||||||||
|
|
|
T1 |
1 |
|
M V |
|
||||||||
|
|
|
|
|
|
|
|||||||||
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых ( T2 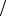 T1 ) - безразмерный, а второй - давление.
T1 ) - безразмерный, а второй - давление.
Проверим второе слагаемое:
[m][R][T ] |
= |
|
1кг |
1Дж/(моль К) 1К |
= |
1кг 1моль |
× |
|
1Дж 1К |
= |
1Дж |
= |
|||||
[M ][V ] |
|
|
|
|
|
|
|
|
|
|
|||||||
1кг/моль |
|
1м3 |
|
1кг |
|
1м3 1моль 1К |
|
1м3 |
|||||||||
= |
1Н м |
|
= 1Па |
|
|
|
|
|
|
|
|
|
|
|
|
||
1м3 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Паскаль является единицей давления. Произведем вычисления по формуле (5), учитывая, что M = 4 10−3 кг/моль (см. табл. 9 Приложения для He):
|
|
290 |
|
|
|
10 |
−2 |
|
8,31 |
|
|
|
|
Па = 0,364МПа. |
|||
p2 |
|
|
6 |
|
|
|
|
|
|
10 |
5 |
||||||
= |
|
10 |
|
− |
|
|
|
|
|
|
|
290 |
Па = 3,64 |
|
|||
300 |
|
4 10 |
−3 |
10 |
−2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Пример 5. Баллон содержит m1 =80 г кислорода и m2 = 320 г аргона. Давление смеси p = 1 МПа, температура T =З00 К. Принимая данные газы за идеальные, определить
объем V баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева - Клапейрона,
парциальные давления |
p1 |
|
|
кислорода |
и |
|
p2 |
|
|
аргона |
|
выражаются формулами |
||||||||||||||
p1 = m1RT (M1V ), |
|
p2 = m2 RT (M2V ), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Следовательно, по закону Дальтона, давление смеси газов |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 |
|
|
|
m2 |
|
RT |
, |
|
||
|
|
p = p1 + p2 , |
или p = |
|
+ |
|
|
|
||||||||||||||||||
|
|
|
M1 |
|
|
|
V |
|
||||||||||||||||||
откуда объем баллона |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
M2 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m1 |
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) |
||||||
V = |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
M1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
M2 |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Произведем вычисления, учитывая, |
что |
M1 |
= 32 10−3 |
кг/моль, M2 = 40 10−3 кг/моль |
||||||||||||||||||||||
(см. табл. 9 Приложения для O2 и Ar) : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
0,08 |
|
|
|
|
0,32 |
|
8,31 300 |
|
3 |
|
|
|
|
|
|
3 |
= 26,2 л. |
||||||||
V = |
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
м |
|
= 0,0262 м |
|
|||||||
32 |
10−3 |
|
|
|
|
|
|
106 |
|
|
|
|
||||||||||||||
|
|
|
|
40 10−3 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||

35
Пример 6. Найти среднюю кинетическую энергию εвр вращательного движения одной молекулы кислорода при температуре T =350К, а также кинетическую энергию Eк вращательного движения всех молекул кислорода массой m=4 г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия  ε1 = 12 kT
ε1 = 12 kT
где k - постоянная Больцмана, T - термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода - двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
|
|
|
|
|
|
|
|
εВР |
= 2 1 kT . |
(1) |
|
|||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
Кинетическая энергия вращательного движения всех молекул газа |
|
|||||||||||||
|
Eк = εВР N . |
(2) |
|
|||||||||||
Число всех молекул газа |
|
|
|
N = NAν , |
(3) |
|
||||||||
где NA - постоянная Авогадро; ν- количество вещества. |
|
|||||||||||||
Если учесть, что количество вещества ν = m/M, где m - масса газа, |
M - |
|||||||||||||
молярная масса газа, то формула (3) примет вид |
|
|
||||||||||||
|
|
|
|
|
N |
|
|
= NA |
m |
, |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
M |
|
|
||
Подставив выражение N в формулу (2), получаем |
|
|||||||||||||
Eк = N A m εВР |
M . |
(4) |
|
|||||||||||
Произведем вычисления, учитывая, что для кислорода (O2) M = 32 10−3 |
кг/моль |
|||||||||||||
(см. табл. 9 Приложения): |
|
|
|
|
|
|
|
|
|
|||||
εВР = kT =1,38 10−23 350 Дж = 4,83 10−21 Дж; |
|
|||||||||||||
Eк |
= 6,02 |
1023 |
4 10−3 |
4,83 10−21 |
Дж = 364 Дж. |
|
||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
32 10−3 |
|
|
||
Пример 7. Вычислить удельные теплоемкости при постоянном объеме cv |
и при |
|||||||||||||
постоянном давлении cp неона и водорода, принимая эти газы за идеальные. |
|
|||||||||||||
Решение. Удельные теплоемкости идеальных газов выражаются формулами |
|
|||||||||||||
c |
= |
|
i |
|
R |
|
|
, |
|
|
|
|
(1) |
|
|
|
|
|
|
|
|
|
|||||||
v |
|
|
2 M |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
cp |
= |
i + 2 |
|
R |
, |
|
|
|
(2) |
|
||||
|
|
|
|
|
|
|||||||||
|
2 |
|
|
M |
|
|
|
|
|
|||||
где i - число степеней свободы молекулы газа, М - молярная масса. Для неона (одноатомный газ) i =3 и кг/моль (см. табл. 9 Приложения). Произведем вычисления:
c |
|
= |
3 |
|
|
|
8,31 |
Дж (кг К) = 6,24 102 Дж (кг К) ; |
||||
|
|
|
|
|
|
|||||||
v |
|
2 |
|
20 10−3 |
|
|
||||||
|
|
|
|
|
|
|||||||
cp |
= |
3 + 2 |
|
8,31 |
|
Дж (кг К) = 1,04 103 Дж (кг К) . |
||||||
|
|
20 10−3 |
||||||||||
|
|
|
2 |
|
|
|
|
|||||
Для водорода (двухатомный газ) i |
=5 и М= 2 10−3 кг/моль. Тогда |
|||||||||||

36
c = |
5 |
|
8,31 |
|
Дж (кг К) = 1,04 104 Дж (кг К) |
|||
|
|
|
|
|||||
v |
2 |
|
2 10−3 |
|
|
|||
|
|
|
|
|||||
|
cp = |
5 + 2 |
|
|
8,31 |
Дж (кг К) = 1,46 104 Дж (кг К) |
||
|
2 |
2 10−3 |
||||||
|
|
|
|
|
|
|||
Пример 8. Вычислить удельные теплоемкости cV и cP смеси неона и водорода, если массовые доли неона и водорода составляют ω1 = 80 % и ω2 = 20 %. Значения
удельных теплоемкостей газов взять из предыдущего примера.
Решение. Удельную теплоемкость cv смеси при постоянном объеме найдем
следующим образом. Теплоту, необходимую для нагревания смеси на ∆T , выразим двумя способами:
Q = cv (m1 + m2 )∆T , |
(1) |
Q = (cv,1m1 + cv,2m2 )∆T , |
(2) |
где cv,1 - удельная теплоемкость неона; cv,2 - удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе части полученного равенства на ∆T , получим cv (m1 + m2 ) = cv,1m1 + cv,2 m2 . Отсюда
|
|
|
|
|
|
|
|
c |
|
= c |
|
|
m1 |
+ c |
|
|
m2 |
, |
|
|
|
|
|
|
|
v |
v,1 m |
+ m |
v,2 m |
+ m |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
или |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
1 |
2 |
|
||
|
|
|
|
|
|
cv = cv,1ω1 + cv,2ω2 |
|
|
|
|
|
|||||||
где ω1 |
= |
|
m1 |
, ω2 |
= |
|
m2 |
|
|
|
|
|
|
|
|
|
|
|
m1 |
+ m2 |
m1 |
+ m2 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
cp = cp,1ω1 + cp,2ω2 .
Произведем вычисления:
cv = (6,24 102 0,8 +1,04 104 0,2)Дж (кг К) = 2,58 103 Дж
(кг К) = 2,58 103 Дж (кг К) = 2,58кДж/(кг К) cp = (1,04 103 0,8 +1,46 104 0,2) Дж
(кг К) = 2,58кДж/(кг К) cp = (1,04 103 0,8 +1,46 104 0,2) Дж (кг К) = 3,75 103 Дж
(кг К) = 3,75 103 Дж (кг К) = 3,75кДж
(кг К) = 3,75кДж (кг К)
(кг К)
Пример 9. Определить среднюю длину свободного пробега молекул и число соударений за 1 с, происходящих между всеми молекулами кислорода, находящегося в сосуде емкостью 2 л при температуре 27 °С и давлении 100 кПа.
Решение. Средняя длина свободного пробега молекул кислорода вычисляется по формуле  λ =1/(
λ =1/(  2πd 2n) (1)
2πd 2n) (1)
где d — эффективный диаметр молекулы кислорода; п — число молекул в единице объема, которое можно определить из уравнения
п = p/(kT), |
(2) |
где k — постоянная Больцмана. Подставляя (2) в (1), имеем |
(3) |
λ = kT /( 2 πd 2 p) |
|
Число соударений Z, происходящих между всеми молекулами за 1 с, равно |
|
Z =1/2 Z N |
(4) |

37
где N — число молекул кислорода в сосуде объемом 2 10−3 м3 ,
 Z
Z - среднее число соударений одной молекулы за 1с. Число молекул в сосуде
- среднее число соударений одной молекулы за 1с. Число молекул в сосуде
|
|
|
N = nV |
|
|
|
|
|
|
(5) |
|
|
||||
Среднее число соударений молекулы за 1с равно |
|
|
|
(6) |
|
|
||||||||||
|
|
|
Z = |
|
v / λ |
|
|
|
|
|
|
|
|
|||
где v - средняя арифметическая скорость молекулы |
|
|
|
|
|
|
||||||||||
|
|
|
v = |
|
|
|
|
|
|
|
|
(7) |
|
|
||
|
|
|
|
8RT /(πM ) |
|
|
|
|
|
|||||||
Подставляя в (4) выражения (5),(6) и (7), находим |
|
|
|
|
|
|
||||||||||
|
|
Z = 1 |
8RT |
2 πd 2 p |
p V |
= 2πd 2 p2V |
|
|
|
|
||||||
|
|
|
RT . |
. |
||||||||||||
|
|
2 |
πM |
|
|
kT |
kT |
k 2T 2 |
|
|
πM |
|
||||
Подставляя числовые значения, получим |
|
|
|
|
|
|
|
|||||||||
Z = |
2 3,14 2,92 10−20 м2 1010 Па2 2 10−3 м3 × |
|
|
|
|
|
||||||||||
|
|
1,38 10−46 Дж2 К−2 9 104 К2 |
|
|
|
|
|
|
||||||||
× |
8,31Дж/(моль К) 300К |
=9 1028 |
с−1; |
|
|
|
|
|
|
|||||||
|
|
3,14 32 10−3 кг/ моль |
|
|
|
|
|
|
|
|
|
|||||
|
|
1,38 10−23 |
Дж |
300К |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||||
λ |
|
|
|
|
К |
|
|
|
−8 |
|
|
|
|
|
||
= |
2 3,14 2,92 10−20 м2 105 Па = |
3,56 10 |
|
м. |
|
|
|
|||||||||
Ответ: Z =9 1028 c-1 , λ =3,56 10-8 м.
Пример 10. Определить коэффициенты диффузии и внутреннего трения азота, находящегося при температуре T=300 К и давлении 105 Па.
Решение. Коэффициент диффузии определяется по формуле
D = |
1 |
v |
λ |
(1) |
|
3 |
|
|
|
где v - средняя арифметическая скорость молекул, равная |
||||
v = |
|
8RT |
; |
(2) |
|
|
πM |
|
|
λ - средняя длина свободного пробега молекул. Для нахождения λ воспользуемся формулой (3) из решения примера 9:
|
λ = |
|
kT |
|
|
(3) |
|
2 π d 2 p |
|
||||
Подставляя (2) и (3) в выражение (1), имеем |
|
|||||
D = 1 |
8RT |
|
kT |
= |
2kT RT . |
(4) |
3 |
πM |
|
2πd 2 p |
|
3πd 2 p πM |
|
Коэффициент внутреннего трения |
|
|||||
|
η = |
1 v |
λ ρ, |
(5) |
||
|
|
|
3 |
|
|
|
где ρ — плотность газа при температуре 300 К и давлении 105 Па. Для нахождения ρ воспользуемся уравнением состояния идеального газа. Запишем его для двух состояний азота — при нормальных условиях T0 =273 К, p0 = 1,01 105 Па и в условиях
задачи:
38
|
|
|
|
p0V0 = (m / M )RT0 ; |
|
|
pV = (m / M )RT. |
|
|
|
|
(6) |
|||||||||||||||||
Учитывая, чтоρ0 = m /V0 , ρ = m /V, имеем |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
ρ = |
ρ0 pT0 |
. |
|
|
|
|
|
|
|
|
(7) |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
p T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Коэффициент внутреннего трения газа может быть выражен |
через коэффициент |
||||||||||||||||||||||||||||
диффузии: |
|
|
|
|
|
|
ρ0 pT0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
η = D ρ = D |
|
|
|
|
|
|
|
|
|
|
|
(8) |
|
|
|
|
|||||||||||
|
|
|
p T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Подставляя числовые значения в (4) и (8), получим |
|
|
|
|
|
|
|||||||||||||||||||||||
D = |
|
2 1,38 10-23 Дж/ К 300К |
|
8,31Дж/(моль К) 300К |
= 4,7 10 |
−5 |
м |
2 |
/ с; |
||||||||||||||||||||
3 |
|
2 |
10 |
−20 |
м |
2 |
10 |
5 |
Па |
|
3,14 |
28 10 |
−3 |
кг/ моль |
|
|
|
||||||||||||
|
3,134 3,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
η = 4,7 10-5 м/ с 1,25кг/ м3 |
|
|
|
105 Па 273К |
|
= 5,23 10−5 кг/(м с). |
|
|
|
|
|||||||||||||||||||
1,01 105 Па 300К |
|
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Ответ: D = 4,7 10-5 м2 / с, |
|
η = 5,23 10−5 кг/(м с). |
|
|
|
|
|
|
|
||||||||||||||||||||
Пример 11. |
Кислород массой m = 2 кг занимает объем V = 1м3 |
и находится под |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
давлением p1 |
= 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема |
||||||||||||||||||||||||||||
V = 3м3 , а затем при постоянном объеме до давления p |
3 |
= 0,5 МПа. Найти изменение |
|||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆U внутренней энергии газа, совершенную им работу А и теплоту Q, переданную |
|||||||||||||||||||||||||||||
газу. Построить график процесса. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
Решение. Изменение внутренней энергии газа |
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
∆U = c m∆T = |
i |
|
R |
m∆T ; |
|
|
|
|
|
(1) |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
v |
|
|
|
|
2 |
|
M |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
где i - число степеней свободы молекул газа (для двухатомных молекул кислорода i =5); ∆T = T3 − T1 , - разность температур газа в конечном (третьем) и начальном
состояниях. Начальную и конечную температуру газа найдем из уравнения Менделеева - Клапейрона pV = mRTM , откуда
T = pVMmR .
Работа расширения газа при постоянном давлении выражается формулой
A1 = Mm R ∆T .
Работа газа, нагреваемого при постоянном объеме, равна нулю: A2 = 0
Следовательно, полная работа, совершаемая газом,
A = A1 + A2 = A1 .
Согласно первому началу термодинамики, теплота Q, переданная газу, равна сумме изменения внутренней энергии ∆U и работы A
Q = ∆U + A.
39
Произведем вычисления, учтя, что для кислорода M = 32 10−3 кг/моль
(см. табл. 9 Приложения): |
|
T = |
2 105 1 32 10−3 |
K = 385K |
||||||||||||||
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
2 105 3 32 10 |
−3 |
|
|
|
|
5 105 |
3 32 10 |
−3 |
||||||||
T = |
|
|
|
|
|
|
K =1155K |
|
T = |
|
|
|
|
K = 2887K |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
2 |
|
|
|
|
2 8,31 |
|
|
|
|
|
|
3 |
|
2 8,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
A = |
8,31 2 (1155 −385) |
Дж = 0,400 106 Дж = 0,4МДж |
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||
1 |
|
|
|
|
32 10−3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = A1 = 0,4МДж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
∆U = |
5 |
|
8,31 2 (2887 −385) |
|
Дж = 3,24 106 Дж = 3,24МДж |
|
|
|||||||||||
|
32 10−3 |
|
|
|||||||||||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|||||||
Q = (3,24 + 0,4)МДж = 3,64МДж
График процесса приведен на рисунке.
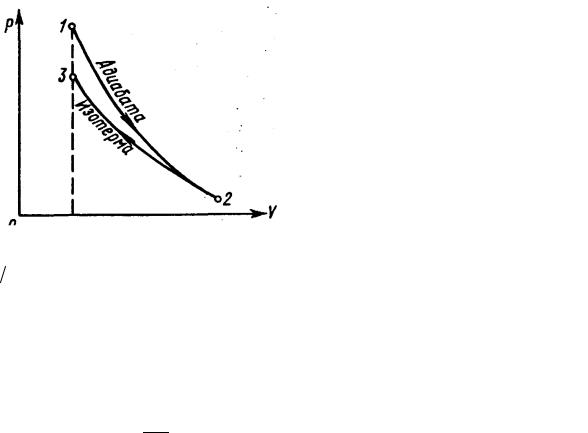
Пример 12. В цилиндре под поршнем находится водород массой m =0,02кг при температуре T1 = З00 К. Водород сначала расширился адиабатно, увеличив свой объем
в n1 =5 раз, а затем был сжат изотермически, причем объем газа уменьшился в n2 = 5
раз. Найти температуру в конце адиабатного расширения и работу, совершаемую газом при этих процессах. Изобразить процесс графически.
Решение. Температуры и объемы газа, совершающего адиабатный процесс, связаны
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
γ −1 |
T2 |
1 |
|
|
|
||||||
между собой соотношением |
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
= |
|
|
|
|
, или |
|
= |
|
|
|
||||||||||||||||
|
|
|
|
T |
|
V |
|
T |
nγ −1 |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
1 |
1 |
|
|
|
||||
где γ |
- |
отношение |
теплоемкостей |
|
газа |
|
при постоянном давлении и |
постоянном |
||||||||||||||||||||||||
объеме, |
n1 |
=V2 |
V1 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Отсюда получаем следующее выражение для конечной температуры: |
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
T |
= T |
nγ −1 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа A1 |
газа при адиабатном расширении может быть определена по формуле |
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
A = |
|
m |
C (T −T ) = |
m |
|
i |
R(T −T ) |
, |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
M |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
V |
1 |
|
|
2 |
|
|
M 2 |
1 |
2 |
|
|
||||||||||
где CV |
- молярная теплоемкость газа при постоянном объеме. Работа |
A2 газа при |
||||||||||||||||||||||||||||||
изотермическом процессе может быть выражена |
|
|
|
|
|
|
||||||||||||||||||||||||||
в виде |
|
|
|
m |
|
|
V3 |
|
|
|
m |
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = |
|
RT ln |
,или A = |
|
RT ln |
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
2 |
|
|
M |
2 |
V2 |
|
2 |
|
M |
2 |
|
|
n2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
где n2 |
=V2 |
|
V3 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Произведем вычисления, учитывая, что для водорода как двухатомного газа γ =1,4, i =5 и
M = 2 10−3 кг/моль:
T |
= |
300 |
K = |
300 |
K |
|
|
|
|
|
|
||||
2 |
|
51,4−1 |
50,4 |
|
|
|
|
|
|
|
|
|
|||
Так |
как |
50,4 =1,91 |
(находится |
||||
логарифмированием), то T2 = 1300,91 K =157K ;
40
A |
= |
0,02 5 8,31 |
(300 −157) |
Дж = 29,8 кДж , |
A = |
|
0,02 |
8,31 157 ln |
1 |
Дж = − 21кДж.. |
|
|
|
|
|
||||||||
1 |
|
2 10−3 |
2 |
|
2 |
2 |
10−3 |
5 |
|
||
|
|
|
|
|
|||||||
Знак минус |
показывает, |
что при сжатии работа |
газа совершается над газом |
||||||||
внешними силами. График процесса приведен на рисунке.
Пример 13. Объем аргона, находящегося при давлении 80 кПа, увеличился от 1 до 2л. На сколько изменится внутренняя энергия газа, если расширение производилось:
а) изобарно; б) адиабатно?
Решение. Применим первый закон термодинамики. Согласно этому закону, количество теплоты Q, переданное системе, расходуется на увеличение внутренней энергии ∆U и на внешнюю механическую работу А:
Q = ∆U + A |
|
|
|
|
|
(1) |
||||||
Величину∆U можно определить, зная массу газа |
m, удельную теплоемкость при |
|||||||||||
постоянном объеме cV и изменение температуры ∆T : |
||||||||||||
∆U = m cV ∆T. |
|
|
|
|
|
(2) |
||||||
Однако удобнее изменение внутренней энергии |
∆U определять через молярную |
|||||||||||
теплоемкость CV , которая может быть выражена через число степеней свободы: |
||||||||||||
|
|
|
c = |
CV |
|
= |
i |
|
R |
|
(3) |
|
|
|
|
|
|
||||||||
|
|
|
|
V |
M |
|
2 M |
|
||||
|
|
|
|
|
|
|
||||||
Подставляя величину cV из формулы (3) в (2), получаем |
||||||||||||
∆U = |
m |
|
i |
R ∆T . |
|
|
|
|
|
(4) |
||
M |
|
|
|
|
|
|
||||||
|
2 |
|
|
|
|
|
|
|
|
|
||
Изменение внутренней энергии зависит от характера процесса, при котором идет расширение газа. При изобарном расширении газа, согласно первому закону термодинамики, часть количества теплоты идет на изменение внутренней энергии∆U , которая выражается формулой (4) Найти ∆U для аргона по формуле (4) нельзя, так как масса газа и температура в условии задачи не даны. Поэтому необходимо провести преобразование формулы (4).
Запишем уравнение Клапейрона — Менделеева для начального и конечного состояний газа:
|
pV1 = (m / M )RT1 ; |
pV2 = (m / M )RT2 , |
|
||||
или |
p(V2 −V1 ) = (m / M )R(T2 −T1 ) . |
(5) |
|||||
Подставив (5) в формулу (4), получим |
|
||||||
|
∆U = |
i |
p(V |
2 |
−V ) . |
(6) |
|
|
|
||||||
|
2 |
|
|
1 |
|
||
|
|
|
|
|
|
||
Это уравнение является расчетным для определения ∆U при изобарном расширении. При адиабатном расширении газа теплообмена с внешней средой не происходит, поэтому Q = 0. Уравнение (1) запишется в виде
∆U + A = 0 . |
(7) |
Это соотношение устанавливает, что работа расширения газа может быть произведена только за счет уменьшения внутренней энергии газа (знак минус перед
∆U ): |
|
A = −∆U . |
(8) |
Формула работы для адиабатного процесса имеет вид
