
- •Запитання для самоконтролю
- •1.2. Уявлення про походження Землі (космогонічні гіпотези)
- •1.3. Форма, розміри і будова Землі
- •1.4. Оболонки Землі
- •1.4.1. Зовнішні сфери Землі
- •1.4.2. Внутрішні сфери Землі
- •Запитання для самоконтролю
- •2.1. Поняття про ендогенні та екзогенні процеси
- •2.2.1. Тектонічні рухи земної кори
- •2.2.2. Землетруси
- •2.2.3. Магматизм
- •2.2.4. Вулканізм
- •2.3. Процеси зовнішньої динаміки
- •2.3.1. Вивітрювання
- •2.3.4. Геологічна діяльність річок
- •2.3.5. Геологічна діяльність морів і океанів
- •2.3.6. Геологічна діяльність озер і боліт
- •2.3.7. Геологічна діяльність льодовиків
- •2.3.8. Геологічна діяльність підземних вод
- •2.3.9. Діагенез осадів
- •3.1. Поняття про мінерали. Первинні і вторинні мінерали, їх роль у ґрунтотворенні
- •3.2. Агрегатний стан мінералів та їх внутрішня будова
- •3.3. Фізичні властивості мінералів
- •3.4. Форми існування мінералів у природі
- •3.5. Процеси утворення мінералів
- •3.5.1. Магматичні процеси мінералоутворення
- •3.5.2. Екзогенні процеси мінералоутворення
- •3.5.3. Метаморфічні процеси мінералоутворення
- •3.6. Класифікація природних речовин
- •3.7. Характеристика найпоширеніших мінералів
- •3.7.1. Клас самородних елементів
- •3.7.2. Клас сульфідів
- •3.7.3. Клас оксидів і гідроксидів
- •3.7.5. Клас галоїдів
- •3.7.6. Клас вуглеводневих сполук
- •Запитання для самоконтролю
- •4.1. Поняття про гірські породи та їх класифікація
- •4.1.1. Діагностичні ознаки гірських порід
- •4.2. Магматичні гірські породи
- •4.2.1. Класифікація магматичних гірських порід
- •4.3. Метаморфічні гірські породи
- •4.3.1. Основні представники метаморфічних гірських порід
- •4.4. Осадові гірські породи
- •4.4.1. Фізичні властивості осадових гірських порід
- •4.4.2. Класифікація осадових гірських порід
- •Запитання для самоконтролю
- •5.1. Абсолютний вік гірських порід
- •5.2. Відносний вік гірських порід
- •5.3. Геохронологічна шкала
- •Запитання для самоконтролю
- •6.1. Елювіальні породи
- •6.4. Пролювіальні породи
- •6.5. Алювіальні породи
- •6.6. Льодовикові відклади
- •6.7. Флювіогляціальні відклади
- •6.8. Еолові відклади
- •6.9. Озерні відклади
- •6.10. Морські відклади
- •Запитання для самоконтролю
- •7.1. Поняття про агрономічні руди
- •7.2. Азотні агрономічні руди
- •7.3. Фосфорні агрономічні руди
- •7.4. Калійні агрономічні руди
- •7.5. Кальцієві агрономічні руди
- •7.6. Магнієві агрономічні руди
- •7.7. Органічні агрономічні руди
- •Запитання для самоконтролю
- •8.1. Загальні відомості про рельєф земної поверхні
- •8.1.1. Елементи рельєфу
- •8.1.2. Форми і комплекси форм рельєфу
- •8.1.3. Типи і класи рельєфу
- •8.2. Геоморфологічні карти та їх значення для ґрунтознавства, агрохімії і землеробства
- •8.3. Геоморфологічне районування України
- •Запитання для самоконтролю
- •Список рекомендованої літератури
- •Предметний покажчик

енергії. В разі утворення метеоритного кратера породи руйнуються, переміщуються, плавляться і випаровуються.
3.6. КЛАСИФІКАЦІЯ ПРИРОДНИХ РЕЧОВИН
Кристали мінералів можуть формуватися різними шляхами: ви- ростати з газової фази, виникати з рідин, випадати під час охоло- дження гарячого розплаву і насиченого розчину в глибоких надрах і під час випаровування цього розчину за найрізноманітніших обста- вин, у тім числі і на поверхні Землі. Є багато систематик мінералів, гірських порід, корисних копалин, які розглядають ці геологічні ті- ла з різних позицій — загальногосподарських, промислових, будіве- льних, загальногеологічних, кристалохімічних та генетичних. Най- загальніша з них ділить усі речовини Землі на дві великі групи —
неорганічні та органічні.
У геохімії поширена класифікація природних систем В. Гольд- шмідта, згідно з якою ознакою геохімічної спорідненості хімічних елементів — сумісних концентрацій у геологічних тілах — всі еле- менти поділено на п’ять груп (табл. 3.5).
Таблиця 3.5. Геохімічна класифікація елементів (за Б. Мейсоном)
|
|
Елементи |
|
|
автофільні |
гідрофільні |
літофільні (зем- |
халькофільні |
сидерофільні |
(атмосфера) |
(гідросфера) |
на кора + |
(нижня мантія) |
(ядро Землі) |
+ верхня мантія) |
||||
N,O,C (у фо- |
Н і О (у фор- |
Li,Na,K,Mg, |
Cu,Ag,Zn, |
Fe,Co,Ni, |
рмі СО2) |
мі Н2О) |
Ca, Ba,B,Al |
Hg, Ti |
Pt,Au,Sn |
Н, Н2О (па- |
С і О (у фор- |
Рідкісноземе- |
Pb,As,B |
— |
ра) |
мі СО2 і в |
льні (С), Si, Ti |
|
|
Благородні |
розчині) |
P,O,Cr,H, |
S,Se,(Fe), |
C,P,(Pb), |
(О), (N), луги, |
||||
гази |
Ca, Mg, гало- |
F,Cl,Br,I,Mn |
(Mo),(Cr) |
(As) |
|
гени, бор |
|
|
|
Автофільні елементи — інертні, леткі, перебувають у газоподіб- ному стані; гідрофільні — в рідкому (Н і О у формі Н2О; С і О — у формі СО2) і в розчині; літофільні — накопичуються в період кон- центрування розплаву, за моделлю це атоми, іони; халькофільні і сидерофільні — мають велику щільність, є розплавленими сульфі- дами або входять до складу мінералів.
Господарська систематика мінеральної сировини. Усі корисні ко- палини М.І. Єрмаков поділив на чотири типи: I — метали; II — не- метали; III — горючі копалини; IV — гідрогазомінеральна сирови- на. Серед металів він виділив підтип — родовища елементів або їхніх сполук, серед неметалів — родовища мінералів і гірських по- рід, кристалів, аморфних і прихованокристалічних речовин. Вчений
121

літерою А позначив технічну сировину, коштовні камені та п’єзооптичну сировину, літерою Б — кольорові камені, В — будіве- льні матеріали і скляно-керамічну сировину, Г — тверде паливо (хімічну сировину, каустобіоліти, гуміти, напівсапропелі і сапропе- лі), Д — відходи (різні шлаки, цемент, бетон), Е — агрономічну си- ровину (агроруди — добрива і меліоранти ґрунтів, корми для тва- ринництва та птахівництва).
Систематика мінералів. До останнього часу найбільш пошире- ною була класифікація мінералів, в основу якої покладено хімічний склад аніонної частини сполуки. Під час складання цієї класифіка- ції вчені виходили з того, що металоподібна частина сполуки міне- ралів, яка зумовлює низку зовнішніх ознак (кристалічну форму, оп- тичні властивості та ін.), дає змогу об’єднати мінерали в певні кла- си. Вивченням особливостей кристалічної структури мінералів встановлено чіткий зв’язок між їх будовою — структурою, хімічним складом і фізичними властивостями (забарвлення, твердість, спай- ність) і доведено, що морфологія (зовнішній вигляд) мінералів до- помагає визначити їх генезис. Перебудова мінералогічної система- тики і класифікації мінералів за О.Г. Берехтіним на кристалохіміч- ній (структурній) основі відкриває великі перспективи для пізнання і розуміння деяких процесів мінералоутворення.
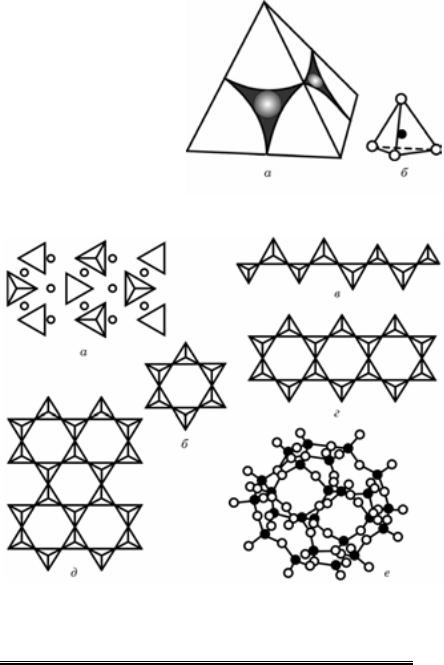
Кристалохімічна класифікація. Силікатні сполуки земної кори досить різнорідні. Серед них є головні породоутворювальні мінера- ли і відносно рідкісні мінеральні види. Склад і кристалохімічна структура силікатів здебільшого складніші, ніж інших мінералів. Основним елементом кристалохімічної структури силікатів є силіці- євокисневий радикал — тетраедр (табл. 3.6, рис. 3.11).
Таблиця 3.6. Силіцієвокисневі радикали в структурах різних класів силіка-
тів (спрощено за М.О.Тороповим і Л.М.Бурак)
Відно- |
Радикал |
Структура |
Формула |
Мінерал |
шення |
||||
[Si, Al] : О |
|
|
|
|
12 : 48 |
[SiO4] |
Окремі тетраедри |
Mg2[SiO4] |
Форстерит |
12 : 36 |
[SiO3] |
(острови) |
Mg7(OH)2[Si8O11] |
Авгіт |
Ланцюжок |
||||
12 : 33 |
[Si4O11] |
Стрічки |
Mg7[OHSi4O11]2 |
Антофіліт |
12 : 30 |
[Si4O10] |
Шари, листи |
Mg3[ (OH)2Si4O10] |
Тальк |
12 : 24 |
[SiO2] |
Каркас |
Si4O8 = [SiO2]4 |
Кварц |
12 : 24 |
[(AlSi3)O8] |
» |
K[AlSi3O8] |
Ортоклаз |
12 : 24 |
[(AlSi2)O6] |
» |
K[AlSi2O6] |
Лейцит |
12 : 24 |
[(AlSi)O4] |
» |
Na3К[AlSiO4]4 |
Нефелін |
В усіх силікатах кожен іон силіцію сполучений із чотирма іонами кисню, розташованими у вершинах тетраедра. Тетраедри можуть з’єднуватись між собою тільки через кисневі вершини.
122
Способи сполучення силицієвокисневих тет- раедрів покладено в ос- нову сучасної кристало- хімічної класифікації силікатів. Залежно від характеру сполучення і розміщення таких тетра- едрів у кристалічній ґра- тці силікату утворюються різні типи структури
(рис. 3.12).
Поряд із подільним конечним радикалом си- лікатів виділяють ради- кали нескінченні — лі-
Рис. 3.11. Угруповання з чотирьох іонів кисню з іоном силіцію в центрі (а) та умовне зображення силіцієвокисневого тетраедра (б)
Рис. 3.12. Типи кристалохімічної структури силікатів:
а — окремі силіцієвокисневі тетраедри, сполучені з катіонами магнію і заліза (оли- він); б — кільцеві угруповання силіцієвокисневих тетраедрів (берил); в, г — поодино- кий і подвійний ланцюги; д, е — плоска сітка і тривимірний каркас силіцієвокисневих тетраедрів
123

нійні, площинні або просторові сполучення силіцієвокисневих тет- раедрів. З’єднання силицієвокисневих тетраедрів у безперервні ланки дають ланцюгові силікати з радикалом [Si2O6]4–. У кожній ланці залишаються вільними чотири валентності: біля двох атомів кисню з кожного тетраедра — по дві вільні валентності.
Здвоєні ланцюги відповідають радикалу [Si4O11]6– й утворюють стрічки або пояси. Спостерігаються вони у структурах амфіболів. Стрічки, розміщені в одній площині, мають по три спільних атоми кисню й утворюють нескінченний лист або шар із радикалом [Si4O10]4–, типовим для мінералів шаруватої будови (слюди, каолініт, тальк).
У разі безперервного тривимірного зчеплення силіцієвокисневих тетраедрів у кристалічній структурі, коли кожен іон кисню одноча- сно належить двом тетраедрам, зчеплення тетраедрів відбувається через усі чотири вершини і дає каркасну будову (польові шпати, кварц та ін.; див. рис. 3.12).
Кожен мінерал має певний хімічний склад, що передається хіміч- ною формулою. Хімічна формула містить символи хімічних елемен- тів, що входять до складу мінералу, таких як кисень (О), силіцій (Si), алюміній (Al), залізо (Fe) та ін. (див. табл. 3.5). Загальноприй- нятою є структурна формула будови мінералу. Наприклад, мінерал галіт (NaCl) складається з атомів натрію і хлору, при цьому 23 ма- сові частки натрію зв’язані з 35,5 масовими частками хлору. Інколи формули складних мінералів записують у вигляді оксидів, які вхо- дять у мінерал. Наприклад, структурна формула калієвого польово- го шпату — К[АlSi3O8], або у вигляді оксидів — K2O•Аl2O3•6SiO2. Цей мінерал складається з 64,8 % діоксиду силіцію (SiO2), 18,3 % оксиду алюмінію (Аl2O3) і 16,9 % оксиду калію (K2O).
Кристалохімічні класифікації численні і принципово мало різ- няться одна від одної. Тут використано класифікацію М.О. Торопо- ва, яка враховує тип хімічної сполуки, структурні зв’язки речовин — іонів, атомів тощо (табл. 3.7).
Розвиваючи сучасні уявлення про стан твердого тіла — криста- лічний та аморфний, М.О. Торопов виділив три головні типи міне- ралів.
I.Кисневі сполуки — мінерали мають переважно іонні структури
йіноді іонно-ковалентні.
II.Некисневі сполуки — структурні зв’язки атомні, ковалентні, металічні, особливо — галоїди з іонними структурами.
III.Органічні та штучні сполуки — структурні зв’язки відсутні. Типи мінералів поділено на класи.
Кисневі сполуки включають сім класів: 1 — силікати; 2 — карбо- нати; 3 — фосфати; 4 — вольфраміти; 5 — нітрати; 6 — сульфати; 7 — оксиди і гідроксиди.
124

Таблиця 3.7. Кристалохімічна класифікація мінералів |
|
|||
(за працею М.П. Толстого, 1991) |
|
|||
|
|
|
|
|
Тип |
Клас |
Підклас |
Представник |
Структурний |
|
|
|
|
зв’язок |
Самородні еле- |
1. Самородні |
— |
Алмаз, графіт, |
Металічний і |
менти |
елементи |
|
сірка, платина, |
ковалентний |
мінерали з ме- |
|
|
золото, мідь |
(структури |
талічними і ко- |
|
|
|
атомні і ме- |
валентними |
|
|
|
талічні) |
зв’язками |
|
|
|
|
мінерали з ме- |
|
|
|
|
талічними і |
|
|
|
|
атомними |
|
|
|
|
структурами |
2. Сульфіди |
— |
Пірит, марка- |
Ковалентний |
Сульфіди та |
||||
близькі до них |
|
|
зит, халькопі- |
(структури |
сполуки |
|
|
рит, галеніт, |
атомні) |
|
|
|
сфалерит, ар- |
|
|
|
|
сенопірит, ау- |
|
|
|
|
рипігмент, |
|
|
|
|
реальгар, кі- |
|
|
|
|
новар, моліб- |
|
Галоїдні сполуки |
3. Галоїди |
— |
деніт |
Іонний |
Галіт, сильвін, |
||||
|
|
|
флюорит, кар- |
(структури |
Кисневі сполуки |
4. Силікати |
1. Острівні |
наліт |
іонні) |
Оливін, граніт, |
Проміжний |
|||
|
|
|
циркон, топаз, |
іонно-кова- |
|
|
2. Комплек- |
дистен |
лентний |
|
|
Епідот, мелиніт |
|
|
|
|
сні |
Берил, турмалін |
|
|
|
3. Кільцеві |
|
|
4.Ланцюгові Авгіт, тальк, гіперстен, діо- псид
5.Стрічкові Рогова обман- ка, родоніт, жадеїт, волас- тоніт
6.Шаруваті Слюда, каолі- (листуваті ніт, монтмори-
ішаруваті) лоніт, галуазит, вермикуліт
7. Каркасні |
Ортоклаз, мік- |
|
роклін, лаб- |
|
радор, анортит, |
|
нефелін, лей- |
|
цит, натроліт, |
5. Карбонати Водні і без- |
кварц |
Кальцит, ара- |
|
водні |
гоніт, доломіт, |
|
магнезит, ма- |
|
лахіт, азурит, |
|
смітсоніт |
125
