
- •Рабочая тетрадь
- •«Гистология с основами цитологии»
- •Правила работы в гистологическом классе
- •На занятия приносить обязательно:
- •Раздел основы гистотехники
- •Порядок операций при работе с микроскопом:
- •Железный гематоксилин Вейгерта.
- •Прогрессивным методом.
- •Регрессивным методом.
- •Метод окрашивания под ван Гизон.
- •Раздел цитология пз: Строение животной клетки.
- •Цитоплазма
- •Правила оформления графической работы с микропрепарата
- •Пз : клеточный цикл, митоз
- •Телофаза второго мейотического деления.
- •Дробление
- •Гаструляция
- •Гисто- и органогенез
- •Пз: эпителиальная ткань
- •Контрольные вопросы:
- •Лз : волокнистые соединительные ткани
- •Задачи:
- •Пз: лимфа. Гемопоэз
- •Лз: хрящевая и костная ткани
- •Лз. Мышечная ткань
- •Лз : нервная ткань
- •Пз: нейроглия
- •Пз : нервные волокна и нервные окончания
- •Рекомендуемая литература
- •Краткий эмбриологический словарь
Порядок операций при работе с микроскопом:
1. Работать с микроскопом следует сидя; 2. Микроскоп нужно осмотреть, вытереть от пыли мягкой салфеткой объективы, окуляр, зеркало или электроосветитель; 3. Микроскоп установить перед собой, немного слева на 2-3 см от края стола. Во время работы его не сдвигать; 4. Открыть полностью диафрагму, поднять конденсор в крайнее верхнее положение; 5. Работу с микроскопом всегда начинать с малого увеличения; 6. Опустить объектив малого увеличения в рабочее положение, т.е. на расстояние 1 см от предметного стекла; 7. Установить освещение в поле зрения микроскопа, используя электроосветитель или зеркало. Глядя одним глазом в окуляр и пользуясь зеркалом с вогнутой стороной, направить свет от окна в объектив, а затем максимально и равномерно осветить поле зрения. Если микроскоп снабжен осветителем, то подсоединить микроскоп к источнику питания, включить лампу и установить необходимую яркость горения; 8. Положить микропрепарат на предметный столик так, чтобы изучаемый объект находился под объективом. Глядя сбоку, опускать объектив при помощи макровинта до тех пор, пока расстояние между нижней линзой объектива и микропрепаратом не станет 4-5 мм; 9. Смотреть одним глазом в окуляр и вращать винт грубой наводки на себя, плавно поднимая объектив до положения, при котором хорошо будет видно изображение объекта. Нельзя смотреть в окуляр и опускать объектив (во избежание того, что фронтальная линза может раздавить покровное стекло, и на ней появятся царапины); 10. Передвигая препарат рукой, найти нужное место, расположить его в центре поля зрения микроскопа; 11. Если изображение не появилось, то надо повторить все операции пунктов 6, 7, 8, 9; 12. Для изучения объекта при большом увеличении, сначала нужно поставить выбранный участок в центр поля зрения микроскопа при малом увеличении. Затем поменять объектив на 40 х, поворачивая револьвер, так чтобы он занял рабочее положение. При помощи микровинта добиться хорошего изображения объекта. На коробке микрометренного механизма имеются две риски, а на микрометренном винте - точка, которая должна все время находиться между рисками. Если она выходит за их пределы, ее необходимо возвратить в нормальное положение. При несоблюдении этого правила, микрометренный винт может перестать действовать;
13. По окончании работы с большим увеличением, установить малое увеличение, поднять объектив, снять с рабочего столика препарат, протереть чистой салфеткой все части микроскопа, накрыть его полиэтиленовым пакетом и поставить в шкаф.
Определить разрешающую способность микроскопа при использовании дневного света и объективов с увеличением 8х, 20х, 90х;
Определить разрешающую способность микроскопа при использовании красного света и объективов с увеличением 9х, 20х, 90х;
Определить разрешающую способность микроскопа при использовании фиолетового света и объективов с увеличением 10х, 60х, 90х.
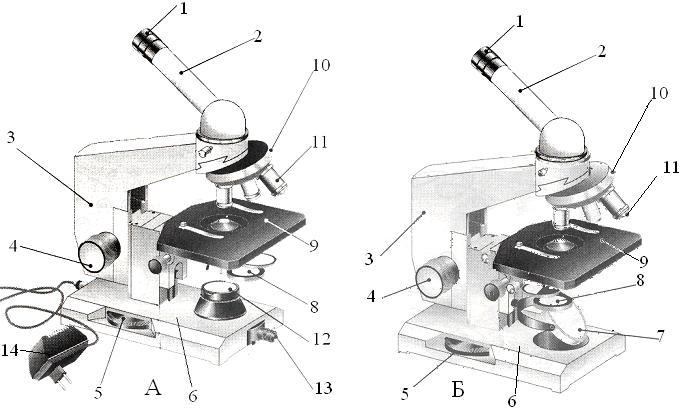
Рис. 1 Строение микроскопа
А – МИКМЕД-1; Б – БИОЛАМ.
1 –
2 –
3 -
4 –
5
6 –
7 –
8 –
9 –
10 –
11 –
12 –
13 –
14 –
Приемы и методы приготовления гистологических препаратов называются гистологической техникой.
Гистологическая техника состоит из нескольких последовательных приемов:
взятие материала;
его фиксация;
отмывания от фиксатора;
замораживания или заключения в уплотняющие среды;
приготовления срезов;
их окрашивания;
и их заключения.
Взятие материала производится острым режущим инструментом от убитого животного или от трупа (не более 1 часа после смерти), иногда биопсией при жизни животных. Величина взятого кусочка не должна превышать 1 см3.
Фиксация. Взятый кусочек помещается в фиксатор. При этом происходит быстрая коагуляция (осаждение, свертывание) белков. Однако, имеются фиксаторы, в которых происходит сильное обезвоживание коллоидов. При фиксации прекращаются процессы разложения, и тем самым, сохраняются в большей или меньшей степени прижизненные структуры материала. Наиболее часто в качестве фиксатора используется формалин, этиловый спирт, ацетон и другие вещества. Часто фиксаторы бывают сложного химического состава.
Промывка - извлечение (удаление) фиксатора. Производится промывание сначала обычной (водопроводной), а затем дистиллированной водой.
Для ускоренного приготовления гистологических препаратов из промывочной воды кусочки переносятся на столик специального микротома, замораживаются жидкой углекислой и готовятся срезы.
Обезвоживание и заключение в плотные среды. Для заключения в целлоидин или парафин материал проводят обезвоживание материала в спиртах возрастающей концентрации.
После проводки через спирты производится заливка материала.
Заключение материала в целлоидин. Целлоидин представляет собой очищенный сор коллодионной нитраклетчатки. Из-за дефицитности целлоидина, его можно заменить кино- и рентгенопленками, имеющими нитроцеллоидную основу. С кино и рентгенопленок удаляют эмульсию, помещая в горячую воду или 20% раствора едкого натрия или калия. Затем их сушат и нарезают на мелкие кусочки и растворяют в равных частях спирт – эфира. Готовят 2, 4-5 и 10% растворы.
Для заливки в целлоидин материал из последнего спирта переносят в равные части спирта – эфира (6-24час.), затем делается последовательная проводка через растворы (2- , 4-5, 10%) целлоидина. В последнем густом растворе целлоидина оставляют на открытом воздухе на 2-3 дня. Спирт – эфир испаряется и целлоидин загустевает. Затем вырезаются заключенные кусочки материала и приклеиваются к деревянным блокам. Хорошо сохраняются блоки в 70º спирте.
Для заключения материала в парафин кусочки ткани проводятся через спирты возрастающей концентрации, включая абсолютный. В дальнейшем материал помещается в раствор из равных частей спирт- хлороформа (вместо хлороформа можно использовать ксилол и толуол). Из этого раствора кусочек перекладывается в чистый хлороформ (2 порции) с последующим переносом в хлороформ – парафин (насыщенный раствор парафина в хлороформе) при температуре 35-40ºС. В последующем материал помещается в 3 порциях расплавленного парафина при температуре 54-56ºС. Из бумаги изготовляются формочки, куда переносится материал и сверху заливается расплавленным парафином. Для быстрого застывания парафина формочки опускаются в чашки с холодной водой.
Приготовление срезов из целлоидиновых и парафиновых блоков. Готовятся срезы с помощью особых приборов – микротомов.
Наиболее распространенными являются санные микротомы. Они состоят из станины (корпуса), микрометрического винта, объектодержателя, ножевых салазок с зажимом ножа. Для резки блоков используются микротомные ножи. По форме клина лезвия ножей различаются на прямые (обе стороны лезвия ножа плоские), плосковогнутые (одна сторона лезвия плоская, другая вогнутая) и двояковогнутые. Прямые ножи используются для срезки замороженных материалов и парафиновых блоков. Другие ножи чаще всего применяются для срезки целлоидиновых блоков.
При установке ножа нужно соблюдать угол резания, образуемый при пересечении верхней плоскости объекта с нижней стороной лезвия ножа. Считается наиболее лучшим угол резания около 15 градусов.
При гистохимических исследованиях иногда производится приготовление срезов из нефиксированной ткани. Для этой цели наиболее приемлемым является криостат. Он представляет холодильную установку с помещенным в ней микротомом. После включения прибора через 1-1,5 часа устанавливается автоматически поддерживаемая температура до 30ºС. При низкой температуре под контролем через иллюминатор готовятся замороженные срезы.
Окрашивание срезов. Перед окрашиванием срезы подвергаются предварительной обработке в зависимости от фиксации и заключения материала.
Парафиновые срезы не имеют достаточной прозрачности и затрудняется процесс окрашивания. Поэтому их подвергают депарафинированию с помощью ксилола или других растворителей парафина. Затем срезы выдерживают в спиртах нисходящей концентрации о последующим помещением в воду.
Целлоидиновые срезы, полученные из блоков, хранящихся в 70º спирте, помещают сначала в 50º спирт, а затем в воду.
Срезы из криостата сразу помещают на предметные стекла. Замороженные срезы, приготовленные на микротоме или замораживающем столике, сразу опускают в воду.
Окрашиванию подвергаются наклеенные на предметные стекла и не наклеенные срезы. В первом случае для крашения используются биологические стаканчики, высокие бюксы и кюветы. Не наклеенные срезы помещаются в низкие бюксы, часовые стекла. При этом перенос срезов производится с помощью стеклянных крючков.
При переносе срезов из одного раствора в другой нужно избегать загрязнения последующих реактивов. При переносе предметных стекол с наклеенными срезами надо давать возможность стекать жидкости, но не допуская их подсыхания. При окрашивании срезов необходимо чаще менять растворы, не допуская их загрязнения.
В гистологии применяется много различных красок. Они по химическому составу делятся на основные, кислые, нейтральные и индиферентные. Основные краски являются красящими основаниями и их солями. Гистологические структуры, окрашивающиеся основными красками называются базофильными. Кислые краски – это красящие кислоты и их соли. Гистологические структуры, окрашивающиеся кислыми красками называются оксофильными или ацидофильными.
Нейтральные краски – это солеобразные соединения, у которых анионы и катионы являются красящими радикалами. В нейтральных красках базофильные структуры окрашиваются основными компонентами красителя, а кислые – соответственно кислыми радикалами краски.
Индиферентные краски – это не красители, а окрашенные вещества. В гистологии они используются для окрашивания жировой ткани. Индиферентные краски (суданы разных марок) хорошо растворяются в жировой ткани и тем самым окрашивают ее.
Также красители делятся на субстактивные и аджективые. Первые окрашивают срезы без какой-либо дополнительной обработки, а вторые для окрашивания нуждаются в дополнительной обработке – протравливании. Протравами служат окислы двух – и трехвалентных металлов (железа, алюминия, хрома и других). При окрашивании протравы с красителями образуют хелатный комплекс (лак), который заметно отличается от взятого красителя. Протрава в отдельных случаях может превратить вещество в краситель. Так, например, гематоксилин в чистом виде почти не обладает красящими свойствами, так как его лаки становятся сильными красителями.
В гистологии применяются прогрессивные и регрессивные метод окрашивания. При прогрессивном методе срезы окрашивают до желательной интенсивности, когда все необходимые детали среза четко выявляются. При работе регрессивным методом срезы специально перекрашиваются, а затем избыток красителя извлекается соответствующими реактивами.
Самым распространенным классическим гистологическим методом является окрашивание гематоксилин – эозином.
Гематоксилин – экстракт камышового дерева. Имеется много рецептов приготовления гематоксилина. В нашей лаборатории часто применяются гематоксилины Каррачи, Гейденгайна и Вейгерта. Гематоксилин Каррачи имеет следующий химический состав:
Вода дистиллированная – 400,0 мл
Квасцы алюмо – калиевые – 25,0 г.
Гематоксилин – кристаллический – 0,5 г.
Глицерин – 100,0 мл.
Йодноватокислый калий (КО3) – 0,03 г.
Для приготовления железного гематоксилина Гейденгайна сначала готовят два раствора.
10% раствор железоаммиачных квасцов (кристаллы их должны быть только светло – фиолетового цвета).
Растворяют 1,0 г гематоксилина в 10мл 96º спирта и затем добавляют 90мл дистиллированной воды.
Отмечают уровень второго раствора и его оставляют для созревания на 4-5 недель. При этом раствор должен быть свободный доступ воздуха. Для чего среду с раствором прикрывают марлей сложенный в несколько слоев. По мере испарения воды из раствора доливают воду до исходного уровня. По мере созревания раствор красителя становится от светло-коричневого до темно-коричневого. Перед окраской раствор краски разбавляют равным количеством дистиллированной воды.
