
- •Таврический национальный университет им. В.И. Вернадского
- •1. Природа сил химической связи
- •1.1 Методы анализа сложных молекул
- •1.1.1 Метод валентных связей
- •1.1.2 Метод молекулярных орбиталей
- •1.1.3 Заключение
- •2. Структура энергетических уровней молекул
- •2.1 Потенциальные кривые электронных состояний молекул
- •2.2 Колебательные уровни энергии молекул
- •2.3 Вращательные уровни энергии молекул
- •2.4 Заключение
- •3. Молекулярные спектры
- •3.1 Общие характеристики молекулярных спектров
- •3.1.1 Вращательные спектры молекулы.
- •3.1.2 Колебательно-вращательные спектры молекулы
- •3.1.3 Электронные спектры молекулы.
- •3.2 Спектр поглощения двухатомной молекулы йода
- •4. Экспериментальная часть
- •4.1 Описание установки
- •4.2 Обработка результатов. Задание.
- •4.3 Вопросы к отчету
- •Литература
2.2 Колебательные уровни энергии молекул
В разделе 1.1 отмечалось, что при адиабатическом приближении уравнение (1.1) разбивается на два, при чем, второе уравнение описывает колебательное движение ядер. Это уравнение имеет вид:
![]() , 2.5
, 2.5
где = M1M2/(M1+M2) – приведенная масса двух ядер молекулы; U(x) – потенциальная энергия ядер, которая равна энергии электронов молекулы E(R).
Для нахождения вида потенциала U(R) разложим функцию E(R) в ряд по степеням малой величины x = R– R0 :
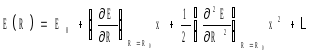 2.6
2.6
В случае малых x = R–R0 (малых колебаний) можно ограничиться первыми тремя членами в (2.6)
![]() ,
где
2.7
,
где
2.7
![]() причем,
очевидно, что коэффициенты
и
различны для различных состояний
молекулы. Поскольку
= 0 (условие равновесия) то (2.7) примет
вид:
причем,
очевидно, что коэффициенты
и
различны для различных состояний
молекулы. Поскольку
= 0 (условие равновесия) то (2.7) примет
вид:
![]() , 2.8
, 2.8
что соответствует потенциальной энергии гармонического осциллятора.
Решение уравнения (2.5) с потенциалом (2.8) дает следующие собственные значения для энергии колебания ядер молекулы:
![]() , 2.9
, 2.9
где колебательное квантовое число n = 0,1,2,3, ... ; 0 – собственная частота гармонического осциллятора.
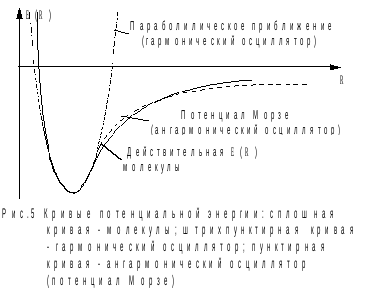
Как видно из рис.5, параболическая кривая лишь возле самого минимума хорошо аппроксимирует реальную потенциальную кривую молекулы. Поэтому высоко расположенные колебательные состояния двухатомной молекулы не описывается соотношением (2.9). Хорошим приближением к реальной потенциальной кривой молекулы является потенциал Морзе (см. рис.5)
![]() 2.10
2.10
где D и – постоянные; x = R – R0 . Как видно из (2.10), U() – U(0) = D ; отсюда следует, что параметр D представляет собой энергию диссоциации.
Значительно более точное выражение для колебательной энергии двухатомной молекулы получается при подстановке в уравнение Шредингера (2.5) вместо функции (2.8) потенциал Морзе (2.10). В этом случае колебания молекулы не являются гармоническими (ангармонический осциллятор) и решение уравнения Шредингера дает следующее соотношение для колебательных энергетических уровней:
![]() , 2.11
, 2.11
где
![]() 2.12
2.12
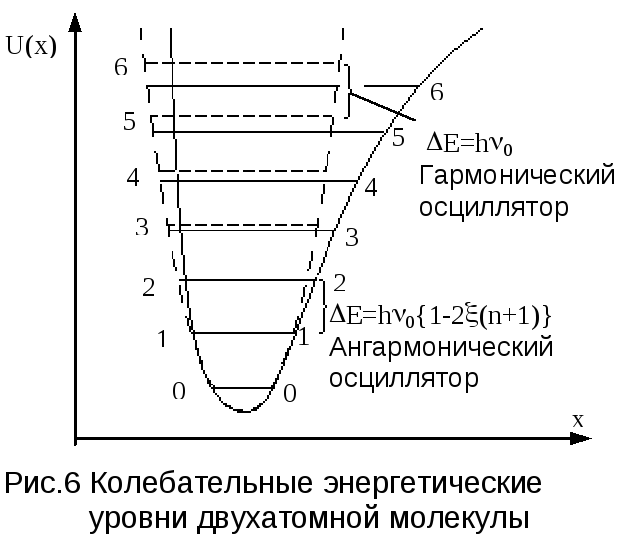
Параметр называется постоянной ангармоничности. Как видно из (2.11), уровни ангармоничного осциллятора не являются равноотстоящими, промежутки между соседними уровнями равны
![]() 2.13
2.13
т.е. убывают с увеличением квантового числа n (см. рис.6).
В заключение следует отметить, что согласно формулы (2.2), при характерном для двухатомных молекул отношением масс электрона и ядра атома m/M ~ 10-3 - 10-5 и при характерной энергии электронного движения в несколько электронвольт, для энергии колебательного движения получается характерная величина Eкол h0 10-1- 10-2 эВ.
