- •Получение сернистого газа сжиганием серы, сероводорода и других видов сырья
- •Коксование каменных углей
- •Химические методы получения гидроксида натрия
- •Известковый метод
- •Ферритный метод
- •Электрохимические методы получения гидроксида натрия
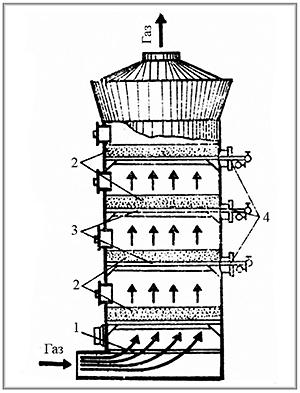
- •Контактный аппарат для окисления оксида серы(IV) в кипящем слое: 1 – выравнивающие решетки; 2 – катализатор; 3 – газораспределительные решетки; 4 – теплообменные элементы
- •Получение азота
- •13. Аммиак. Синтез аммиака.
- •14. Азотная кислота. Абсорбция нитрозных газов при атмосферном давлении.
- •15. Получение чугуна
- •16.Абсорбция серного ангидрида. Получение могогидрата и олеума
- •17. Получение этилена, ацетилена.
- •Получение пиролизом
- •20. Ректификация нефти.
- •23.Каталитический крекинг.
- •22. Выплавка стали.
- •24.Получение цемента сухим способом.
- •Производство цемента сухим способом
- •25. Технология получения соды.
- •26. Получение водорода из водяного пара
- •27. Получение стекла
- •28. Получение карбамида
- •29. Получение капролактама. Капрон.
- •9. Топливо. Электроэнергия.
- •10. Уравнение теплопроводности.
- •11. Уравнение Эйлера для гидродинамических условий.
- •12. Насосы. Компрессоры.
- •13. Сушка. Виды сушилок.
- •15. Теплообменники.
- •22. Ректификация. Ректификационная колонна.
- •21. Закон сохранения массы для любого разреза аппарата.
- •20. Выпарки. Упаривание методом противотока
- •19. Выпарки. Упаривание методом прямотока.
- •18. Экстракция. Экстракторы.
- •17. Уравнение Бернулли.
- •16. Критерии Рейнольдса.
Химические методы получения гидроксида натрия
К химическим методам получения гидроксида натрия относятся известковый и ферритный.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется множество энергоносителей, получаемый едкий натр сильно загрязнён примесями.
Сегодня эти методы почти полностью вытеснены электрохимическими методами производства.
Известковый метод
Известковый метод получения гидроксида натрия заключается во взаимодействии раствора соды с гашенной известью при температуре около 80 °С. Этот процесс называется каустификацией; он проходит по реакции:
Na2СО3 + Са (ОН)2 = 2NaOH + CaСО3
В результате реакции получается раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % масс. NaOH. После NaOH плавят и разливают в железные барабаны, где он застывает.
Ферритный метод
Ферритный метод получения гидроксида натрия состоит из двух этапов:
Na2СО3 + Fe2О3 = 2NaFeО2 + СО2
2NaFeО2 + xH2О = 2NaOH + Fe2O3*xH2О
Реакция 1 представляет собой процесс спекания кальцинированной соды с окисью железа при температуре 1100—1200 °С. Помимо этого образуется спек — феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции 2; получается раствор гидроксида натрия и осадок Fe2O3*xH2О, который после отделения его от раствора возвращается в процесс. Получаемый раствор щелочи содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % масс. NaOH, а после получают твёрдый продукт в виде гранул или хлопьев.
Электрохимические методы получения гидроксида натрия
Электрохимически гидроксид натрия получают электролизом растворов галита (минерала, состоящего в основном из поваренной соли NaCl) с одновременным получением водородаихлора. Этот процесс можно представить суммарной формулой:
2NaCl + 2H2О ±2е- → H2 + Cl2 + 2NaOH
Едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них — электролиз с твёрдым катодом (диафрагменный и мембранный методы), третий — электролиз с жидким ртутным катодом (ртутный метод).
В мировой производственной практике используются все три метода получения хлора и каустика с явной тенденцией к увеличению доли мембранного электролиза.
7. Очистка сернистого газа от каталитических ядов.
Газообразные выбросы очень неблагоприятно влияют на экологическую обстановку в местах расположения этих промышленных предприятий, а также ухудшают санитарно-гигиенические условия труда. К агрессивным массовым выбросам относятся окислы азота, сероводород, сернистый, углекислый и многие другие газы.
Например, азотнокислотные, сернокислотные и другие заводы нашей страны ежегодно выбрасывают в атмосферу десятки миллионов кубометров окислов азота, представляющих собой сильный и опасный яд. Из этих окислов азота можно было бы выработать тысячи тонн азотной кислоты.
Не менее важной задачей является очистка газов от двуокиси серы. Общее количество серы, которое выбрасывается в нашей стране в атмосферу только в виде сернистого газа, составляет около 16 млн. т. в год. Из этого количества серы можно выработать до 40 млн. т. серной кислоты.
Значительное количество серы, главным образом, в виде сероводорода содержится в коксовом газе.
Серосодержащий газ, используемый в металлургической промышленности для обогрева мартеновских и нагревательных печей, вызывает угар металла и повышает содержание серы и стали, ухудшая ее качество. Потери металла при этом исчисляются сотнями тысяч тонн в год.
С дымовыми газами из заводских труб и энергетических установок ежегодно выбрасываются в атмосферу несколько миллиардов кубометров углекислого газа. Этот газ может быть использован для получения эффективных углеродсодержащих удобрений.
Приведенные примеры показывают, какие огромные материальные ценности выбрасываются в атмосферу с газообразными выбросами.
Но более серьезный ущерб эти выбросы приносят тем, что они отравляют воздушный бассейн в городах и на предприятиях: ядовитые газы губят растительность, крайне вредно действуют на здоровье людей и животных, разрушают металлические сооружения и коррозируют оборудование.
Хотя в последние годы отечественные промышленные предприятия работают не на полную мощность, но проблема борьбы с вредными выбросами стоит очень остро. А учитывая общую экологическую обстановку на планете, необходимо принять самые срочные и самые радикальные меры по очистке выбросных газов от вредных примесей.
Каталитические яды
контактные яды, вещества, вызывающие «отравление» катализаторов (См. Катализаторы) (обычно гетерогенных), т. е. снижающие их каталитическую активность или полностью прекращающие каталитическое действие. Отравление гетерогенных катализаторов происходит в результате адсорбции яда или продукта его химического превращения на поверхности катализатора. Отравление может быть обратимым или необратимым. Так, в реакции синтеза аммиака на железном катализаторе кислород и его соединения отравляют Fe обратимо; в этом случае при воздействии чистой смеси N2 + H2 поверхность катализатора освобождается от кислорода и отравление снижается. Соединения серы отравляют Fe необратимо, действием чистой смеси не удается восстановить активность катализатора. Для предотвращения отравления реагирующую смесь, поступающую на катализатор, подвергают тщательной очистке. К числу наиболее распространенных К. я. для металлических катализаторов относятся вещества, содержащие кислород (H2O, CO, CO2), серу (H2S, CS2, C2H2SH и др.), Se, Te, N, Р, As, Sb, а также непредельные углеводороды (C2H4, C2H2) и ионы металлов (Cu2+, Sn2+, Hg2+, Fe2+, Co2+, Ni2+). Кислотные катализаторы обычно отравляются примесями основании, а основные — примесями кислот.
8. Получение нитрозных газов.

Выделившиеся после отбеливания оксиды азота конденсируются в водяном и рассольном конденсаторах и используются для приготовления сырой смеси. Поскольку температура кипения N2O4 составляет 20,6 °С при давлении 0,1 МПа, в этих условиях газообразный NO2 может быть полностью сконденсирован (давление насыщенных паров N2O4 при 21,5 °С над жидким N2O4 равно 0,098 МПа, т.е. меньше атмосферного). Другим способом получения жидких оксидов азота является конденсация их под давлением и при пониженной температуре. Если вспомнить, что при контактном окислении NH3 при атмосферном давлении концентрация оксидов азота составляет не более 11 % об., их парциальное давление соответствует 83,5 мм рт.ст. Давление же оксидов азота над жидкостью (упругость паров) при температуре конденсации (–10 °С) равно 152 мм рт.ст. Это означает, что без повышения давления конденсации жидкие оксиды азота получить из этих газов нельзя, следовательно, конденсация оксидов азота из такого нитрозного газа при температуре –10 °С начинается при давлении 0,327 МПа. Степень конденсации резко возрастает с увеличением давления до 1,96 МПа, при дальнейшем росте давления степень конденсации изменяется незначительно.
Переработка нитрозного газа (т.е. после конверсии NH3) в жидкие оксиды азота малоэффективна, т.к. даже при Р=2,94 МПа степень конденсации составляет 68,3 %.
В условиях конденсации чистого N2O4, охлаждение не следует вести ниже температуры –10 °С, т.к. при –10,8 °С N2O4 кристаллизуется. Наличие примесей NO, NO2, Н2О снижает температуру кристаллизации. Так смесь, имеющая состав N2O4+5 % N2O3, кристаллизуется при –15,8 °С.
Полученные жидкие оксиды азота хранят в стальных резервуарах.
9. Получение простого и двойного суперфосфата
'Суперфосфат' — смесьCa(H2PO4)2*H2O и CaSO4. Наиболее распространённое простое минеральное фосфорное удобрение. Фосфорв суперфосфате присутствует в основном в видемонокальцийфосфатаи свободнойфосфорной кислоты. Удобрение содержитгипси др.примеси(фосфатыжелезаиалюминия,кремнезём, соединенияфтораи др.). Получают простой суперфосфат изфосфоритов, обрабатывая ихсерной кислотой, по реакции:
Са3 (РО4)2 + 2H2SO4 = Са(H2PO4)2 + 2CaSO4.
Простой суперфосфат — серый порошок, почти не слёживаемый, среднерассеиваемый; в удобрении 14-19,5 % усваивамаемый растениями P2O5. Сущность производства простого суперфосфата состоит в превращении природного фторапатита, нерастворимого в воде и почвенных растворах, в растворимые соединения, преимущественно в монокальцийфосфат Са(Н2РО4)2 . Процесс разложения может быть представлен следующим суммарным уравнением:
2Ca5F(PO4)3+7H2SO4+3H2O=3Са(Н2РО4)2*Н2О]+7[CaSO4*0,5H2O]+2HF; (1) ΔН= - 227,4кДж .
Практически в процессе производства простого суперфосфата разложение протекает в две стадии. На первой стадии около 70% апатита реагирует с серной кислотой. При этом образуются фосфорная кислота и полугидрат сульфата кальция:
Ca5F(PO4)3+5H2SO4 +2,5H2O = 5(CaSO4*0,5H2O) +3H3PO4 +HF (2)
Функциональная схема получения простого суперфосфата представлена на рис. Основные процессы проходят на первых трех стадиях: смешения сырья, образования и затвердевания суперфосфатной пульпы, дозревания суперфосфата на складе.
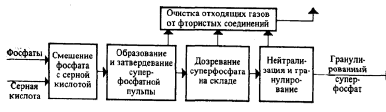
Рис. Функциональная схема производства простого суперфосфата
Для получения товарного продукта более высокого качества суперфосфат после дозревания подвергают нейтрализации твердыми добавками (известняком, фосфоритной мукой и т. п.) и гранулируют.
Двойной суперфосфат — концентрированное фосфорное удобрение. Основной фосфорсодержащий компонент — моногидрат дигидроортофосфата кальцияCa(H2PO4)2•H2O. Обычно содержит также другие фосфаты кальция и магния. По сравнению с простым фосфатом не содержит балласта — CaSO4. Главное преимущество двойного суперфосфата — малое количество балласта, то есть это сокращает транспортные расходы, затраты на хранение, тару
Двойной суперфосфат производят действием серной кислоты Н2SО4 на природные фосфаты. В России применяют главным образом поточный способ: разложение сырья с последующим гранулированием и высушиванием полученной пульпы в барабанном грануляторе-сушилке. Товарный двойной суперфосфат с поверхности нейтрализуют мелом или NH3 для получения стандартного продукта. Некоторое количество двойного суперфосфата вырабатывают камерным способом. Фосфорсодержащие компоненты в основном те же, что и в простом суперфосфате, но в большем количестве, а содержание CaSO4 составляет 3-5 %. При нагревании выше 135—140 °C двойной суперфосфат начинает разлагаться и плавиться в кристаллизационной воде, после охлаждения становится пористым и хрупким. При 280—320 °C ортофосфаты переходят в мета-,пиро- иполифосфаты, которые находятся в усвояемой и частично водорастворимой формах. Он плавится при 980 °C, превращаясь после охлаждения в стекловидный продукт, в котором 60-70 % метафосфатов цитраторастворимы. Двойной Суперфосфат содержит 43-49 % усвояемого фосфорного ангидрида (пятиокиси фосфора) Р2О5 (37-43 % водорастворимого), 3,5-6,5 % свободной фосфорной кислоты Н3РО4 (2,5-4,6 % Р2О5):
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
Также есть метод разложения фосфоросодержащего сырья фосфорной кислотой:
Ca5(PO4)3F + 7H3PO4 = 5Ca(H2PO4)2 + HF
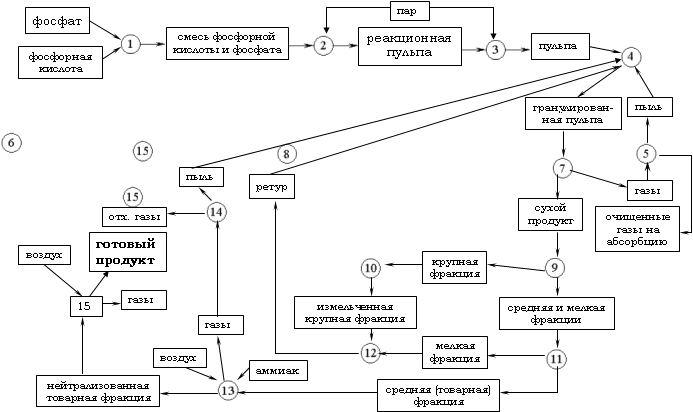
Блок-схема технологического процесса производства двойного суперфосфата: 1 - смешение измельченного фосфорита и фосфорной кислоты; 2 - разложение фосфорита I ступени; 3 - разложение фосфорита II ступени; 4 - гранулирование пульпы; 5 - очищение фосфорсодержащих газов от пыли; 6 - сушка гранул пульпы; 7 - получение топочных газов (в топке); 8 - грохочение сухого продукта; 9 - измельчение крупной фракции; 10 - отделение мелкой и средней (товарной) фракции на втором грохоте; 11 - смешение измельченной крупной фракции и мелкой; 12 - аммонизация (нейтрализация) остаточной фосфорной кислоты; 13 - очищение газов, содержащих аммиак и пыль; 14 - охлаждение нейтрализованной товарной фракции двойного суперфосфата;
10.Получение экстракционной ортофосфорной кислоты
Получение экстракционной фосфорной кислоты
Непосредственно перед получением ЭФК, получают фосфор по специальной технологии

Рис 1. Схема производства фосфора: 1 — бункеры сырья; 2 — смеситель; 3 — кольцевой питатель; 4 — бункер шихты; 5 — электропечь; 6 — ковш для шлака; 7 — ковш для феррофосфора; 8 — электрофильтр; 5 — конденсатор; 10 — сборник жидкого фосфора; 11 — отстойник
Экстракционный
способ (позволяет производить наиболее
чистую фосфорную кислоту) включает
основные стадии: сжигание (окисление)
элементного фосфора в избытке воздуха,
гидратацию и абсорбцию полученного
P4O10 , конденсацию фосфорной кислоты и
улавливание тумана из газовой фазы.
Существуют два способа получения P4O10:
окисление паров P (в промышленности
используют редко) и окисление жидкого
P в виде капель или пленки. Степень
окисления P в промышленных условиях
определяется температурой в зоне
окисления, диффузией компонентов и
другими факторами. Вторую стадию
получения термической фосфорной кислоты-
гидратацию P4O10 - осуществляют абсорбцией
кислотой (водой) либо взаимодействием
паров P4O10 с парами воды. Гидратация
(P4O10 + 6H2O![]() 4H3PO4) протекает через стадии образования
полифосфорных кислот. Состав и концентрация
образующихся продуктов зависят от
температуры и парциального давления
паров воды.
4H3PO4) протекает через стадии образования
полифосфорных кислот. Состав и концентрация
образующихся продуктов зависят от
температуры и парциального давления
паров воды.
Все стадии процесса совмещены в одном аппарате, кроме улавливания тумана, которое всегда производят в отдельном аппарате. В промышленности обычно используют схемы из двух или трех основных аппаратов. В зависимости от принципа охлаждения газов существуют три способа производства термической фосфорной кислоты: испарительный, циркуляционно-испарительный, теплообменно-испарительный.
Испарительные системы, основанные на отводе теплоты при испарении воды или разбавленной фосфорной кислоты, наиболее просты в аппаратурном оформлении. Однако из-за относительно большого объема отходящих газов использование таких систем целесообразно лишь в установках небольшой единичной мощности.
Циркуляционно-испарительные системы позволяют совместить в одном аппарате стадии сжигания P, охлаждения газовой фазы циркулирующей кислотой и гидратации P4O10. Недостаток схемы - необходимость охлаждения больших объемов кислоты. Теплообменно-испарительные системы совмещают два способа отвода теплоты: через стенку башен сжигания и охлаждения, а также путем испарения воды из газовой фазы; существенное преимущество системы - отсутствие контуров циркуляции кислоты с насосно-холодильным оборудованием.
На отечественных предприятиях эксплуатируют технологические схемы с циркуляционно-испарительным способом охлаждения (двухбашенная система). Отличительные особенности схемы: наличие дополнительной башни для охлаждения газа, использование в циркуляционных контурах эффективных пластинчатых теплообменников; применение высокопроизводительной форсунки для сжигания P, обеспечивающей однородное тонкодисперсное распыление струи жидкого P и полное его сгорание без образования низших оксидов.
Технологическая схема установки мощностью 60 тыс. т в год 100%-ной H3PO4 приведена на рис. 2. Расплавленный желтый фосфор распыляется нагретым воздухом под давлением до 700 кПа через форсунку в башне сжигания, орошаемой циркулирующей кислотой. Нагретая в башне кислота охлаждается оборотной водой в пластинчатых теплообменниках. Продукционная кислота, содержащая 73-75% H3PO4, отводится из контура циркуляции на склад. Дополнит, охлаждение газов из башни сжигания и абсорбцию кислоты производят в башне охлаждения (гидратации), что снижает послед, температурную нагрузку на электрофильтр и способствует эффективной очистке газов. Отвод теплоты в башне гидратации осуществляется циркулирующей 50%-ной H3PO4, охлаждаемой в пластинчатых теплообменниках. Газы из башни гидратации после очистки от тумана H3PO4 в пластинчатом электрофильтре выбрасываются в атмосферу. На 1 т 100%-ной H3PO4 расходуется 320 кг P.
Рис. 2. Циркуляционная двухбашенная схема производства экстракционной H3PO4: 1 - сборник кислой воды; 2 - хранилище фосфора; 3,9 - циркуляционные сборники; 4,10 - по-гружные насосы; 5,11 - пластинчатые теплообменники; 6 - башня сжигания; 7 - фосфорная форсунка; 8 -башня гидратации; 12 - электрофильтр; 13 - вентилятор.
11. Катализаторы окисления сернистого газа в серный ангидрид. Контактирование
Серный ангидрид получается при окислении сернистого газа кислородом воздуха:
2SO2 + O2 ↔ 2SO3,
Это обратимая реакция.
Уже давно было замечено, что окись железа, пятиокись ванадия и особенно мелко раздробленная платина ускоряют реакцию окисления сернистого газа в серный ангидрид. Эти вещества являются катализаторами реакции окисления сернистого газа. Так, например, при 400° С в присутствии платинированного асбеста (т. е. асбеста, на поверхность которого нанесена мелко раздробленная платина) почти 100% сернистого газа окисляется кислородом воздуха в серный ангидрид. При более высокой температуре выход серного ангидрида уменьшается, так как ускоряется обратная реакция — реакция разложения серного ангидрида на сернистый газ и кислород. При 1000° С серный ангидрид почти нацело разлагается на исходные вещества. Таким образом, основными условиями осуществления синтеза серного ангидрида являются применение катализаторов и нагревание до определенной, не слишком высокой температуры.
Синтез серного ангидрида требует соблюдения также еще двух условий: сернистый газ должен быть очищен от примесей, которые тормозят действие катализаторов; сернистый газ и воздух должны быть высушены, так как влага снижает выход серного ангидрида.