
ЧАСТЬ 1
.pdfКаждая молекула газа участвует в двух движениях: хаотическом тепловом со
средней скоростью u и упорядоченном движении со скоростью V. Вследствие хаотического теплового движения происходит непрерывный переход молекул из одного слоя в другой
Попав в другой слой, молекула сталкивается с молекулами этого слоя, в результате чего она либо отдает избыток своего импульса другим молекулам (если она прилетела из слоя, движущегося с большей скоростью), либо увеличивает свой импульс за счет других молекул (если она прилетела из слоя, движущегося с меньшей скоростью). В итоге импульс более быстро движущегося слоя убывает, а более медленно движущегося возрастает. Слои ведут себя так, как если бы к первому слою (скорость которого больше) была приложена тормозящая его движение сила, а ко второму слою (скорость которого меньше) – такая же по величине ускоряющая сила.
Теория метода
Для измерения коэффициента динамической вязкости воздуха в данной работе используется метод Пуазейля (метод основан на определении скорости
истечения жидкости или газа через капилляр). Если открыть кран К 1 , то
вследствие вытекания воды из баллона давление воздуха будет уменьшаться и в него будет через капилляр засасываться воздух. Объем V газа, протекающего через капиллярную трубку радиуса r за время t, определяется по формуле Пуазейля:
V |
r 4 Pt |
|
|
8 |
, |
||
|
|||
где - коэффициент внутреннего трения или динамическая вязкость газа, |
|||
- длина капилляра, - разность давлений на его концах |
|||
gh |
|
||
Здесь g – ускорение свободного падения, h – разность столбов жидкости в
манометре, - плотность воды (1000 |
кг |
) |
|
|
|
|
|||
|
|
м3 |
|
|
Из этой формулы получается выражение для : |
||||
|
r 4 t |
|
||
|
8 V |
(1) |
||
|
|
|||
|
|
|
||
Здесь все величины доступны измерению, что позволяет экспериментально |
|||||||
определять коэффициент внутреннего трения. |
|
||||||
|
|
|
|
|
|
||
Коэффициент внутреннего трения связан со средней длиной свободного |
|||||||
|
|
|
|
|
|
|
|
пробега молекул, плотностью газа и средней арифметической скоростью |
|||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
||||
молекул газа соотношением: |
|
|
V |
(2) |
|||
3 |
|||||||
|
|
|
|
|
|
||
|
|
|
33 |
|
|
|
|
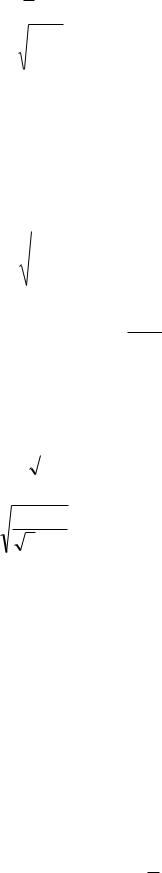
Средняя арифметическая скорость V молекул определяется по формуле:
|
|
|
8RT |
|
|
V |
(3) |
||||
|
|||||
|
|||||
|
|
|
|
||
Плотность газа можно найти, воспользовавшись уравнением состояния газа:
PV |
m |
RT, отсюда |
|
P |
, (4) |
|
|
|
|
||||
|
|
|
RT |
|
||
где P и T – давление и температура газа.
Решая совместно уравнения (2), (3) и (4), получим формулу для расчета
средней длины свободного пробега молекул газа:
|
3 |
|
RT |
|
|
|
|
8 |
, (5) |
P |
|
|||
|
|
|
где R – универсальная газовая постоянная;
- молярная масса газа (для воздуха 29 10 3 молькг );
P – давление газа (в условиях данной задачи его можно считать равным 10 5 Па)
Из молекулярно-кинетической теории известно, что
|
|
kT |
||
|
|
|
||
|
|
|
||
2 2 P |
||||
|
|
|||
Отсюда найдем эффективный диаметр молекулы газа:
|
kT |
, (6) |
|
2 P |
|||
|
где k – постоянная Больцмана.
Порядок выполнения работы.
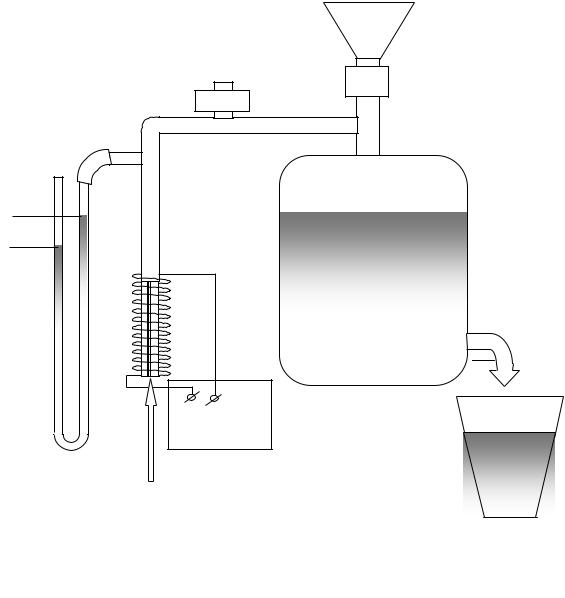
1.Открыть кран К 1 , подставив под него запасной стаканчик, и выждать пока установится стационарное течение (при этом разность уровней в манометре будет постоянной.
2.Измерить эту разность уровней h 1 .
3.Заменить запасной стаканчик мерным, включить секундомер и измерить время заполнения мерного стаканчика (50 или 100 см 3 ).
4.Снова измерить разность уровней h 2 в манометре.
5.По формулам (1), (5) и (6), используя программу, рассчитать коэффициент
внутреннего трения, среднюю длину свободного пробега и эффективный диаметр молекул газа.
34
6.Опыт повторить 3 раза.
7.Результаты измерений и вычислений занести в таблицу.
8.Включив нагреватель (с разрешения преподавателя), повторить пункты (1-5) при температурах выше комнатной.
Схема установки
К2 |
К3 |
|
h 
 К1
К1
Источник
питания
V
Капилляр
Рис.1
35
Таблица
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ |
Т |
V |
t |
|
r |
h 1 |
h |
2 |
|
|
|
|
σ |
σ |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы.
1.Объясните механизм возникновения силы внутреннего трения в газе. 2.Запишите и поясните закон Ньютона.
3.В чем состоит метод Пуазейля, запишите и поясните формулу Пуазейля. 4.Дайте определения коэффициента внутреннего трения, средней длины свободного пробега и эффективного диаметра молекул газа?
5.От чего зависит коэффициент внутреннего трения газа?
Литература
1.Савельев И.В. “Курс общей физики”, Т.1
2.Шубин А.С. “Курс общей физики”
3.Грабовский Р.П. “Курс физики”
36

ЛАБОРАТОРНАЯ РАБОТА № 8
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ
ГАЗА |
СP |
МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ. |
|
||
|
CV |
|
Приборы и принадлежности: стеклянный баллон, манометр, насос.
Цель работы: определение показателя адиабаты (коэффициента Пуассона)
методом Клемана-Дезорма для воздуха.
Теория метода и описание установки.
Удельной теплоемкостью С газа называется скалярная физическая величина, численно равная количеству теплоты Q, которое необходимо сообщить единице массы газа, чтобы увеличить его температуру на 1 К:
C |
Q |
|
|
m T (1) |
|||
|
|||
Величина теплоемкости газов зависит от условий нагревания. Выясним эту зависимость, воспользовавшись первым законом термодинамики, который гласит: количество теплоты Q, сообщенное системе, затрачивается на увеличение ее внутренней энергии U и на работу А, совершаемую системой
против внешних сил
Q U A (2)
При изохорическом (V=const) нагревании газа V 0 , следовательно, и А=0. Тогда все подводимое к газу тепло идет на увеличении его внутренней энергии:
Q U
Из формулы (1) следует, что
CV U (3) m T
При изобарном (Р=const) нагревании газа тепло, сообщаемое газу идет и на увеличение внутренней энергии и на совершение газом работы против внешних сил:
|
|
|
|
Q U A , |
поэтому Cp |
U A |
|
|
|
m T |
(4) |
|||
Сравнивая уравнения (3) и (4), получаем Cp Cv . |
||||
Отношение удельных |
теплоемкостей при постоянном давлении и при |
|||
постоянном объеме |
|
cp |
играет в термодинамике весьма важную роль. |
|
|
|
cv |
||
|
|
|
|
|
|
|
|
|
37 |
В частности оно входит в уравнение Пуассона, которое описывает адиабатическое расширение газа
V const |
(5) |
В данной работе прелагается один из самых простых методов определения C p -
Cv
метод Клемана и Дезорма. Адиабатическим процессом называется процесс, протекающий без теплообмена с окружающей средой, т.е. считается, что процесс передачи тепла системе от окружающей среды отсутствует.
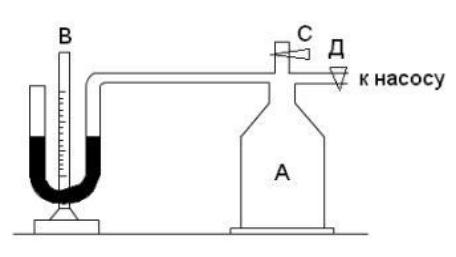
Экспериментальная установка состоит из стеклянного баллона А (рис. 1), соединенного с манометром В и с насосом.
Рис. 1
Если про помощи насоса накачать в баллон некоторое количество воздуха, то давление и температура воздуха внутри баллона повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха, находящегося в баллоне, сравнятся с температурой внешней среды T1 .
Давление, установившееся в баллоне
P1 P вН ,
где Р - атмосферное давление; Н - разность уровней жидкости в манометре;
В - коэффициент перехода от разности уровней к давлению.
Таким образом, состояние воздуха внутри баллона, которое назовем 1 состоянием, характеризуется параметрами
P P вН ; V и T
1 1 1
Если на короткое время открыть кран С, то воздух в баллоне будет расширяться. Этот процесс расширения можно считать адиабатическим. Давление в баллоне установится равным атмосферному Р, температура газа понизится до T 2
, а объем будет равен V 2 .
Следовательно, в конце адиабатического процесса, что назовем 2 состоянием, параметры состояния газа будут Р; V 2 ,T 2 .
38

Применяя к 1 и 2 состояниям уравнение (5), получим:
(P вН ) V |
PV |
или |
( |
V 1 |
) |
P |
(6). |
|
|||||||
|
|
||||||
1 |
2 |
|
|
V2 |
P вН |
|
|
|
|
|
|
|
|||
Охладившийся при адиабатическом расширении воздух в баллоне через некоторое время вследствие теплообмена нагреется до температуры внешней среды T1 , давление возрастет до некоторой величины
P2 P вh ,
где h- новая разность уровней в манометре.
Объем воздуха не изменится и будет равен V2 .
Это состояние воздуха, которое назовем 3 состоянием, характеризуется параметрами
P2 P вh ; V2 ; T1
Так как в состояниях 1 и 3 воздух имеет одну и ту же температуру T1 (процесс изотерический), то, применяя закон Бойля-Мариотта (PV=const), получим:
(P+вH)V1 (P+вh)V2
V1 |
|
P вh |
|
V2 |
P вH |
||
|
Возведем обе части уравнения в степень : |
( |
V1 |
) |
( |
P вh |
|
) |
(7) |
|||
|
P вH |
||||||||||
|
|
V2 |
|
|
|
|
|
||||
Решая совместно уравнения (6) и (7), получим: |
|
P |
|
( |
|
Р вh |
|
) |
|
||
P вН |
P вH ) |
|
|
||||||||
|
|
|
|
|
|||||||
Логарифмируя это выражение и решая относительно , находим
|
lg( P вН ) lg P |
|
|
lg( P вН ) lg( P вh) |
Так как давления Р, Р+вН и Р+вh мало отличаются друг от друга, то разности логарифмов можно принять пропорциональными разностям самих давлений и приближенно положить
|
P вН P |
|
|
вН |
|
|
|
|
|||
(P вН ) (Р вh) |
в(Н h) |
||||
|
|
H |
(8) |
|
|
|
|
|
|||
|
H h |
|
|||
Таким образом, экспериментальное определение C p сводится к измерению H и
Cv
h, то есть формула (8) является расчетной формулой для определения коэффициента Пуассона
39
Порядок выполнения работы
1.Открыть кран Д, при закрытом кране С накачать воздух в баллон так, чтобы разность уровней жидкости в манометре составила 30-40 мм.
2.Закрыть кран Д и выждать 2-3 минуты, пока благодаря теплообмену температура в баллоне не станет равной комнатной, и уровни в коленах манометра перестанут изменяться.
3.Отсчитать разность уровней Н жидкости в коленах манометра.
4.Открыть кран С и в тот момент, когда уровни жидкости обоих коленах манометра сравняются, быстро закрыть кран С.
5.Выждать 2-3 минуты пока газ, охлажденный про адиабатическом расширении, нагреется до комнатной температуры T1 и отсчитать разность
уровней h жидкости в коленах манометра.
6.По формуле (8) вычислить значение .
7.Опыт повторить 5-7 раз, меняя величину Н.
Все полученные опытом (и вычислением) результаты измерений занести в таблицу отчета.
|
|
|
Таблица |
|
|
|
|
|
|
|
|
|
|
№ |
H, мм |
h, мм |
|
|
ИСТ |
E, % |
опыта |
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Что называется удельной теплоемкостью?
2.Запишите и сформулируйте I начало термодинамики
3.Почему C p Cv ?
4.Какой процесс называется адиабатическим? Запишите уравнение Пуассона.
5.Почему температура газа при адиабатном расширении уменьшается?
40
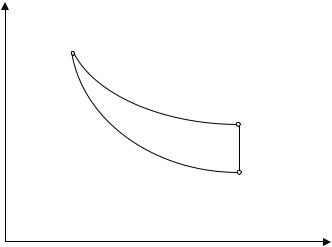
P
1(P1 ,V1 ,T1 )
3(P 2 ,V 2 ,T1 )
2(P,V 2 ,T 2 )
V
Рис. 2
Литература
1.Шубин А.С. Курс общей физики.
2.Савельев И.В. Курс физики, т.1
3.Детлаф А.А., Яворский Б.М. Курс физики, т.1.
41
ЛАБОРАТОРНАЯ РАБОТА № 9
ОПРЕДЕЛЕНИЕ ПРИРАЩЕНИЯ ЭНТРОПИИ ПРИ НАГРЕВАНИИ И ПЛАВЛЕНИИ ОЛОВА.
Приборы и принадлежности:
1.тигель с оловом, смонтированный в микроэлектропечи;
2.термопара;
3.сосуд с маслом;
4.милливольтметр;
5.градуировочный график термопары;
6.автотрансформатор и амперметр.
Цель работы: определение приращения энтропии при фазовом переходе первого рода на примере плавления олова.
Теория метода и описание установки
В середине прошлого века было сделано существенное открытие, касающееся обратимых термодинамических процессов. Оказалось, что наряду с внутренней энергией у тела имеется еще одна замечательная функция состояния – энтропия. Если тело или система при бесконечно малом переходе из одного состояния в
другое при температуре Т получает тепло dQ, то отношение |
dQ |
|
T |
||
|
полным дифференциалом некоторой функции S. Эта функция и есть определяющаяся одним из двух эквивалентных равенств:
является
энтропия,
|
dQ |
|
|
2 |
dQ |
|
|
|
|||
dS |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
T , |
T |
(1) |
|
|
|||||||
|
|
|
|
||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
Утверждение о существовании |
функции, |
дифференциал которой есть |
dQ |
, |
|||||||
T |
|||||||||||
|
|
|
|
|
|
|
|
|
|
||
носит название принципа существования энтропии и является одним из важнейших законов природы.
Энтропия изолированной системы при любых происходящих в ней процессах не может убывать:
dS 0
Это утверждение носит название закона возрастания энтропии или второго начала термодинамики.
42
