
- •Донецкий национальный университет
- •ДонНуэт Донецк
- •Лекция № 1 Основные понятия и законы химии.
- •2. Относительная атомная масса, относительная молекулярная масса, моль, молярная масса.
- •3. Закон сохранения массы веществ.
- •4. Закон Авогадро
- •5. Эквивалент.
- •Лекция № 2
- •1.Строение атома.
- •Лекция № 3.
- •1.Строение атома и периодический закон д. И. Менделева Периодическая система.
- •2.Энергия ионизации и средство электронов.
- •Лекция № 4-5. Химическая связь.
- •2.Свойства ковалентной связи. Длинна связи. Энергия связи. Насыщаемость. Направленность.
- •3. Межмолекулярное взаимодействие.
- •Лекция № 6 основы химии, термодинамики. План
- •3. Понятия об энтропии и энергии Гиббса.
- •Лекция № 7 основы химической кинетики. План
- •1. Скорость химической реакции. Основной закон химической кинетики.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергетические активации.
- •4.Гомогенный и гетерогенный катализ.
- •5.Химическое равновесие.
- •6.Принцип Ле Шателье.
- •Лекция № 8 Растворы. План.
- •2. Разбавленые растворы не электролитов.
- •3. Растворы электролитов.
- •Лекция № 9 Комплексные соединения. План.
- •1. Строение кс.
- •2.Классификация комплексных соединений.
- •3. Характеристика диссоциации кс. Устойчивость комплексных ионов.
- •Лекция № 10 Окислительно восстановительные реакции. Электрохимические процессы. План.
- •4. Классификация окислительно-восстановительные реакций.
- •5. Гальванические элементы.
- •6.Электродный потенциал.
- •7. Химический источник тока.
- •8. Коррозия металлов.
- •Почвенная коррозия
- •Электрическая коррозия
- •Лекция № 11 оcновы органической химии.
- •Синтетические полимеры
- •Наиболее часто встречающиеся полимеры
2. Разбавленые растворы не электролитов.
Вещества которые расподаются на ионы в расплавах или растиорах называются электролитами, которые не росподаются называются не электролитами.
к электролитам относятся кислоты, основания соли, к не электролитам относятся почти все органические вещества. в разбавленных растворах не электролитов малекулы друг с другом не взаимодействуют, они ведут себя как идеальрые газы. например если в сосуд налить раствор сахарозы, а с верху слой чистой воды, то через некоторое время концентрация раствора сахарозы станет одинаковой во всем объеме, в результате диффузии молекул. такая диффузия диухсторонняя. если раствор сахарозы поместить в емкость из полупроницаемой мембраны (цилофан), то диффузия будет односторонней молекулы воды будут просачиваться в раствор сахарозы – это называется осмос.
Осмос – это односторонняя диффузия.
Осмотическое давление – это то давление которое необходимо приложить к раствору, чтобы прекратить осмос. Осмотическое давление растворенно пропорционально концентрации растворенного вещества и обсалютной температуре.
Закон Вант Гоффа: осмотическое давление розбавленного раствора равно тому газовому давлению, которое производило бы растворенное вещество если бы оно притой же температуре находилось в газообразном состоянии и занимало объем раствора.
π = cRT,
где с – концентрация в молях на метр. R – универсальная газовая постоянная. Т – абсолютная температура.
Давление. Пары растворов.
Пар находящийся в равновесии с жидкостью называется насыщенным. Жидкость закипает когда давление ее пара достигает внешнего атмосферного давления. При растворении не летучего вещества давление пара получающегося раствора всегда меньше давления пара чистого растворителя и растворителя над раствором называется понижением давления пара растворителя.
![]() –отн.
–отн.
Первый закон Рауля: относительное положение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Таким образом его относительному понижению давлению насыщенного пара растворителя над раствором можно определить М – молярную массу растворенного вещества на М0 – массу растворителя.
Криоскопия, эбуллиоскопия.
Температура кипения раствора всегда выше чем чистого растворителя, а температура замерзания раствора ниже чем температура замерзания растворителя.
∆t – это понижение температуры замерзания.
∆t¢ - это повышение температуры кипения.
Второй закон Рауля.
Повышение температуры кипения раствора прямо пропорционально его молельной концентрации.
∆t ¢= EC,
∆t = KC.
Понижение температуры замерзания прямо пропорционально его молельной концентрации. К – криоскопическая постоянная. Е – это эбуллиоскопическая постоянная.
Они зависят только от природы растворителяи не зависят от природы вещества. Их величины известны. Измерение ∆t называется криоскопией, а измерение ∆t ¢ называется эбуллиоскопией.
3. Растворы электролитов.
При изучении растворов электролитов оказалось, что они не подчиняются законам Рауля, Ван Гоффа. Чтобы распространить эти законы на растворы электролитов ввели газо-тонический коэффициент.
П=icRT, где і – это изотонический коэффициент, он показывает во сколько раз опытные величины больше теоретических. Если i=2 значит частиц в растворе электролита в 2 раза больше чем следовало ожидать, если в 3 то в 3 раза больше, в 4 то в 4 раза больше.
Чтобы объяснить эти отклонения, а также способность растворов электролитов проводить электрический ток. Шведский химик Аррениус предложил теорию электролитической диссоциации:
электролиты при растворении в воде распадаются на ионы;
под действием тока, катионы движутся к катоду, анионы к аноду;
диссоциация процесс обратимый, обратный процесс ассоциация.
Кислотами в свете теории электролитической диссоциации называются электролиты, которые при диссоциации образуют в качестве катионов только ионы Н+.
Основность кислоты - это количество ионов водорода, которая может образовать при диссоциации.
![]()

![]()

![]()

Основания в свете теорию электролитической диссоциации - это вещества которые при диссоциации образуют ионы гидрокса.
![]()

![]()

Соли в свете теорию электролитической диссоциации - это вещества которые при диссоциации образуют катион металла и ион кислотного остатка.
![]()

![]()

![]()

![]()

![]()

Диссоциация характеризуется степенью диссоциации, где - отношение числа распавшихся молекул на общее число молекул.
![]()
природы растворителя;
природы растворенного вещества;
температуры;
концентрация раствора;
наличие одноименных ионов.
Сильные электролиты диссоциируют практически полностью. К ним относятся:
почти все растворимые соли;
сильные кислоты;
![]()
основания щелочных и щелочноземельных металлов.
Слабые электролиты диссоциируют частично. К ним относятся:
почти все органические кислоты;
слабые минеральные кислоты:
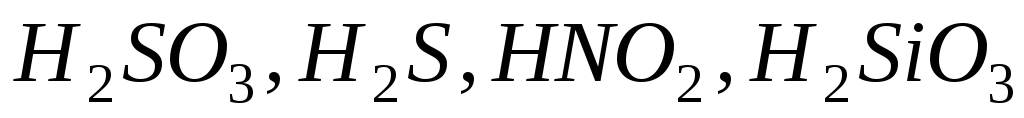
некоторые соли:
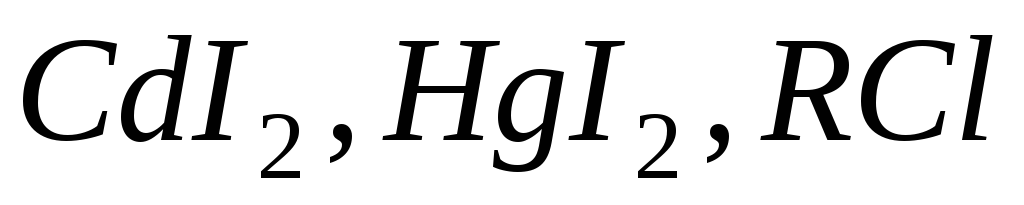
многие основания металлов, кроме сильных;
вода.
Ионные уравнения реакции.
Так как электролиты диссоциируют на ионы, то реакции между ними в растворе по суте являются реакциями между ионами.
![]()
![]()
![]()
Первая реакция в молекулярном виде. Вторая неполное уравнение реакции. Третье краткое ионное уравнение реакции. До конца идут реакции в четырех случаях:
- образование осадка;
- выделение газообразного вещества;
- образования малой диссоциирующего соединения;
- образования комплексного соединения.
Амфотерные электролиты - это электролиты которые при диссоциации образуют ионы H+ и ОН-.
Примером является вода и гидроксид аммония.
![]()
![]() –может
реагировать с кислотами и с щелочами.
–может
реагировать с кислотами и с щелочами.
![]()
Произведение растворимости.
Для количественной характеристики способность электролитов растворяться, используется произведение растворимости. Произведение растворимости - это произведение равновесных молярных концентраций в степенях равных стехиометрическим коэффициентам. В насыщенном растворе:

![]()
![]() <
ПРAgCl
– не
насыщенный.
<
ПРAgCl
– не
насыщенный.
![]() =
ПРAgCl
–
насыщенный.
=
ПРAgCl
–
насыщенный.
![]() >
ПРAgCl
–
перенасыщенный
(осадок выпадает).
>
ПРAgCl
–
перенасыщенный
(осадок выпадает).
Произведение растворимости - величена постоянная температуре (смотреть в справочнике).
Водородный показатель.
 Вода
это слабый электролит.Н2О
Н++
ОН–
Вода
это слабый электролит.Н2О
Н++
ОН–
Экспериментально установлено, что для воды произведение эти ионов равно 10-14. [ Н+] [ОН–] =10-14
Когда [ Н+] = 10-7 – среда нейтральная.
Если [ Н+] > 10-7 – среда кислая.
Если [ Н+] < 10-7 – среда щелочная.
Для количественной характеристики концентрация ионов водорода в растворе пользуются водородным показателем рН= десятичному логарифму концентрации ионов водорода взятому с обратным знаком. Таким образом, если рН<7 среда кислая, если рН =7 нейтральная, если рН>7 среда щелочная.
Для определения среды растворов пользуются индикаторами (фенолфтанол), при рН=8,2-10 приобретает красно-фиолетовый цвет. Метилоранж при рН=3,1– 4,4 приобретает красно-желтый цвет. Лакмус в слабо кислой среде приобретает красный цвет.
Буферные растворы - это растворы с определенной концентрации ионов водорода, которые незначительно изменяются при разбавлении, концентрировании, а также при добавлении небольших количеств кислот и щелочей. Типичный пример буферного раствора - это раствор белка, который во внутренних средах живых организмов рН на постоянном уровне (на определенных пределах).
Гидролиз солей.
Гидролизом называется взаимодействие ионов соли с водой приводящего к образованию слабого электролита. Гидролизу подвергаются соли образованные сильным основанием и слабой кислотой. При этом образуется щелочная среда и гидролиз идет по аниону.
Например: кислая соль гидрокарбонат натрия.
 І
ст.
І
ст.
![]()

![]()

![]()
Гидролиз идет по аниону.
 ІІ
ст.
ІІ
ст.![]()

![]()

![]()
Гидролизу также подвергаются соли образованные слабым основанием и сильной кислотой. В этом случае идет гидролиз по катиону и среда образуется кислая.
![]()

![]()
 -
соль основания
-
соль основания
![]()
 рН<7
среда кислая
рН<7
среда кислая
Гидролизу также подвергаются соли образованные слабым основанием и слабой кислотой. При этом среда может быть либо слабокислой, либо слабощелочной. Что зависит от сравнительной силы кислоты и основания.
Гидролизу не подвергаются соли образованные сильной кислотой и сильным основанием.
Гидролиз идет до конца в том случаи, если в результате образуется малорастворимое соединение (осадок) или выделяется газ.
