
- •Донецкий национальный университет
- •ДонНуэт Донецк
- •Лекция № 1 Основные понятия и законы химии.
- •2. Относительная атомная масса, относительная молекулярная масса, моль, молярная масса.
- •3. Закон сохранения массы веществ.
- •4. Закон Авогадро
- •5. Эквивалент.
- •Лекция № 2
- •1.Строение атома.
- •Лекция № 3.
- •1.Строение атома и периодический закон д. И. Менделева Периодическая система.
- •2.Энергия ионизации и средство электронов.
- •Лекция № 4-5. Химическая связь.
- •2.Свойства ковалентной связи. Длинна связи. Энергия связи. Насыщаемость. Направленность.
- •3. Межмолекулярное взаимодействие.
- •Лекция № 6 основы химии, термодинамики. План
- •3. Понятия об энтропии и энергии Гиббса.
- •Лекция № 7 основы химической кинетики. План
- •1. Скорость химической реакции. Основной закон химической кинетики.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергетические активации.
- •4.Гомогенный и гетерогенный катализ.
- •5.Химическое равновесие.
- •6.Принцип Ле Шателье.
- •Лекция № 8 Растворы. План.
- •2. Разбавленые растворы не электролитов.
- •3. Растворы электролитов.
- •Лекция № 9 Комплексные соединения. План.
- •1. Строение кс.
- •2.Классификация комплексных соединений.
- •3. Характеристика диссоциации кс. Устойчивость комплексных ионов.
- •Лекция № 10 Окислительно восстановительные реакции. Электрохимические процессы. План.
- •4. Классификация окислительно-восстановительные реакций.
- •5. Гальванические элементы.
- •6.Электродный потенциал.
- •7. Химический источник тока.
- •8. Коррозия металлов.
- •Почвенная коррозия
- •Электрическая коррозия
- •Лекция № 11 оcновы органической химии.
- •Синтетические полимеры
- •Наиболее часто встречающиеся полимеры
2.Свойства ковалентной связи. Длинна связи. Энергия связи. Насыщаемость. Направленность.
Длинна связи – определяется экспериментально, чем меньше длинна связи тем оно прочнее. Однако мерой прочности является энергия связи.
Энергия связи – количество энергии которая необходима для разрыва связи. С увеличением кратности энергия увеличивается, а длинна уменьшается.
Насыщаемость – это способность атомов образовывать ограниченное число ковалентных связей.
Направленность ковалентной связи обуславливает пространственную структуру молекулы.
Так например молекула HCl - линейна, молекула Н2О – нелинейная. Так как связь образована р элементами атома кислорода, облака которых расположены по осям ординат т. е. Под углом 90°. Таким образом их угол в молекуле Н2О должен быть 90°. Но в действительности 104°. В молекуле аммиака угол равен 107° 3', а молекула имеет вид пирамиды. Ковалентные связи образованные много валентными атомами и всегда имеют пространственную направленность. Между направлениям ковалентных связей образуется валентный угол.
Отклонение реального валентного угла от теоретического навело на мысль о существовании гибридизации.
BeCl2
2p
 4Be
1s2
2s2
2p0
2s2
- основное
состояние
Be.
4Be
1s2
2s2
2p0
2s2
- основное
состояние
Be.
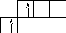
2s2 - два неспаренных электрона.
Ковалентная связь которая образуется при перекрывании облаков вдоль линии соединяющих центры называется сигма связью(δ- связь).
Ковалентная связь может быть полярной и не полярной. Полярная связь в молекуле Н2О, H2S, HCl, NH3.
Смещение связующего электронного облака в молекуле называется поляризацией.
Заряды атома в молекуле обозначается δ – это эфективный заряд. Количественной мерой полярности молекулы является электрический момент диполя. P = δ · l
l- длинна диполя, т. е. расстояние между центром тяжести положительних и отрицательных зарядов. Единицы измерения электрического момента диполя в СИ кулон\м.
В некоторых молекулах связь между атомами может быть полярной, а в целом молекула неполярная. Любую химическую связь можно изобразить в виде векторов, который направлен к более отрицательному атому. В том случае когда нам можно определить полярность молекулы, мы геометрически складываем эти векторы. Если геометрическая сумма векторов равна нулю - значит молекула неполярна, если не равна нулю – значит молекула полярна.



 О
С О О
О
С О О
 ∑ = 0 Н Н
∑ = 0 Н Н
∑≠ 0
Способность молекулы поляризоваться под действием внешнего электрического поля называется поляризуемостью.
Ионная связь – это связь обусловленная электростатическим притяжением между ионами. Ее еще называют электровалентной. Ионную связь образуют атомы имеющие большую разницу электроотрицательности, когда более электроотрицательный атом не просто смещает электронное облако на себя, а полностью забирает себе электрон, превращаясь при этом в отрицательно заряженный ион (анион). Атом который отдал свой электрон превращается в положительный заряженный ион (катион). Ионную связь можно считать крайнем случаем ковалентной полярной связью. Обычно ее образуют атомы элементов главных подгрупп, 1 и 2 группы, 6 и 7 группы. Например NaCl, NaBr, Na2S, KBr. Ковалентная полярная, неполярная и ионная связи отличаются значениями электрических моментов диполей р. Если р = 0 – неполярная связь. При р от 0 до 13·10-30 – полярная связь. При р больше 13·10-30 – ионная связь.
Металлическая связь осуществляется между атомами металлов, которые имеют один, два, три подвижных электрона на внешнем энергетическом уровне и свободные орбитали.
Например у Na 3s1 на s подуровне один электрон, р и d свободны. Li 2s1 p – пустой. Ca 4s2 2 – электрона, остальные уровни пустые. В результате чего электрон близ лежащих атомов металла обобществляются и превращаются в электронный газ, электроны при этом движутся по всем свободным орбиталям.
Металлической связью обусловлены физические свойства металла: высокая электропроводность, высокая теплопроводность, пластичность, и тд.
Водородная связь бывает внутримолекулярной и межмолекулярной. Она образуется между атомом водорода и более электроотрицательными атомами.
Вещества с межмолекулярной связью имеют аномально высокие температуры кипения.
