
- •Донецкий национальный университет
- •ДонНуэт Донецк
- •Лекция № 1 Основные понятия и законы химии.
- •2. Относительная атомная масса, относительная молекулярная масса, моль, молярная масса.
- •3. Закон сохранения массы веществ.
- •4. Закон Авогадро
- •5. Эквивалент.
- •Лекция № 2
- •1.Строение атома.
- •Лекция № 3.
- •1.Строение атома и периодический закон д. И. Менделева Периодическая система.
- •2.Энергия ионизации и средство электронов.
- •Лекция № 4-5. Химическая связь.
- •2.Свойства ковалентной связи. Длинна связи. Энергия связи. Насыщаемость. Направленность.
- •3. Межмолекулярное взаимодействие.
- •Лекция № 6 основы химии, термодинамики. План
- •3. Понятия об энтропии и энергии Гиббса.
- •Лекция № 7 основы химической кинетики. План
- •1. Скорость химической реакции. Основной закон химической кинетики.
- •2. Зависимость скорости реакции от температуры.
- •3. Энергетические активации.
- •4.Гомогенный и гетерогенный катализ.
- •5.Химическое равновесие.
- •6.Принцип Ле Шателье.
- •Лекция № 8 Растворы. План.
- •2. Разбавленые растворы не электролитов.
- •3. Растворы электролитов.
- •Лекция № 9 Комплексные соединения. План.
- •1. Строение кс.
- •2.Классификация комплексных соединений.
- •3. Характеристика диссоциации кс. Устойчивость комплексных ионов.
- •Лекция № 10 Окислительно восстановительные реакции. Электрохимические процессы. План.
- •4. Классификация окислительно-восстановительные реакций.
- •5. Гальванические элементы.
- •6.Электродный потенциал.
- •7. Химический источник тока.
- •8. Коррозия металлов.
- •Почвенная коррозия
- •Электрическая коррозия
- •Лекция № 11 оcновы органической химии.
- •Синтетические полимеры
- •Наиболее часто встречающиеся полимеры
Лекция № 9 Комплексные соединения. План.
Строение КС.
Основные классы и номенклатуры.
Характеристика диссоциации КС. Устойчивость комплексных ионов.
1. Строение кс.
Помимо традиционных соединений большую группу оставляют, так называемые комплексные или координационные соединения.
Например:
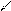

![]()
![]()
![]()
![]()
Комплексные соединения в результате диссоциации образует обычный ион и комплексный ион. Комплексный ион содержит центральный атом комплексообразователя. В определенной степени окисления.
Вокруг комплексного образования скоординированы полярные молекулы или ионы с противоположным зарядом, которые называются – лигандами.
В данном
случае лиганды
![]() ,
а во втором лиганды
,
а во втором лиганды![]() .
Количество лигандов расположенных
вокруг комплекса образования определяется
его координационным числом. Ионы которые
не вошли во внутреннюю сферу составляют
внешнюю сферу. Так напримерК+.
.
Количество лигандов расположенных
вокруг комплекса образования определяется
его координационным числом. Ионы которые
не вошли во внутреннюю сферу составляют
внешнюю сферу. Так напримерК+.
Типичными комплексообразователями являются катионы элементов: Ag+, Ca+2, Cu+2, Fe+2, Fe+3, Hr+3, Co+2 Которые имеют переходные от 8 к 18 электронам уровни свободные энергетические ячейки в последнем иногда в предпоследнем уровне. Комплексообразователями могут быть и другие ионы, которые в определенных условиях способны к комплексообразованию.
Например: Pb+2, Al+3
Важнейшими лигандами являются полярные молекулы H2O, NH3,COкислотные остаткиCN-, NO2-, Cl-, Br-, I-гидроксильные ионыOH-.
Заряд
комплексного иона равен алгебраической
сумме комплекса образователя и лигандов.
Суммарный заряд внешний сферы равенпо
величене, но противоположный по знаку
заряда комплексного иона.
![]()
Некоторые
комплексные соединения не имеют внешней
сферы
![]() .
.
2.Классификация комплексных соединений.
Важнейшими типами комплексных соединений являются:
- амина комплексы, они содержат качество
лигандов, молекулы аммиака
![]() – сульфаттетраамин меди
– сульфаттетраамин меди
- аква комплексы, лиганды молекулы воды
![]() –
сульфат аква меди.
–
сульфат аква меди.
- ацидоз комплексы, лиганды комплексные
остатки
![]() гексоцеаноферрат
калия.
гексоцеаноферрат
калия.
- гидроксо комплексы содержат в качестве
лигандов гидрооксидную группу
![]() гексогидроксоаллюминат
натрия.
гексогидроксоаллюминат
натрия.
3. Характеристика диссоциации кс. Устойчивость комплексных ионов.
При растворимости в воде комплексные электролиты полностью диссоциируют на комплексные ионы. Ионы составляющие внешнюю сферу – это первая стадия диссоциации.
Вторая стадия: диссоциация комплексного иона на ионы образования и лиганды.
![]()

![]()

Комплексный ион диссоциирует на ион меди и четыре молекулы аммиака.
Константы равновесия этих процессов называется константами не стойкости комплексных ионов Кн.
Чем больше константа нестойкости, тем легче диссоциация. Комплексные соединения, имеющие большое значение константы нестойкости практически полностью распадаются на ионы.
Лекция № 10 Окислительно восстановительные реакции. Электрохимические процессы. План.
Сущность процессов окисления восстановления.
Основные положения теории оислительно восстановительные реакции.
Эквивалент окислителя и восстаовителя.
Классификация окислительно восстановительные реакции.
Гальванические элементы.
Электродные потенциалы.
Химические источники тока.
Коррозия металла и защита от коррозии.
Сущность процессов окисления восстановления.
Все реакции подразделяются на реакции двух типов:
реакции которые идут без применения степени окисления на атомах
реакции которые идут с изменением степени окисления на атомах.
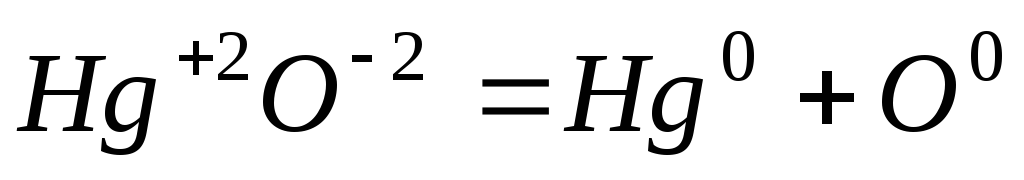
Реакции идущие с изменением степени окисления на атомах входящих в состав реагирующих веществ называются окислительно восстановительными.
Окислительно восстановительные реакции - это реакции в процессе которых происходит переход электронов от одних атомов молекул или ионов к дригим.
Основные положения теории окислительно-восстановительные реакции.
Окисления - это процесс отдачи электрона атома молекулой или ионом. Степень окисления при этом увеличивается.
Восстановление - это процесс присоединения электронов, степень окисления при этом уменьшается.
Атомы молекулы или ионы отдающие электроны называются восстановителями, а присоединяющие электроны окислителями. Так как атомы, молекулы или ионы входят в состав вещества то и эти вещества называются соответственно окислителями или восстановителями.
Окисление всегда сопровождается восстановлением и наоборот. Число электронов отдаваемых восстановителем равно числу электронов, присоединяемых окислителем.
Например:
![]()
![]()

Важнейшие окислители и восстановители.
Восстановители: металлы, водород Н2, углеродСи угольСО –оксид углерода,Н2S –сероводород, Na2S, SO2, H2SO3– сернистая кислота и ее соли,HCl, HBr, HI, SnCl2, FeCl2, FeSO4, MnSO4, HNO2, HN3,альдегиды, спирты, муравьиная и щавеливая кислота, глюкоза. Важнейшие окислители галогены:Mn2O7, MnO2, KmnO4, CrO3, K2CrO4, K2CrO7, HNO3, H2SO4, CuO, Ar2O, PbO2ионы благородных металлов:Ar+, FeCl3, гидпохлориды, хлораты, перхлораты, царская водка.
Эквивалент окислителя и восстаовителя.
Эквивалент окислителя - называют такое количество окислителя, которое присоединяет один моль электронов в данной окислительно восстановительные реакции.
Эквивалентная масса окислителя равна его молярной массе, деленной на число присоединенных одной молекулой окислителя выраженной в грамм молях. Соответственно определяется эквивалент и молярная масса эквивалента восстановителя
![]()
![]()
