
СеминарОбщаяНеорганическаяХимия / Задание-6-го-семинара-рН
.docЗадание 6-го семинарского занятия. Растворы электролитов
Расчет рН различных растворов.
-
Сильной кислоты: pH = -lg[H+] = -lgСн, где Сн или Сэк., СN -нормальная концентрация кислоты.
-
сильного основания: рН = 14 + lg[OH-] = 14 + lgСo, где Сo или Сэк., СN - нормальная концентрация основания.
-
слабой кислоты: . рН определяется диссоциацией слабой кислоты: рН= 0,5 рКк - 0,5 lgCк = -lg
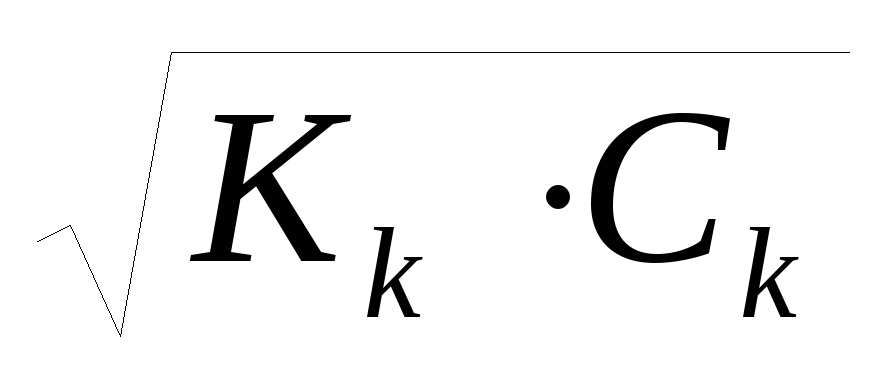 =
0,5 рКк
+ 0,5 pCk
=
=
0,5 рКк
+ 0,5 pCk
=
 рКк
+
рКк
+
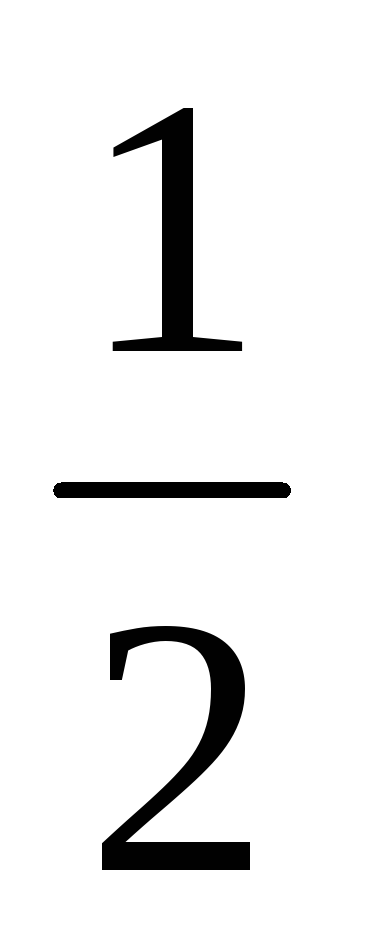 рСк, где
Cк
- молярная концентрация слабой кислоты,
pCк
= -lgCк.
Если кислота многоосновная (Н2СО3,
Н3РО4),
то учитывается только диссоциация по
первой стадии, так как диссоциация по
остальным стадиям меньше и поставляет
незначительное количество протонов.
рСк, где
Cк
- молярная концентрация слабой кислоты,
pCк
= -lgCк.
Если кислота многоосновная (Н2СО3,
Н3РО4),
то учитывается только диссоциация по
первой стадии, так как диссоциация по
остальным стадиям меньше и поставляет
незначительное количество протонов.
-
cлабого основания: рН = 14 – рОН = 14 – (-lg
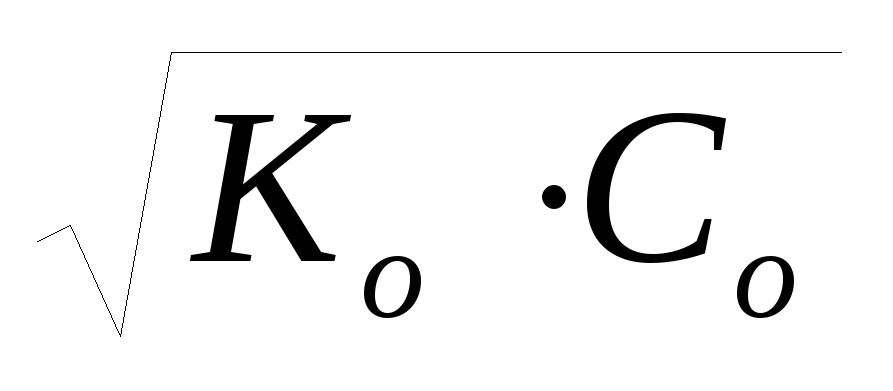 ),
так как рОН = -lg
),
так как рОН = -lg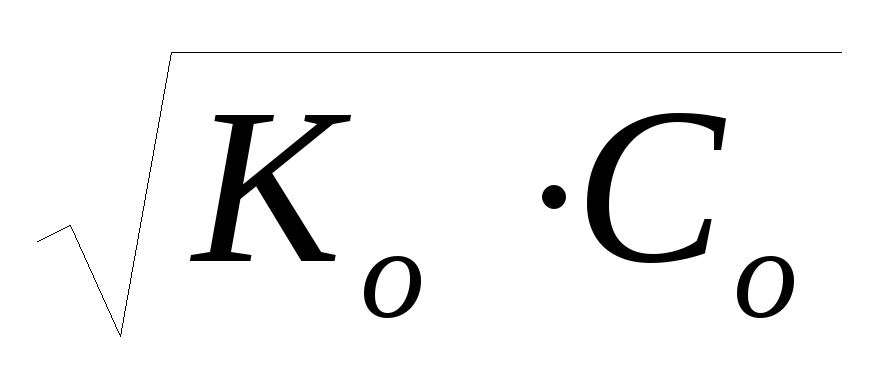
-
В растворе находится соль слабой кислоты и сильного основания. рН определяется гидролизом соли слабой кислоты: pH = 7 + 0,5 pKк + 0,5 . lgCсоли = 14 – рОН = 14 + lg
 .
Если кислота двухосновная, расчет вести
считая, что гидролиз идет только по
первой стадии.
.
Если кислота двухосновная, расчет вести
считая, что гидролиз идет только по
первой стадии. -
Соли сильной кислоты и слабого основания: pH = 7 - 0,5 pKосн. - 0,5 . lgCсоли = -lg
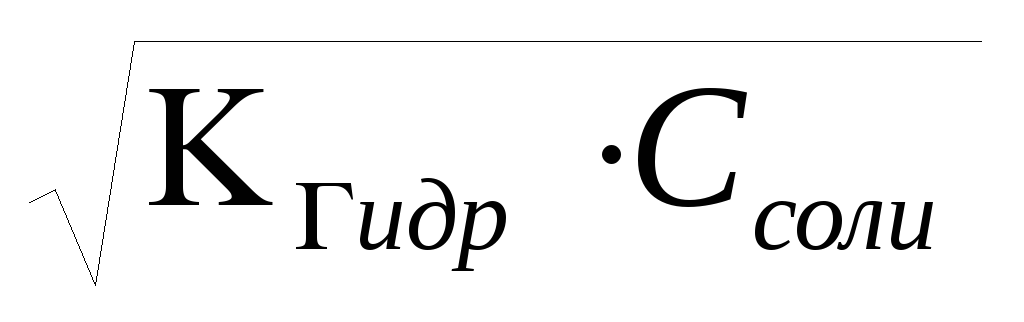 .
.
7) Соли сильной кислоты и сильного основания: рН = 7, так как гидролиз соли не протекает ни по аниону, ни по катиону и среда остается нейтральной.
-
Кислой буферной смеси, состоящей из слабой кислоты и ее соли: рН= -lg[H+] = -lg
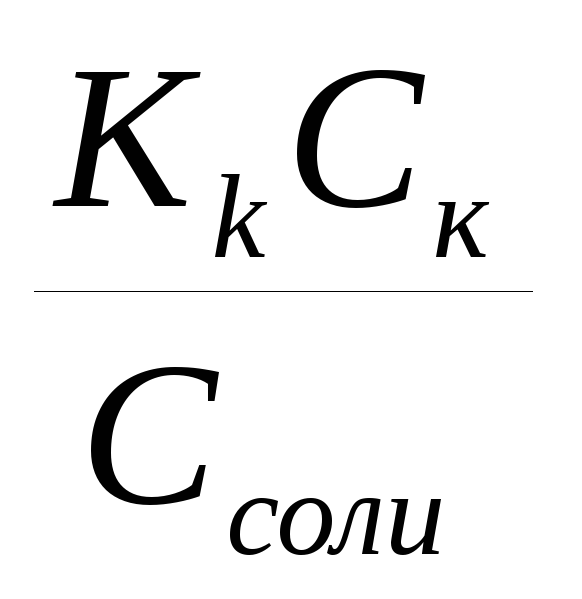 = -lgKk
– lg(Ck/Cсоли)
= рКк
- lg(Ck/Cсоли)
= рКк
– lgCk
+ lgСсоли.
= -lgKk
– lg(Ck/Cсоли)
= рКк
- lg(Ck/Cсоли)
= рКк
– lgCk
+ lgСсоли. -
Основной буферной смеси, состоящей из слабого основания и его соли: рН = 14 + lg
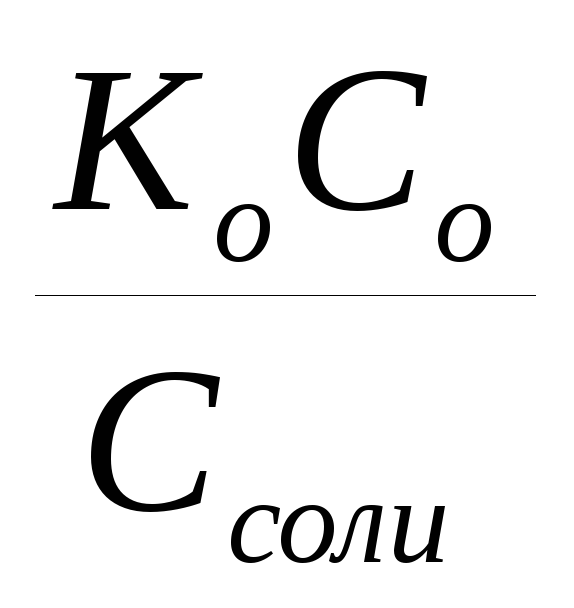 = 14 - рКо
+ lgCo/Ccоли
= 14 - рКо
+ lgCo
- lgCcоли.
= 14 - рКо
+ lgCo/Ccоли
= 14 - рКо
+ lgCo
- lgCcоли.
Очевидно, что в вариантах 3 – 6 удобно пользоваться однотипной формулой:
рН = -lg![]() (варианты
3,6) или
(варианты
3,6) или
рОН = -lg![]() (варианты
4,5), используя при этом константы
равновесия соответствующих процессов,
а именно: диссоциации (варианты 3,4) или
гидролиза (варианты 5,6).
(варианты
4,5), используя при этом константы
равновесия соответствующих процессов,
а именно: диссоциации (варианты 3,4) или
гидролиза (варианты 5,6).
В вариантах 8 – 9 удобно пользоваться однотипной формулой:
рН = рКк – lgСк/Ссоли (кислый буфер, вариант 8) или
рОН = рКо – lgСо/Ссоли (основный буфер, вариант 9).
9) Степень диссоциации слабой кислоты
или основания, степень гидролиза соли,
образованной слабой кислотой и сильным
основанием или наоборот, определяется
по формуле: α =
![]() ,
где К – это константа диссоциации
кислоты или основания, константа
гидролиза соли (К(гидр.)
= К(воды)/ К(дисс.)
= 10-14/ K(дисс.)
=
,
где К – это константа диссоциации
кислоты или основания, константа
гидролиза соли (К(гидр.)
= К(воды)/ К(дисс.)
= 10-14/ K(дисс.)
=
![]() )
)
Домашнее задание:
Cоставить ионно-молекулярные и молекулярные уравнения гидролиза следующих солей: Na3AsO4, Cr2S3, NH4OOCCH3, (NH4)2CO3
Задача 1.
Определить рН и степень гидролиза 0,1 М (0,1 молярного) раствора карбоната натрия (Na2CO3), если известно, что константы кислотности (диссоциации) угольной кислоты (H2CO3) равны: К1= 10-7, К2= 10-11
Задача 3.
Определить рН и степень гидролиза 0,1 М раствора цианистого калия (KCN), если известно, что константа кислотности синильной кислоты (HCN) равна: К = 10-9.
Задача 4. Определить рН водного раствора объемом 2л, содержащего 0,2 моль уксусной кислоты и 0.2 моля уксусно-кислого натрия. Константа кислотности уксусной кислоты равна: Кк = 10-5.
Задача 5.
В сосуде находится раствор гидроксида натрия (NaOH) и осадок гидроксида меди (II) (Cu(OH)2). Определить концентрацию щелочи в растворе, если концентрация ионов меди в нем составляет: [Cu2+] = 2.10-18моль/л, а ПРCu(OH)2 = 2.10-20
Задача 6.
а) Определить рН 0,001н раствора серной кислоты.
б) Определить рН 0,0005М раствора гидроксида кальция
Задача 7. Даны 1М растворы NaCl, CuSO4 ,NiCl2 ,Al2(SO4)3 .Ионная сила какого из растворов будет наибольшей?
Задача 8. Определите концентрацию ионов CN – в насыщенном растворе малорастворимого Cd(CN)2, если ПР = 5 · 10-10.
