
- •Глава 11. Гормоны
- •Способы взаимодействия сигналов и клеток мишеней многообразны
- •В основе взаимодействия сигнала и рецептора лежит слабое взаимодействие
- •Механизм передачи сигнала в клетку определяется особенностями свойств рецептора.
- •Все рецепторы можно разделить на две группы
- •Эндокринная сигнальная система одна из ведущих регулирующих систем в организме.
- •Уровень гормона в крови не всегда определяет конечный эффект гормона
- •Передача сигнала рецепторами, связанными с g-белками проходит с участием вторичных посредников
- •Образование вторичных посредников – дело интегральных белков плазматической мембраны.
- •ЦАмф - первый вторичный посредник в истории исследований переноса сигналов
- •ЦАмф- аллостерический регулятор протеинкиназы а (пка).
- •В каскадном механизме передачи сигнала заложен механизм усиления сигнала
- •На каждом этапе каскадного механизма усиления сигнала есть свои выключатели.
- •Два вторичных посредника образуются из фосфатидилинозитолов мембран
- •Иф3 обеспечивает повышение уровня ионов кальция в цитозоле.
- •Обе ветви инозитолфосфолипидного пути действуют совместно
- •Разные пути передачи сигнала с участием 7 тмс рецепторов взаимодействуют между собой
- •Многие рецепторы сами обладают ферментативной активностью.
- •Наиболее широко распространенная группа 1тмс рецепторов в клетках – рецепторные тирозинкиназы (ртк).
- •Фосфорилированные тирозиновые остатки связываются со специфическими доменами белков.
- •В механизме передачи сигнала с участием 1тмс рецепторов тоже есть система усиления сигнала.
- •Рецепторы, взаимодействующие с тирозинкиназами по механизму действия подобны рецепторным тирозинкиназам
- •1Тмс рецепторы могут обладать и серин/треонин протеинкиназной активностью.
- •Сигнальные гидрофобные молекулы взаимодействуют с внутриядерными и цитозольными рецепторами
- •Гормоны гипоталамуса и гипофиза
- •Нейроны гипоталамуса –нейросекреторные клетки
- •Гормоны передней доли гипофиза можно разделить на три группы.
- •Великаны и карлики- следствие нарушений функций гормона роста
- •В механизмах действия гормона роста участвуют посредники
- •Конечный эффект гормона роста на метаболизм определяется сочетанием прямого и опосредованного ифр влияния на клетки
- •Самые сложные белковые гормоны.
- •Гонадотропины- гормоны регулирующие функциональную активность половых желез
- •Секреция актг изменяется в течении суток.
- •Липотропин - источник эндогенных опиатов
- •Гормоны задней доли гипофиза
- •Вазопрессин – антидиуретический гормон.
- •Основной физиологический эффект окситоцина соответствует названию гормона.
- •Несахарное мочеизнурение – форма проявления функциональной недостаточности вазопрессина.
- •Гормоны щитовидной железы
- •В синтезе гормонов щитовидной железы можно выделить 4 этапа
- •Все клетки организма, по-видимому, мишени гормонов щитовидной железы.
- •Калоригенное влияние, по-видимому, первично в действии гормонов на организм
- •О системных эффектах гормонов можно судить, сопоставляя изменения, наблюдаемые при гипо и гиперфункциях железы
- •Развитию гипотиреоза у взрослых может предшествовать увеличение размеров щитовидной железы- зоб
- •Гипотиреоз у плода и новорожденного приводит к нарушению роста и развития.
- •Увеличение размеров щитовидной железы может быть признаком гиперфункции
- •Увеличение размеров щитовидной железы может быть следствием применения антитиреоидных средств.
- •Кальцитонин- гормон-полипептид
- •Паращитовидные железы – регуляторы обмена кальция и фосфора
- •Гормоны поджелудочной железы
- •Молекулы инсулина обладают видовой специфичностью
- •Синтез инсулина проходит по законам синтеза секретируемых белков
- •В регуляции синтеза самого инсулина и в механизме его действия важную роль играют переносчики глюкозы
- •Инсулин-«гормон изобилия»
- •Эффекты инсулина тканеспецифичны.
- •Активирование поступления глюкозы в адипоцит сопровождается ингибированием липолиза
- •Инсулиновый рецептор и его субстрат активируют путь передачи сигнала с участием гтф-азы.
- •Комплекс нарушений, вызванных недостаточностью функций инсулина называется сахарным диабетом.
- •Снижение толерантности к глюкозе при диабете - следствие нарушения использования глюкозы периферическими тканями
- •Гипергликемия при диабете – причина «диабета».
- •Длительная гипергликемия способствует неферментативному гликозилированию белков
- •Избыток глюкозы вне клеток при диабете контрастирует с ее внутриклеточным дефицитом.
- •Диабет – болезнь липидного обмена?
- •Кетоновые тела –важный источник энергии.
- •Кетоновые тела – источник протонов
- •Выделяют две формы диабета.
- •Высокие дозы инсулина также ведут к коме
- •Падение уровня глюкозы компенсируется специальными механизмами.
- •Глюкагон образуется а- клетками поджелудочной железы
- •Глюкагон действует через 7тмс рецепторы
- •Основной регулятор секреции глюкагона - глюкоза
- •Молярное отношение инсулин :глюкагон - важный показатель состояния регуляторных систем метаболизма.
- •Панкреатический полипептид синтезируется f- клетками поджелудочной железы
- •Гормоны надпочечников Гормоны коры надпочечников - производные холестерола.
- •Основной исходный субстрат для синтеза гормонов коры надпочечников – холестерол.
- •Прегненолон –прямой предшественник всех стероидных гормонов.
- •Клетки гломерулярной зоны синтезируют альдостерон потому, что у них есть синтаза альдостерона
- •Транскортин- главный транспортный белок стероидных гормонов
- •Печень –основной орган катаболизма стероидных гормонов надпочечников
- •Секреция актг и кортикостероидов подвержена циркадным ритмам
- •Регуляция секреции альдостерона мало зависит от актг
- •Ведущий фактор в регуляции секреции альдостерона – ренин –ангиотензиновая система.
- •Ангиотензин II– гипертезин
- •Глюкокортикоидные гормоны стимулируют образование глюкозы.
- •Существует тканевая специфичность в действии глюкокортикостероидов на липидный обмен.
- •На обмен белков глюкортикостероидов оказывают двоякий эффект
- •Высокие концентрации глюкокортикоидов тормозят иммунологический ответ.
- •Высокие концентрации глюкокортикоидов подавляют воспалительную реакцию.
- •Глюкокортикоиды оказывают влияние практически на все органы и системы
- •Для проявления своей активности альдостерон связывается с внутриклеточным рецептором.
- •Недостаточность ферментов, катализирующих синтез кортикостероидов, ведет к гиперплазии надпочечников.
- •Синдром Кушинга развивается при избытке глюкокортикоидов.
- •Первичная недостаточность надпочечников - аддисонова болезнь.
- •Первичный альдостеронизм – болезнь Кона
- •Гормоны мозгового слоя надпочечников образуются из тирозина
- •Период полураспада катехоламинов составляет 1- 2 минуты.
- •Феохромоцитомы – опухоли, ведущие к гипертензии
- •Гормоны половых желез
- •Клетки Лейдига –основное место синтеза андрогенов
- •Белки плазмы обеспечивают транспорт гормонов к органам мишеням
- •Тестостерон действует через внутриклеточные рецепторы
- •Конечный эффект тестостерона определяется его концентрацией, которая тщательно регулируется.
- •Недостаточность мужских половых гормонов может проявляться по разному
- •Яичники –источник женских половых гормонов и половых клеток
- •Эстрогены образуются их андрогенов
- •Основной источник прогестерона – желтое тело
- •Количество синтезируемых гормонов зависит от возраста и фазы менструального цикла
- •Желтое тело после оплодотворения – железа внутренней секреции
- •Плацента секретирует свой гормон роста.
- •Фетоплацентарная единица –кооперация в синтезе стероидных гормонов
- •Резкое снижение уровня эстрогенов инициирует лактацию после родов
- •Гинекомастия – развитие молочных желез у мужчин
- •Менопауза – результат снижения активности яичников.
- •Эстрогены регулируют синтез белков
- •Бесплодие – одна из важных медицинских проблем.
- •Гормоны желудочно-кишечного тракта.
- •Организация эндокринной системы желудочно-кишечного тракта отличается рядом особенностей
- •Секретин - первый гормон в истории эндокринологии
- •Инкретины –гормоны стимулирующие секрецию инсулина.
- •Вазоактивный интестинальный полипептид член семейства секретина
- •Мотилин не входит ни в семейство гастрина ни в семейство секретина
- •Механизмы действия многих гормонов жкт еще не известны.
Передача сигнала рецепторами, связанными с g-белками проходит с участием вторичных посредников
Механизм проведения информационного сигнала с участием рецепторов, связанных с G-белками, состоит, по крайней мере, из 5 этапов.
Первый этаппередачи сигнала включает распознавание и связывание сигнальной молекулы специфическим рецептором плазматической мембраны клетки-мишени.
Второй этаппредставляет собой сложный процесс переноса информации с внешней поверхности плазматической мембраны клетки на внутреннюю, что приводит кG-белок-зависимой активации мембрано-связанных ферментов (например, аденилатциклазы или фосфолипазы С).
Третий этапэтого многоступенчатого каскада сопровождается образованием и повышением уровня в цитозоле одного или нескольких низкомолекулярных внутриклеточных посредников (цАМФ, цГМФ, ДАГ, ионы Са2+ и т.д.).
Повышение уровня низкомолекулярных внутриклеточных посредников внутри клетки инициирует четвертый этаппроведения внешнего регуляторного сигнала – подключение ферментов, активность которых непосредственно регулируется низкомолекулярными внутриклеточными посредниками. Это, как правило, протеинкиназы, которые в свою очередь (пятый этаппроведения регуляторного сигнала) оказывают влияние на активность ключевых клеточных ферментов, определяющих суть ответной реакции клетки на полученный ею извне конкретный информационный сигнал. Активированные каталитические субъединицы некоторых протеинкиназ (например, цАМФ – зависимых) могут оказывать свое влияние непосредственно в цитозоле или транслоцироваться из цитоплазмы в ядро при различных функциональных состояниях клетки. Результатом внутриядерных процессов может быть активация или торможение клеточного цикла, а также синтеза белковых молекул.
Образование вторичных посредников – дело интегральных белков плазматической мембраны.
Первые этапы передачи сигнала с образованием вторичных посредников протекают с участием интегральных белков плазматической мембраны. В этом процессе участвуют 7 ТМС рецептор, Gбелок и фермент, способствующий образованию вторичного посредника.
С хематическое
изображение структуры-адренэргического
рецептора показана на рис слева. Этот
рецептор является членом одного из
подсемейств большого суперсемейства
7 ТМС рецепторов, включающего 3 подсемейства:
1) подсемейство-адренергического
рецептора; 2) подсемейство секретиноподобных
рецеторов;3)подсемейство
метаботропнык глутаматных рецепторов.
Это разделение основано на особенностях
аминокислотных последовательностей
этих рецепторов.
хематическое
изображение структуры-адренэргического
рецептора показана на рис слева. Этот
рецептор является членом одного из
подсемейств большого суперсемейства
7 ТМС рецепторов, включающего 3 подсемейства:
1) подсемейство-адренергического
рецептора; 2) подсемейство секретиноподобных
рецеторов;3)подсемейство
метаботропнык глутаматных рецепторов.
Это разделение основано на особенностях
аминокислотных последовательностей
этих рецепторов.
Представители подсемейства -адренергического рецептора составляют большинство 7-TMS рецепторов, идентифицированных к настоящему времени. Это подсемейство включает- и-адренергические рецепторы, рецепторы гистамина, серотонина, брадикинина, субстанции Р, ангиотензина, интерлейкина 8, тромбина, саматостатина, гликопротеиновых гормонов, ацетилхолина (М-холинорецепторм) и т.д.
-адренергический рецептор, связывающий катехоламиновые агонисты (адреналин, норадреналин и т.д.), состоит из 418 аминокислотных остатков. Его внеклеточный N-концевой домен имеет два участка (сайта) гликозилирования. Гидрофобные участки аминокислотной последовательности -адренергического рецептора образуют 7 трансмембранных а-спиральных сегментов, которые соединены между собой гидрофильными экстраклеточными и внутриклеточными петлями (последние содержат участки взаимодействия с G-белком).
Подсемейство секретиноподобных рецепторов.Это подсемейство включает пептидергические рецепторы секретина, глюкагона, вазоинтестинального пептида, паратирина, кальцитонина, соматолиберина и др. Эти рецепторы характеризуются достаточно высокой гомологией аминокислотной последовательности внутри подсемейства и низкой гомологией с рецепторами подсемейства-адренергического рецептора. Все представители подсемейства секретиноподобных рецепторов связаны с Gs-белком, активация которого лигандорецепторным комплексом приводит к увеличению внутриклеточного уровня цАМФ. Вместе с тем, известно, что наряду с активацией Gs-белка, рецепторы глюкагона, паратирина и кальцитонина активируют и другие G-белки, приводящие к увеличению внутриклеточного уровня Са2* и инозитолтрифосфата.
Подсемейство метаботропных глутаматных рецепторов.Метаботропные глутаматные рецепторы образуют третье, высокоспециализированное подсемейство 7-TMSрецепторов. Глутаматорецепторный комплекс активирует Gq-белок, что в конечном итоге приводит к стимуляции образования инозитолтрифосфата и мобилизации внутриклеточного Са2*. Поскольку увеличение внутриклеточного содержания последнего ведет к активации многих метаболических процессов в клетке эти рецепторы носят название метаботропных в отличие от ионотропных глутаматных рецепторов, являющихся лигандозависимыми ионными каналами. Метаботропные глутаматные рецепторы присутствуют в клетках центральной и периферической нервной системы, где участвуют в регуляции разнообразных функций в ответ на действие агониста L-глутамата.
 Метаботропные
рецепторы характеризуются очень низкой
степенью гомологии аминокислотной
последовательности со всеми другими
7-TMS рецепторами. Эти рецепторы имеют
значительно более высокую молекулярную
массу по сравнению с типичными
представителями других подсемейств
7-ТМSрецепторов.
Метаботропные
рецепторы характеризуются очень низкой
степенью гомологии аминокислотной
последовательности со всеми другими
7-TMS рецепторами. Эти рецепторы имеют
значительно более высокую молекулярную
массу по сравнению с типичными
представителями других подсемейств
7-ТМSрецепторов.
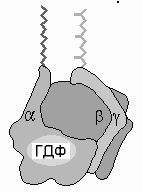
Рис.11.5. Схема строения мембраносвязанного Gбелка
Второй участник передачи сигнала – G белки. Эти белки довольно широко представлены в клетке. Можно выделить по крайней мере 2 типаGбелков:
а) большие, состоящие из нескольких субъединиц, (как правило, гетеротримеры, состоящие из ,исубъединиц с молекулярной массой 42kDa, 35kDaи 10kDaсоответственно) обычно связаны с мембранами благодаря липидным компонентам (пальмитиновая кислота) ковалентно присоединяемым к белку после синтеза на рибосомах
б) низкомолекулярные, состоящие из одной полипептидной цепи (23 кДа), находятся в цитозоле
Все Gбелки обладают ГТФазной активностью (отсюда их название) и их конформация зависит от того, связаны ли они в данный момент с ГДФ или ГТФ. Эти белки в клетке играют роль своеобразных молекулярных «выключателей» многих биохимических процессов (см. раздел по синтезу белков).
 На рис.11.5 представлена схема строения
мембраносвязанногоGбелка. Он состоит из 3 субъединиц,и.
В обычном (неактивном) состоянии три
субъединицы соединены вместе исубъединица связана с ГДФ.
На рис.11.5 представлена схема строения
мембраносвязанногоGбелка. Он состоит из 3 субъединиц,и.
В обычном (неактивном) состоянии три
субъединицы соединены вместе исубъединица связана с ГДФ.
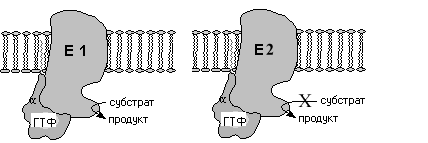 После присоединения гормона к 7 ТМС
рецептору и взаимодействия сGбелком в последнем происходит замена
ГДФ на ГТФ иGбелок
диссоциирует с образованием свободнойсубъединицы и димера субъединиц.субъединица и димерсубъединиц затем перемещаются по
мембране и могут взаимодействовать с
третьим мембраносвязанным участником
передачи сигнала эффекторным белком.
Им может быть фермент, катализирующий
образование низкомолекулярных вторичных
посредников.
После присоединения гормона к 7 ТМС
рецептору и взаимодействия сGбелком в последнем происходит замена
ГДФ на ГТФ иGбелок
диссоциирует с образованием свободнойсубъединицы и димера субъединиц.субъединица и димерсубъединиц затем перемещаются по
мембране и могут взаимодействовать с
третьим мембраносвязанным участником
передачи сигнала эффекторным белком.
Им может быть фермент, катализирующий
образование низкомолекулярных вторичных
посредников.
Конечный эффект такого взаимодействия или активирование (Gs–белок) или ингибирование (Gi-белок) эффекторного белка. Продолжительность эффекта определяется ГТФазной активностью-субъединицы и после гидролиза ГТФ до ГДФ действие субъединиц прекращается и происходит реассоциация их в исходное тримерное состояние.
