
- •Ферменты 3
- •Содержание:
- ••При знакомстве с материалом по кинетике ферментов могло сложиться впечатление, что кинетика всех
- ••У ферментов, подчиняющимся принципам кинетики Михаэлиса и Ментен с позиций процессов, протекающих в
- ••Поэтому природа вынуждена обратиться к "кооперативным" системам, в которых маленькие изменения в одном
- ••Графически результат работы такой кооперативной системы (график зависимости скорости реакции от концентрации субстрата)
- ••Аллостерический белок определяется как белок, содержащий два или больше топологически различающихся центра связывания
- ••Кооперативность - это модификация константы связывания (Кs)лиганда, белком, предшествующим связыванию другого лиганда. Константы
- •• Км обычно принимается как константа связывания субстрата, поскольку ее проще измерять, чем
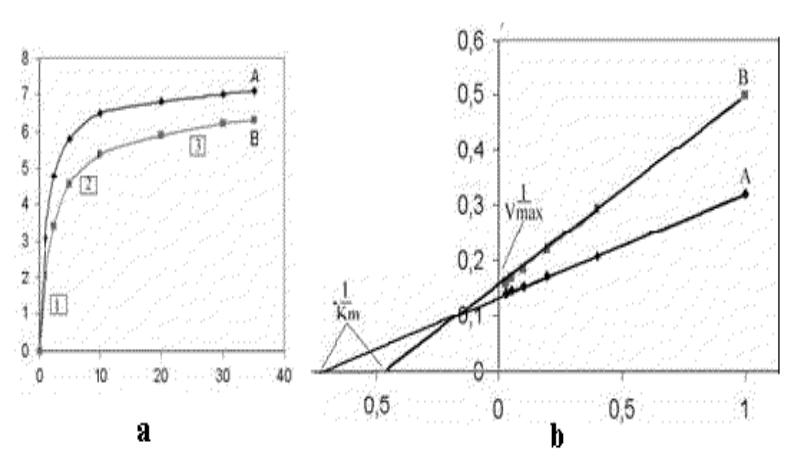
- •Значения Vmax и Km определяются при экстраполяции линий до пересечения с осью абсцисс
- ••Два лиганда один из которых влияет на связывание другого, могут быть химически идентичны,
- •У аллостерических ферментов
- ••Центральная линия графика - типичная сигмовидная кривая в отсутствии любого эффектора. В присутствии
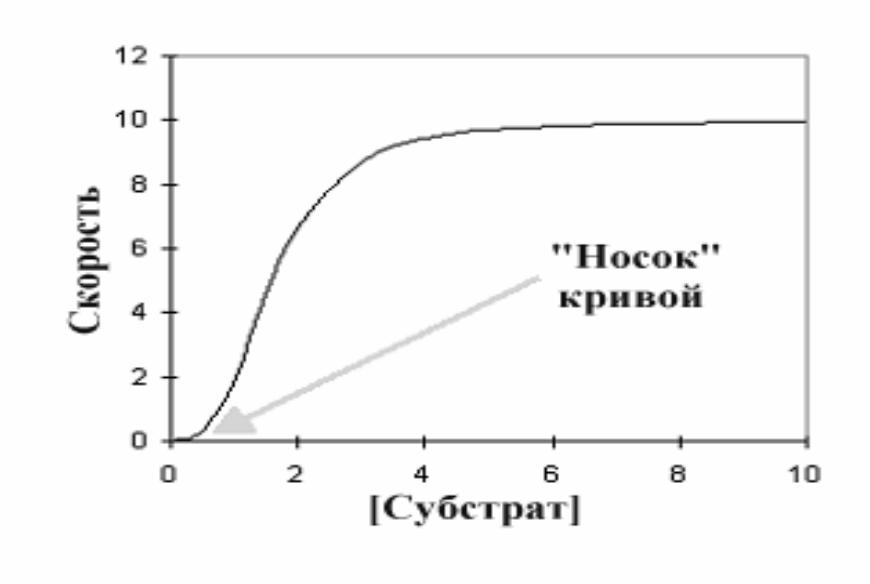
- ••Ингибитор увеличил сигмовидную форму, удлиняя «носок» кривой, в то время как активатор оказывал
- ••Денатурация – нарушение пространственной структуры фермента с последующей потерей активности фермента. Денатурация вызывается
- •Инггибиторы бывают обратимые
- ••Следствием такого связывания обратимого ингибитора является эффективное мгновенное действие, но после удаления ингибитора
- •Необратимые ингибиторы известны также как инактиваторы фермента. Они связываются с ферментом, формируя прочные,
- ••Среди примеров необратимо действующих ингибиторов можно назвать диизопропилфторфосфат (ДИПФФ). Это соединение вошло в
- •ДИПФФ ковалентно связывается с гидроксильной группой серина и если эта группа важна в
- •Ацетилсалициловая кислота (известный всем аспирин) является необратимым ингибитором циклооксигеназы- фермента участвующего в синтезе
- •Ингибитором синтеза протеогликанов стенки бактерий является пенилиллин, структура которого напоминает D- аланин, встраиваемый
- •Различают два механизма конкурентного торможения.
- •Если связывание субстрата с АЦ
- •И субстрат и ингибитор не могут одновременно связаться с ферментом. В этом виде
- •Конкурентные ингибиторы не
- •Малоновая кислота тормозит активность дегидрогеназы янтарной кислоты, занимая активный центр на ферменте. Учитывая
- •Конкурентное торможение
- ••Регуляция активности ферментов путем химической модификации: Реакции ограниченного протеолиза, аденилирования, рибозилирования, ацетилирования, фосфорилирования
- •Активность фермента можно изменить путем ковалентной модификации его структуры.
- •Гормональная регуляция активности ферментов
- •Регуляция активности ферментов
- •Аденилатциклазный комплекс
- •В ходе этого процесса образуется небелковое соединение - цАМФ, цАМФ - внутриклеточный гормон
- •См. мультимедийную презентацию- Сигнальная трансдукция.
- •Гормон, циркулирующий в крови, попадает в межклеточную жидкость и контактирует с поверхностью клетки,
- •Уровень, образовавшийся под действием АЦ, цАМФ определяется не только активностью АЦ, но и
- •Наибольшее значение имеет цГМФ. Она образуется под действием гуанилатциклазы, расположенной как в наружной
- •цГМФ оказывает эффекты противоположные цАМФ.
- •Аденилатциклазный механизм
- •Некоторые клеточные ответы на действие гормонов, опосредуемое циклическим АМФ
- •ИФ3 обеспечивает повышение
- •Сигнальные роли ДАГ
- ••Фермент, активируемый ДАГ, называется протеинкиназой С (ПКС) или С–киназой, так как активность его
- ••Связывание диацилглицерола изменяет конформацию протеинкиназы С, что сопровождается повышением ее сродства к ионам
- ••Концентрация С-киназы выше всего в нейронах головного мозга, где, помимо, прочего она фосфорилирует
- •Взаимосвязь цАМФ и ИФ3
- •Изоферменты, их природа,
- •Изоферменты
- •1)скоростью катализа;
- ••Тетрамерный фермент, состоящий из двух кодируемых генетически субъединиц А и В может быть
- •Изоферменты имеют адаптивное значение, т. е. придают специфику метаболизма.
- •Существует 5 изоферментных форм:
- •Остальные изоферменты занимают промежуточное положение.
- •Изменение активности ферментов в онтогенезе.
- •Глюкоза утилизируется анаэробным путем (анаэробный гликолиз), т. к. ткани плода не способны к
- •3. Грудной
- •6. Зрелый.
- •Активная регуляция ферментов возможна - на геномном уровне ( лактозный оперон);
- •Роль ПКС в регуляции
- •Известны два внутриклеточных пути, через которые активированная С- киназа усиливает транскрипцию генов. В
- •Elk-1 связан с короткой последовательностью ДНК (обозначаемой serum response element
- •В другом пути, активация С-киназы приводит к фосфорилированию ингибиторного белка Ik-B, что сопровождается
- •Существует группа соединений, среди которых наиболее хорошо изучены форболовые эфиры, которые являются мощными
- •Метаболизм ферментов
- •Имея высокую молекулярную массу, большая часть ферментов не экскретируется с мочой. Ферменты экскретируемые
- •Активность фермента
- •Понятие "активность фермента" по сути дела идентична понятию "скорость ферментативной" реакции. Ферментативная активность
- •В системе СИ в качестве единицы ферментативной активности используют "катал" (kat). Катал определяется
- •Размерность её слишком велика, на практике пользуются меньшими кратными значениями, начиная с нанокатала
- •В практике лабораторий широко
- •При исследовании кинетики реакций
- •Пример для вычисления активности фермента
- •ферментов у больного ИМ в разные сроки заболевания
- •Номенклатура и классификация ферментов
- •Шифр КФК и ее место в классификации ферментов
- •Каждый подподкласс представляет собой список ферментов. Порядковый номер фермента в этом списке –
- •Оксидоредуктазы
- •Трансферазы
- •Гидролазы (3.0.0.0.)
- •Лиазы(4.0.0.0) 4.1.0.0.Углерод-углерод лиазы 4.1.1.0.Карбокси лиазы 4.1.1.1. Пируватдекарбоксилаза
- •Лигазы (6.0.0.0)
- •Ферменты 4
Ферменты 3
Содержание:
1.Механизм регуляции активности ферментов. Аллостерическая регуляция.
2.Характеристика аллостерических ферментов. Виды ингибирования( обратимое, необратимое, конкурентное, неконкурентное, бесконкурентное)
3. Регуляция активности путем химической модификации ферментов.
4.Изоферменты.
5. Изменение активности ферментов в онтогенезе.
•При знакомстве с материалом по кинетике ферментов могло сложиться впечатление, что кинетика всех ферментов основана на принципах Михаэлиса и Ментен.
•Кинетика многих ферментов не подчиняется принципам кинетики Михаэлиса и Ментен
•У ферментов, подчиняющимся принципам кинетики Михаэлиса и Ментен с позиций процессов, протекающих в клетке, имеется ряд недостатков :
•-узкий диапазон допустимых
концентраций субстратов в клетке, способных для удовлетворения потребности, быстро реагировать на условия;
•- потребность в тонкой
регуляции концентраций
большинства метаболитов для сохранения нормальной жизнедеятельности.
•Поэтому природа вынуждена обратиться к "кооперативным" системам, в которых маленькие изменения в одном параметре, например концентрации ингибитора, вызывают большие изменения в скорости. Существует большое семейство ферментов, которые представляют собой кооперативные системы. Это аллостерические ферменты
•Графически результат работы такой кооперативной системы (график зависимости скорости реакции от концентрации субстрата) выражается не гиперболой, а S-образной сигмоидной кривой (сигмоидальные кривые всегда сдвинуты вправо в сравнении с гиперболой
•Аллостерический белок определяется как белок, содержащий два или больше топологически различающихся центра связывания лигандов (субстраты, ингибиторы и т.д), которые функционально взаимодействуют друг с другом. Связывание лиганда, с одним центром изменяет свойства другого (их).
•Большая часть аллостерических белков – аллостерические ферменты, но некоторые белки, типа гемоглобина, выполняют и другие функции.
•Кооперативность - это модификация константы связывания (Кs)лиганда, белком, предшествующим связыванию другого лиганда. Константы связывания - подобны Ks для субстрата или Ki для ингибитора,и являются в основном константами диссоциации белка и лиганда.Это указывает на силу связывания, или сродство белка и лиганда.
