
- •3.Змішані пухлини
- •Класифікація раку легені
- •Периферичний рак легені
- •Системні синдроми
- •Гіперамілаземія.
- •Основна причина пізньої діагностики раку легені – неефективна робота загальної лікувальної мережі і, насамперед, численні лікарські помилки тактичного і діагностичного плану.
- •Таблиця 6
- •Гормональна терапія РМЗ
- •Пухлини щитовидної залози
- •Диференціальна діагностика раку щитовидної залози
- •Гормональне лікування раку щитовидної залози
- •Морфологічна класифікація раку нирки (2002р.)
- •В лікуванні РН застосовуються всі існуючі на сьогоднішній день методи протипухлинної терапії: хірургічний, хіміотерапія, променева терапія, гормонотерапія.
- •Хірургічне лікування локалізованого раку нирки
- •Результати лікування раку ендометрію
- •FIGO
- •Ступінь поширення
- •Пухлина відсутня
- •IIIA
- •IIIB
- •IIIC
- •Серозний рак
- •Муцинозний рак
- •Прогностичні фактори
- •Клініка раку яєчників
- •Діагностика пухлин яєчників
- •Лікування раку яєчників
Ангіографія (АГ), яка раніше була провідним методом діагностики пухлин нирок, зараз застосовується лише у тих випадках, коли необхідна точна інформація про особливості кровопостачання нирок і при підозрі на ураження магістральних судин. АГ показана також у тих випадках, коли є велика пухлина нирки, пухлинний тромбоз НПВ або коли планується резекція нирки, емболізація ниркової артерії.
Найважливіші лабораторні параметри, які визначаються у хворих на РН, включають визначення рівня гемоглобіну і ШОЕ, креатиніну (функціональний стан нирок), лужної фосфатази (метастази в печінку, кістки), сироваткового кальцію (гіперкальціємія).
Тонкоголкова біопсія пухлини застосовується у тих випадках, коли додаткові методи дослідження не дозволяють на доопераційному етапі установити діагноз, при цьому точність діагностики досягає 98%. У разі, одержання в пунктаті елементів крові, навіть при відсутності пухлинних клітин, пункцію треба повторювати, оскільки може мати місце розпад пухлини з утворенням гематоми.
Лікування раку нирки
В лікуванні РН застосовуються всі існуючі на сьогоднішній день методи протипухлинної терапії: хірургічний, хіміотерапія, променева терапія, гормонотерапія.
Хірургічне лікування локалізованого раку нирки
Хірургічний метод до цього часу залишається найефективнішим у лікуванні РН. Уперше в 1884 р. М.І.Орловський успішно виконав нефректомію з приводу аденокарциноми нирки жінці 37 років. Після цього нефректомія поступово увійшла в широку практику. В 60-і роки минулого століття великі надії покладались на хіміопроменеву терапію, однак подальше її застосування у різних варіантах не принесло очікуваного результату. За останні роки значно розширились показання до резекції нирки на початкових стадіях хвороби і, у зв’язку з появою схем ад’ювантної імунотерапії, зросла роль хірургічного методу в лікуванні хворих з метастазами і місцево-розповсюдженими формами пухлинного процесу.
Радикальна нефректомія – основне втручання при хірургічному лікуванні раку нирки – одержала загальне визнання після того, як у 1963 році Robson були опубліковані цілком прийнятні результати хірургічного лікування РН. Принципи виконання радикальної нефректомії мало змінились
зтих пір і включають зараз:
-ранню перев’язку ниркової артерії і вени;
-видалення нирки поза фасцією Герота разом з оточуючою паранефральною клітковиною;
-видалення однойменного наднирника;
-виконання регіонарної лімфаденектомії.
Найважливішим моментом є видалення нирки поза фасцією Герота, тому що її інвазія відзначається у 25% випадків. Сучасні дослідження показали, що рутинне видалення наднирника не завжди доцільне, за винятком тих випадків, коли пухлина знаходиться у верхньому полюсі, або існує субтотальне ураження нирки. Незважаючи на те, що лімфаденектомія забезпечує більш точне стадіювання пухлинного процесу, її вплив на віддалене виживання залишається предметом дискусії.
У світлі сьогоднішніх уявлень можна сформулювати такі показання до
нефректомії:
1.Радикальна нефректомія залишається методом вибору у лікуванні локальних форм РН. Оскільки ефективність резекції нирки при здоровій протилежній нирці остаточно не визначена, більшість дослідників вважають, що резекція можлива при розмірах пухлини не більше 3-5 см.
2.Радикальна нефректомія показана у випадках РН з пухлинною інвазією ниркової і нижньої порожнистої вени.
3.Радикальна нефректомія може виконуватися пацієнтам з одиничними віддаленими метастазами у сполученні з їх одномоментним або послідовним видаленням.
4.Паліативна нефректомія застосовується при захворюванні на РН для зменшення інтоксикації, зниження інтенсивності больового синдрому і купіювання профузної кровотечі.
З самого початку при хірургічному лікуванні РН застосовується позаочеревинний поперековий доступ. Перевагою його є те, що ложе видаленої нирки розташовується поза очеревиною і при розвитку нагноєння у цій зоні черевна порожнина залишається інтактною. Однак недоліками поперекового доступу є неможливість виконання комбінованих операцій при поширенні пухлини на сусідні органи й неможливість повноцінної ревізії черевної порожнини і, при необхідності, видалення метастатичних пухлин. Ще однією перевагою лапаротомного доступу є можливість виконати втручання при наявності супутньої патології, наприклад, холецистектомії при холециститі або екстирпації матки при фіброміомі.
З лапаротомних доступів найбільшого поширення одержали серединний і трансректальний. Перевагу варто віддати серединному доступу, оскільки він
єменш травматичним, бо при цьому не перетинаються м’язи передньої черевної стінки і, відповідно, у меншої кількості пацієнтів виникають післяопераційні грижі. Серединний доступ забезпечує найкращий доступ до воріт нирки і магістральних судин, де можуть виникнути основні складності при виконанні нефректомії.
Торакоабдомінальні доступи застосовуються у випадках, коли тромб у нижній порожнистій вені піднімається вище діафрагми.
Лімфаденектомія при раку нирки передбачає видалення усієї жирової клітковини з лімфатичними вузлами, яка оточує магістральні судини, від рівня ніжок діафрагми, безпосередньо нижче рівня відходження верхньої брижової артерії, до біфуркації аорти та нижньої порожнистої вени.
Обґрунтуванням лімфаденектомії є те, що проростання метастазів РН у лімфатичні вузли є одним з найбільш значущих несприятливих факторів
прогнозу. Поява регіонарних метастазів знижує виживання хворих до 5-30%. Видалення уражених лімфатичних вузлів може покращити результати хірургічного лікування і, крім того, забезпечує коректне стадіювання, а отже, і прогноз результатів лікування.
Хірургічне лікування раку нирки, котрий супроводжується пухлинним тромбозом ниркової і нижньої порожнистої вени, є досить складною задачею. РН має тенденцію до формування пухлинних тромбів з їх розповсюдженням по нирковій і нижній порожнистій венах аж до правого передсердя. Венозна інвазія зустрічається у 4-10% хворих, з яких у 60% тромб поширюється вище устя печінкових вен.
Основною відмінністю нефректомії з тромбектомією є необхідність мобілізації та резекції НПВ. Особливо небезпечне видалення тромбу при його поширенні на праве передсердя, при деяких видах тромбозу вимагається кардіопульмональне шунтування і гіпотермія з зупиненням кровообігу.
У хворих без віддалених метастазів радикальна нефректомія з тромбектомією забезпечує 5-річне виживання від 47 до 64%. На відміну від наявності метастазів у лімфатичних вузлах і віддалених метастазів, рівень розповсюдження пухлинного тромбу вірогідно не впливає на прогноз. Отже, активний хірургічний підхід до хворих з пухлинним тромбозом НПВ є ефективним методом лікування, а радикальне видалення тромбу будь-якої протяжності дає шанс на одужання більшості хворих.
Резекція нирки є методом вибору у тих випадках, коли пухлина розташовується в одному з полюсів нирки, не деформує ниркову миску і не перевищує 3 см у найбільшому вимірі. Поряд з традиційними методиками, у ДОПЦ останнім часом ця операція виконується за допомогою так званого «електрозварювального апарата», розробленого під керівництвом академіка Б.Є.Патона. Методика дозволяє виконати операцію з мінімальною крововтратою.
Енуклеацію пухлини допустимо виконувати у хворих з єдиною функціонуючою ниркою за умови, що розміри пухлини не перевищують 3 см, і вона локалізована в одному з полюсів.
Хірургічне лікування солітарних та одиничних метастазів раку нирки. Солітарні метастази РН або метастатичне ураження лише одного органа відзначаються в 3-11% випадків. Найчастіше солітарними метастазами уражаються легені (30%), кістки (15%), лімфатичні вузли (14%), ЦНС (8%), печінка (5%), наднирники (2,7%), контрлатеральна нирка (1,4%),
шкіра (1,4%).
Сучасні дослідження показали, що видалення солітарних і одиничних метастазів суттєво покращує виживання і якість життя хворих. У першу чергу, це стосується пацієнтів з ураженнями скелета і головного мозку. Резекція кісткових уражень виконується для корекції і попередження патологічних переломів, збереження рухової активності, усунення болів, декомпресії спинного мозку. 5- і 10-річне виживання після успішної резекції солітарних кісткових метастазів складає 35% і 17%, відповідно.
Метастази в головний мозок призводять до розвитку неврологічної симптоматики у 98% випадків, їх видалення забезпечує повне зникнення
обтяжливої симптоматики і суттєве покращання якості життя, при цьому середня тривалість життя збільшується з 1-2 до 24 місяців, а п’ятирічне виживання – до 12%.
При наявності безсимптомних одиничних або солітарних метастазів у легені, печінку, наднирник, контрлатеральну нирку – хірургічне лікування показане за умови повного видалення первинної пухлини, відсутності інших пухлин і проявів метастатичної хвороби, можливості повного хірургічного видалення метастазів. Прогностично сприятливими факторами є:
-локалізація метастазів тільки в одному органі;
-можливість повного видалення уперше виниклих уражень;
-безрецидивний період після нефректомії більше 24 міс;
-солітарний характер уражень.
Хіміотерапія метастатичного раку нирки
Хіміотерапія РН застосовується з 60 років минулого сторіччя. За цей час удалося встановити, що рак нирки малочутливий до системної хіміотерапії. Біологічною основою цього є гіперекспресія гена множинної лікарської стійкості MDR-1 – мембранного глікопротеїну Р–170, який забезпечує виділення цитотоксичних агентів та їх метаболітів з пухлинної клітини.
Дослідження, присвячені вивченню ефективності різних хіміопрепаратів та їх комбінацій з іншими цитотоксичними агентами, показали маловтішні результати: загальна ефективність лікування не перевищує 4 – 6%. Між тим, інтенсивний пошук у цьому напрямку продовжується.
Гормональна терапія раку нирки
Наявність рецепторів естрогенів у нирково-клітинних пухлинах є підставою для проведення досліджень, присвячених вивченню ефективності гормональних препаратів при дисемінованому РН. Однак до цього часу застосування гормональних препаратів: прогестинів, антиестрогенів і антиандрогенів не забезпечечувало значного покращання результатів лікування. Призначення антиестрогенних препаратів також виявилось малоефективним, за даними ряду авторів, середня ефективність лікування тамоксифеном не перевищує 9%. Тому більшість дослідників вважають гормональну терапію раку нирки практично неефективною.
Імунотерапія раку нирки
Теоретичною основою імунотерапії нирково-клітинного раку послужили факти спонтанної регресії метастазів і виявлення в периферичній крові хворих цитолітичних Т – лімфоцитів. Імунотерапія в нинішній час відіграє важливу роль у лікуванні розповсюджених форм РН, практично застосовуються такі методики імунотерапії:
- неспецифічна імунотерапія цитокінами (інтерферони, інтерлейкіни) та іншими модифікаторами біологічних реакцій;
-адоптивна клітинна імунотерапія із застосуванням аутолімфоцитів (ALT), лімфокін-активованих кілерів (ЛАК), туморинфільтруючих лімфоцитів (TIL);
специфічна імунотерапія вакцинами і моноклональними антитілами;
-генна терапія;
-мініалогенна трансплантація стовбурових клітин.
Інтерферони (ІФ) сприяють підвищенню імуногенності пухлини, інгібують ангіогенез, індукують імунну відповідь. Вони мають безпосередню цитотоксичну дію на пухлинні клітини. На даний час інтерферон альфа є одним з препаратів вибору терапії даної категорії пацієнтів, однак оптимальні дози і режими його введення ще не визначені. Установлено, що застосування разових доз інтерферону альфа менше 3 млн. МО зменшує ефективність терапії, а збільшення разової дози понад 10 млн. МО не дає переваг. Середня частота повних і часткових ремісій при використанні інтерферону альфа складає, за даними Savage P.D. (1995), 15%.
Найпоширеніші режими введення: по 3-6 млн. МО щоденно протягом 2 тижнів або 3 рази на тиждень упродовж 3-4 тижнів; починаючи з 2-го тижня, можливе збільшення разової дози до 9-18 млн. МО/доб.
Оскільки нирково-клітинний рак вважається хіміо- і гормонорезистентною пухлиною, на сьогоднішній день стандартом лікування метастатичного раку нирки є імунотерапія з використанням інтерферону та інтерлейкіну-2 у вигляді монотерапії або у різних поєднаннях, подібна терапія дає об’єктивний ефект у 10 до 20% хворих.
Поява нових методів імунотерапії (протипухлинна вакцинотерапія, генна терапія і мініалогенна трансплантація) дозволяє сподіватися на збільшення ефективності комбінованого лікування дисемінованого раку нирки.
Променева терапія раку нирки
За спільною думкою, злоякісні пухлини нирки загалом резистентні до променевого впливу, його застосування обґрунтовано тільки при паліативній терапії кісткових метастазів: для зменшення болів, попередження подальшої прогресії та покращання якості життя. На практиці використовуються декілька найбільш поширених режимів фракціонування: 3 Гр х 10 протягом 2 тижнів або 4 Гр х 5 протягом 1-го тижня. Анальгезуючий ефект променевої терапії при СОД 30-40 Гр досягається у 80% хворих.
Променева терапія застосовується не тільки для зменшення больового синдрому, але й з метою стабілізації та попередження патологічних переломів за рахунок ремінералізації кісткової тканини. Для досягнення рекальцифікації показано використання більш тривалих курсів з більш дрібним фракціонуванням і високими сумарними дозами: СОД 60-66 Гр (по 2 Гр х 5 днів на тиждень, 6 – 7 тижнів), СОД 50 Гр. (по 2,5 Гр х 20), СОД 39 Гр. (по 3 Гр х 13). Вибір схеми лікування залежить від очікуваної тривалості життя пацієнта і локалізації ураження. Аналогічні режими можуть бути застосовані у післяопераційному періоді, хоча доза опромінення зменшується в залежності від розмірів резидуальної пухлини.
Застосування передопераційної променевої терапії теоретично можна обґрунтувати необхідністю профілактики місцевих рецидивів та інтраопераційної дисемінації пухлини. З цією метою проводиться інтенсивний курс променевої терапії по 5 Гр щоденно протягом 5-ти днів, через 24-48 годин після завершення процесу опромінення пацієнта оперують. Ефективність подібної терапії в нинішній час вивчається.
Застосування бісфосфонатів
З метою покращання якості життя хворих на РН з метастазами в кістки сьогодні активно використовуються препарати групи бісфосфонатів (зомета,
бонефос, бондронат, мілдронат, памиред, аредія,) які є синтетичними аналогами пірофосфатів, котрі регулюють процес мінералізації в організмі. Застосування цих препаратів удвічі зменшує відсоток ускладнень з боку кісткової системи, таких як патологічні переломи і стиснення спинного мозку, дозволяє уникнути необхідності проведення променевої терапії або хірургічного втручання, збільшує безрецидивний період на 6 місяців.
Результати лікування раку нирки
Результати лікування РН, представлені в літературі, у значній мірі різняться, і все ж, загальні тенденції більшості дослідників очевидні. Giuliani et al. (1990), Herrilinger et al. (1991), Ditonno et al. (1992), Eschweg et al. (1994),
Серняк П.С. (1996) наводять дані 5-річного виживання в залежності від стадії захворювання.
Таблиця 10
5-річне виживання хворих на нирково-клітинний рак за даними різних авторів
Автор |
Кількість |
Стадія |
5-річне |
|
хворих |
захворювання |
виживання |
||
|
||||
|
200 |
T1N0 |
80 |
|
Giuliani et al. (1990) |
|
T2N0 |
68 |
|
|
T3N0 |
70 |
||
|
|
N+M0 |
52 |
|
|
|
T1N0 |
90 |
|
Herrilinger et al. (1991) |
320 |
T2N0 |
90 |
|
|
T3N0 |
78 |
||
|
|
|||
|
|
N+M0 |
28 |
|
|
|
T1N0 |
100 |
|
Ditonno et al. (1992) |
97 |
T2N0 |
79 |
|
|
T3N0 |
68 |
||
|
|
|||
|
|
N+M0 |
25 |
|
|
|
T1N0 |
90 |
|
Eschweg et al. (1994) |
90 |
T2N0 |
87 |
|
|
T3N0 |
88 |
||
|
|
|||
|
|
N+M0 |
– |
|
|
|
T1N0 |
– |
|
Серняк П.С. (1996) |
131 |
T2N0 |
80 |
|
|
T3N0 |
72 |
||
|
|
|||
|
|
N+M0 |
46 |
Як видно з наведеної таблиці, на 5-річне виживання більшою мірою впливає метастатичне ураження лімфатичних вузлів, ніж розміри пухлини.
Ми бачимо, що при неметастатичних стадіях раку можна домогтися 5- річного виживання у 68-100% хворих. Якщо в регіонарних лімфовузлах є метастази, цей показник знижується до 25-52%, а, за даними окремих авторів, жоден хворий не переживає п’ятирічний рубіж.
Диспансеризація хворих
Диспансеризація повинна бути спрямована на раннє виявлення пухлин нирки. Передусім, у людей, старших 40 років, необхідно 1 раз на рік брати аналіз сечі і виконувати їм УЗД черевної порожнини та заочеревинного простору. Ці дослідження можуть виявитися дуже ефективними, оскільки сучасні УЗД апарати здатні виявляти пухлини до 0,5-1 см в діаметрі. Таким доступним у сучасних умовах методом можна виявляти РН на ранніх стадіях захворювання. Якщо у хворого виявляється аденома нирки, йому необхідно пропонувати оперативне лікування. Хворим, які мають доброякісні пухлини нирок, необхідно проводити УЗД не рідше 1 разу у 6 місяців. Обстеження бажано проводити на тому ж апараті, і в того ж лікаря, щоб вірогідно оцінити динаміку.
Після проведеного радикального лікування перший огляд здійснюється через 1 місяць, потім 1 раз у 3 місяці протягом першого року і далі – 1 раз у півроку протягом 5 років Кожен огляд повинен супроводжуватися УЗД - контролем, не рідше одного разу на півроку, рентгендослідженням органів грудної клітки, загальним аналізом крові і сечі. За показаннями необхідно виконувати КТ, МРТ, ізотопне дослідження кісток скелета, ренографію тощо.
Профілактика раку нирки
Як зазначалося вище, паління є основним фактором, що збільшує імовірність захворювання на РН. Відомо, що тютюнопаління найсуттєвіше впливає на захворюваність на рак легені, сечового міхура і нирки. Складається враження, що компоненти тютюнового диму чинять канцерогенну дію «на вході і виході» з організму. Особливу увагу слід приділити роз’яснювальній роботі з дітьми, підлітками і молодими людьми, оскільки ризик захворіти на рак нирки з плином часу знижується дуже повільно.
Більше уваги необхідно приділяти профоглядам на нафтопереробних, паперовиробних та інших виробництвах, пов’язаних з можливістю канцерогенного впливу на персонал.
Список літератури:
1.Пивоваров П.И. и др. Урология и нефрология в схемах. – Вінниця:
Велес. – 2001. - С. 170-178.
2.Трудный диагноз в урологии / Под ред. Д.Л.Мак-Каллаха. – Москва:
Медицина. - 1997. - С. 104-149.
3.Руководство по химиотерапии опухолевых заболеваний / Под редакцией Переводчиковой Н.И. - М, 2005. – 698 с.
4.Аль Шукри С.Х., Ткачук В.Н. Опухоли мочеполовых органов.– СПб:
Питер, 2000. – 320 с.
5.Энциклопедия клинической онкологии. Руководство для практикующих врачей / Давыдов М.И., Вышковский Г.Л и др. / Под общ. редакцией М.И.Давыдова., Г.Л.Вышковского. - М.: РЛС – 2005, 2004. – 1536с.
РАК СЕЧОВОГО МІХУРА
Вступ
Рак сечового міхура(РСМ) до цього часу залишається однією з найактуальніших проблем онкоурології, ряд питань якої остаточно не вирішені.
Захворюваність на РСМ продовжує невпинно зростати. При цьому ризик розвитку захворювання може варіювати в різних регіонах в 10 разів. Чоловіки хворіють в 2,5 – 6 разів частіше від жінок. Основну масу пухлин сечового міхура складають епітеліальні пухлини. Вони розділяються на доброякісні (папіломи) і злоякісні (перехідноклітинний, сосочковий, плоскоклітинний рак та аденокарцинома).
Для РСМ особливо характерне наростання захворюваності з віком: пухлини майже не виявляються у людей, молодших 35 років, однак після 65 років імовірність їх появи різко збільшується.
Серед захворілих на РСМ летальний кінець, зумовлений основним захворюванням, відзначається усього в 20 – 25% пацієнтів. Цей, відносно сприятливий, показник пояснюється тим, що в 70 – 80% випадків РСМ діагностується на неінвазивних стадіях. У решти хворих пухлина характеризується інфільтративним ростом вже при її виявленні, що вказує на несприятливий прогноз протягом захворювання.
Епідеміологія
Рак сечового міхура посідає 6-е місце у структурі онкологічних захворювань (11,4 на 100 тис. населення), 3-є місце серед урологічної і 2-е - серед онкоурологічної патології (50% і 72%, відповідно). Захворюваність чоловічого населення перевищує таку у жінок в 4 рази. Кількість хворих на рак сечового міхура зростає кожні 5 років більше ніж на 20%, і за прогнозами зростатиме у тому ж темпі. Мешканці розвинених країн, особливо представники білої раси, страждають найбільшою мірою. Так, у США і Західній Європі захворюваність на РСМ в 2 – 3 рази перевищує середньосвітові показники і в 10 разів вища, ніж у Східній Європі та Азії.
В Україні сьогодні на обліку перебуває 24 тис. хворих на рак сечового міхура, і прогнозується збільшення захворюваності до 2010 р. в 1,4 рази, а смертності – в 2,8 рази.
Етіологія
Виділяють екзогенні та ендогенні (генетичні) фактори ризику розвитку РСМ.
До екзогенних факторів ризику належать такі:
-вплив виробничих шкідливостей;
-паління;
-хронічне запалення;
-ятрогенний вплив.
Виробничі шкідливості. РСМ є одним з перших онкологічних захворювань, для яких був вірогідно продемонстрований взаємозв’язок з роботою на шкідливому виробництві. Установлена підвищена захворюваність серед працівників, робота яких пов’язана з виробництвом барвників, а також працівників гумової і текстильної промисловості. Вважається, що найбільш значущою ланкою в патогенезі «професійного» раку сечового міхура є контакт з канцерогенами групи ароматичних амінів та їх похідних (бензидин, бета-нафтиламін, 4-амінобіфеніл, нітрозоаміни). Сьогодні, завдяки повсюдному впровадженню правил техніки безпеки, спрямованих на зменшення контакту з ариламінами індустріального походження, рівень захворюваності на РСМ, пов'язаної зі шкідливим виробництвом, помітно знижується.
Паління є однією з основних причин виникнення РСМ, вплив якої значно зріс за останні роки. Ризик розвитку раку сечового міхура у курців приблизно в 20 – 30 разів вищий, порівняно з тими, хто не палить.
Вплив ароматичних амінів, які входять до складу тютюнового диму, на негативні наслідки паління в нещодавньому минулому розцінювався як помірний, порівняно з поліциклічними вуглеводнями (ПАВ). Однак, починаючи з 80-х років XX століття, в розвинутих країнах спостерігається витіснення «міцних» сортів сигарет так званими «легкими» різновидами тютюнових виробів («light», «superlight» і т.і.). Останні дійсно характерризуються низькою концентрацією смол і зниженою кількістю ПАВ в тютюновому димі, при цьому кількість попередників ароматичних амінів у подібних модифікованих сигаретах залишається колишньою. Крім того, курці компенсують «недостатню» міцність «легких» сигарет більш глибокою і довготривалою інгаляцією тютюнового диму. Вказані змінення у стилі паління призвели до помітного збільшення ролі ароматичних амінів в канцерогенезі.
Хронічне запалення. Вплив хронічного запалення, в деякій мірі пов’язаного з вторинними бактеріальними інфекціями сечового міхура, також є фактором ризику виникнення РСМ. Багато з умовно патогенних бактерій, які активізуються внаслідок хронічного циститу, здатні утворювати нітрозосполуки, які є потужними канцерогенами. Найбільш класичним прикладом в’яло протікаючого запального процесу є сечостатевий шистозоматоз, надзвичайно поширений в країнах Близького Сходу, особливо в Єгипті.
Ятрогенні впливи. На жаль, багато випадків РСМ пов’язані з попередніми лікувальними заходами. Зокрема, установлення постійних катетерів, уротелія, яка призводить до хронічного подразнення і запалення, сприяють утворенню плоскоклітинних карцином сечового міхура. Іншим відомим ятрогенним фактором ризику є терапія цитостатичними препаратами з групи циклофосфамідів. Вони помітно підвищують імовірність виникнення перехідноклітинних форм раку, що пов’язано з їх прямим мутагенним впливом на стінку сечового міхура.
Терапевтичне опромінення органів малого таза також збільшує ризик розвитку раку в 1,5 – 4 рази.
Ендогенні генетичні фактори ризику виникнення РСМ включають
дві групи:
-спадкові ракові синдроми;
-нормальні варіації геному.
Спадкові ракові синдроми. РСМ не входить до складу основних ракових синдромів, тому родинна схильність до цього захворювання спостерігається рідко. Існує лише один виняток: ризик розвитку РСМ значно підвищений у хворих з синдромом спадкового неполіпозного раку товстої кишки, який проявляється здебілбшого пухлинами шлунково-кишкового тракту та ендометрію.
Нормальні варіації геному. Установлено, що у формуванні індивідуальної схильності до РСМ можуть відігравати суттєву роль не стільки мутації, скільки нормальні варіації генетичних послідовностей – генні поліморфізми. Зокрема, ризик розвитку раку значно підвищується при недостатності трансфераз, інактивуючих ароматичні аміни. Примітно, що несприятливий ефект генних варіацій спостерігається переважно у тих людей, які дійсно зазнають відчутного впливу ароматичних амінів (у першу чергу, курці). У той же час, перераховані поліморфізми є нейтральними для решти популяцій.
Молекулярна патологія при раку сечового міхура
Одним з відносно специфічних для РСМ явищ є активація онкогена HRAS1, яка відбувається внаслідок точкових мутацій в кодонах даного гена. Пошкодження HRAS1 спостерігаються приблизно у 20 –50% РСМ.
Іншою характерною для РСМ подією є делеції хромосоми 9. Їх патологічне значення, мабуть, пов’язанє з інактивацією низки генів, відповідальних за контроль клітинного циклу (зокрема, спостерігаються пошкодження генів CDKN2A (MTS1, p16) і INK4B (р14ARF/p15).
Значення делецій інших хромосомних локусів при РСМ менш зрозуміле. Припускається, що делеції короткого плеча хромосоми 17 відбуваються в ході прогресії неінвазивних пухлин сечового міхура в інвазивні. На більш пізніх стадіях прогресії РСМ частішають випадки делецій хромосом 3, 11, 13 і 18. Вважається, що такі молекулярні порушення сприяють придбанню пухлинами сечового міхура метастатичного потенціалу, хоча конкретні гени, відповідальні за даний процес, поки що не виявлені.
Таким чином, прогресування пухлини сечового міхура може бути проілюстрованє у вигляді такої схеми:
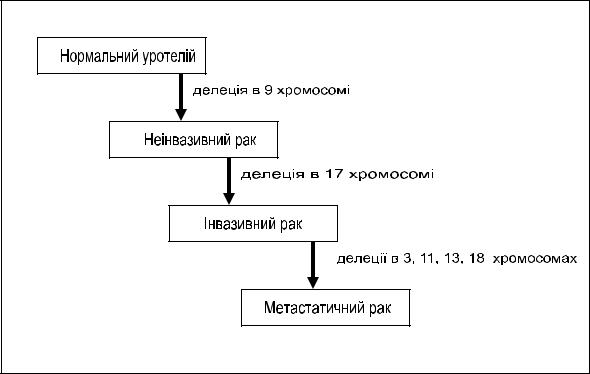
Молекулярні основи прогресування раку сечового міхура (схема)
Анатомія сечового міхура
Сечовий міхур (vesica urinaria) являє собою порожнистий орган, який є резервуаром для накопичення сечі. Сеча періодично виводиться через сечовипускальний канал. Ємність міхура близько 500 – 700 мл і підлягає значним індивідуальним коливанням.
В сечовому міхурі розрізняють: верхівку (apex vesicae), звернену наверх,
тіло (corpus vesicae), дно (fundus vesicae) і шийку (cervix vesicae), яка,
звужуючись, переходить у сечовипускальний канал. У наповненому міхурі розрізняють передню, задню і дві бокові поверхні, які переходять одна в іншу без чітких меж. Найбільш фіксованою і незмінюваною частиною сечового міхура є льєтодіїв трикутник (trigonum vesicae).
Стінка сечового міхура, крім очеревини, яка обгортає верхню, задню і дещо бокові поверхні (tunica serosa), складається з слизового, підслизового шару і м’язової оболонки. Слизова оболонка (tunica mucosa), котра складається з волокнистої сполучної тканини, місцями аденоїдної, в якій іноді зустрічаються скупчення лімфатичних клітин, покриває внутрішню поверхню сечового міхура і пухко з’єднана з підлеглою м’язовою оболонкою. При порожньому міхурі вона складчаста, за винятком невеликого простору трикутної форми (trigonum vesicae), де підслизовий шар відсутній і слизова оболонка тісно зрощена з м’язовою. При розтягненні сечового міхура складки слизової легко згладжуються. Вершиною трикутника є внутрішній отвір сечовипускального каналу (ostium urethrae internum). Підслизовий м’язовий шар трикутника біля верхівки огортає початок сечовипускального каналу і переходить в m. sphincter vesicae, який оточує сечовипускальний канал до diaphragma urogenitalis. Основа трикутника утворена поперечною
підвищеною складкою (plica interureterica), яка з’єднує устя сечоводів (ostium ureteris). Сечоводи пронизують стінку сечового міхура навскоси.
Сечовий міхур розташований у передньому відділі малого таза позаду лонового зчленування. Порожній міхур повністю знаходиться позаду лонового зчленування, а при наповненні піднімається над ним. Форма сечового міхура змінюється також від наповнення і положення сусідніх органів. Передня стінка сечового міхура від симфізу відокремлена пухкою клітковиною, утворюючи передміхуровий простір (spatium retropubicum). Спереду він обмежений передміхуровою фасцією, яка покриває передню поверхню і бокові стінки сечового міхура, ззаду — передньою стінкою міхура, зверху простягається до пупка і обмежено навислою складкою очеревини, а внизу — до дна тазової порожнини і обмежено лобковопередміхуровими зв’язками. Вище сечового міхура передміхурова фасція прилягає до пупкових артерій, які містяться у внутрішньотазовій фасції. Від зовнішнього листка останньої до бокової стінки таза відходить фасціальна пластинка, котра відмежовує передміхуровий простір від решти клітковини таза. Внутрішній листок внутрішньотазової фасції заходить за боковий край задньої поверхні сечового міхура. Сечовий міхур знизу міцно з’єднаний з сечостатевим трикутником. Це досягається за допомогою передміхурової залози, яка міцно зрощена з м’язовим шаром сечового міхура, фасціями тазового дна і сечостатевою діафрагмою. Сечовипускальний канал, який проходить через передміхурову залозу і сечовий трикутник, міцно з’єднує сечовий міхур з тазовим дном. Верхівкою сечовий міхур з’єднаний з пупковим кільцем міхурово-пупкової зв’язки.
Кровопостачання сечового міхура. Артерії сечового міхура йдуть від a. iliaca interna і її пупкової гілки. Верхню частину міхура живлять гілочки a. vesicalis superior, дно і нижню частину — a. vesicalis inferior. Окрім цього,
дно сечового міхура наділене й гілочками a. rectalis media, a. pudenda interior et a. obturatoria. Кожна нижня артерія сечового міхура постачає кров’ю нижній відділ сечоводу, сім’яні пухирці, передміхурову залозу. У жінок кров надходить до сечового міхура з внутрішньої соромітної, маткової і піхвової артерій.
Вени сечового міхура не супроводжують однойменних артерій, а йдуть самостійно. Вони утворюють три сплетіння: соромітне (plexus venosus pudendalis), міхурове (plexus venosus vesicalis) і гемороїдальне (plexus venosus rectalis). Венозна мережа навколо сечового міхура в 15—20 разів більша за артеріальну, у чоловіків вона поширюється на передміхурову залозу, а у жінок охоплює початкову частину сечовипускального каналу. Через венозні сплетіння сечового міхура кров відтікає з передміхурової залози, сім’яних пухирців і кінцевого відділу сім’явиносної протоки, у жінок — від кінцевого відділу сечовипускального каналу. Венозне сплетіння сечового міхура широко анастомозує з венами прямої кишки і з соромітним венозним сплетінням.
Лімфатична система сечового міхура. Відтік лімфи від стінки сечового міхура здійснюється, головним чином, у підчеревні і клубові лімфатичні вузли. Лімфатичні судини відходять уперед, наверх і назад. У
чоловіків вони анастомозують з лімфатичними судинами сім’яних пухирців і передміхурової залози і через них з лімфатичними судинами прямої кишки, а в жінок — з лімфатичною системою піхви і матки. Існують анастомози між лімфатичними судинами сечового міхура, нирок і сечоводу, прямої кишки і внутрішніми статевими органами.
Іннервація сечового міхура здійснюється за допомогою міхурового сплетіння (plexus vesicalis), яке знаходиться, головним чином, біля місця впадіння сечоводів. Нервове сплетіння одержує нерви з двох джерел:
симпатичного походження — від plexus hypogastrici inferioris dexter et sinister
і парасимпатичного nn. splanchnici pelvini. Симпатичні імпульси викликають розслаблення детрузорів і посилення тонусу сфінктера, а парасимпатичні викликають скорочення детрузорів і ослаблення сфінктера.
Морфогенез і гістогенез пухлин сечового міхура
У більшості випадків РСМ розвивається на фоні передракових процесів (атипова гіперплазія, дисплазія слизової оболонки, особливо, коли змінення мультифокальні).
Розрізняють пухлини епітеліального та неепітеліального походження.
До доброякісних неепітеліальних пухлин належать фіброми, міоми, фіброміксоми, гемангіоми, які трапляються дуже рідко,. Дещо частіше зустрічаються злоякісні неепітеліальні пухлини – саркоми, що відрізняються схильністю до метастазування в легені, плевру, печінку та інші органи, швидко інфільтрують стінку сечового міхура і поширюються на сусідні органи.
Найчастіше зустрічаються епітеліальні пухлини сечового міхура – папілома і рак. Під назвою «папілома» прийнято розуміти доброякісне фіброепітеліальне новоутворення ворсинчастої будови. Однак серед папілом сечового міхура зустрічається безліч пограничних і перехідних форм, що дає підставу говорити про їх потенційну злоякісність.
Гістологічно 90-95% випадків РСМ – це перехідноклітинна (папілярна) карцинома, ще 3-5% - плоскоклітинний рак і 2% - аденокарцинома.
Папілярний рак є найпоширенішою формою РСМ. Макроскопічно перехідноклітинний рак подібний до папіломи, але ця пухлина позбавлена ніжки і має широку основу. Пухлина має вигляд цвітної капусти, ділянки, вкриті виразками, чергуються з ділянками некрозу.
Плоскоклітинний рак макроскопічно здебільшого має характерний вигляд бляшки або блюдця.
Аденокарцинома у більшості випадків має вигляд інфільтруючої пухлини.
Класифікація пухлин сечового міхура( ВООЗ 1999 р).,
1. Епітеліальні пухлини сечового міхура 1.1.Доброякісні
1.1.1.Уротеліальна (перехідноклітинна) папілома
1.1.2.Уротеліальна ( ерехідно клітинна) папілома, інвертований тип
1.1.3.Плоскоклітинна папілома
1.1.4Вільозна аденома
1.2. |
Папілярні уротеліальні |
(перехідноклітинні) пухлини з |
|
низьким злоякісним потенціалом |
|
||
1.3. |
Злоякісні |
|
|
1.3.1. |
|
Уротеліальна (перехідноклітинна) карцинома |
|
1.3.1.1. |
Папілярна уротеліальна (перехідно клітинна карцинома |
||
1.3.1.2. |
Інфільтративна уротеліальна ( ерехідно клітинна) карцинома |
||
1.3.1.3 |
Уротеліальна (перехідноклітинна) карцинома in situ |
||
1.3.1.4. |
Атипія/дисплазія |
|
|
1.3.1.5. |
Варіанти уротеліальної (перехідноклітинної) карциноми |
||
1.3.2. |
|
Плоскоклітинний рак |
|
1.3.3. |
|
Верукозна карцинома |
|
1.3.4. |
|
Аденокарцинома |
|
1.3.5. |
|
Рак урахуса |
|
1.3.6. |
|
Світлоклітинна аденокарцинома |
|
1.3.7. |
|
Дрібноклітинний рак |
|
1.3.8. |
|
Недиференційований рак |
|
2.Неепітеліальні пухлини
3.Змішана група пухлин
3.1Парагангліома
3.2.Гематопоетичні і лімфоїдні новоутворення
3.3.Карциносаркома
3.4.Злоякісна меланома
4.Метастатичні пухлини і поширення на сечовий міхур інших пухлин
5.Некласифіковані пухлини
До 95% пухлин сечового міхура мають епітеліальне походження. Найбільш розповсюдженою (понад 90%) гістологічною формою злоякісних епітеліальних новоутворень сечового міхура є перехідноклітинний рак. Зазвичай виділяють дві його форми: папілярну, яка складає 70—75% уперше виявлених пухлин, і непапілярну. Серед непапілярних пухлин виділяють карциному in citu (С15) та інвазивний рак.
Макроскопічно фокуси Са in citu виглядають як еритематозні або бархатисті ділянки слизової, іноді остання може бути набряклою.
Інвазивний перехідноклітинний РСМ може бути представлений макроскопічно у вигляді вузлових утворень, поліповидної або грубоворсинчастої пухлини, іноді — у вигляді покриття виразками або набряклої гіперемованої слизової.
Високодиференційований перехідноклітинний рак за гістологічною картиною мало відрізняється від перехідноклітинної папіломи. Однак сосочки часто мають неправильну форму, вони товщі і коротші, ніж при папіломі, з булавоподібними стовщеннями апікальних відділів. Можна виявити окремі ділянки вираженого клітинного атипізму, де містяться клітини з великими гіперхромними ядрами і повною або частковою втратою полярності, а також є ознаки інвазії у підлеглу тканину. Але ці відмітні ознаки нерідко розкриваються лише при ретельному вивченні зрізів з різних
місць пухлини, у тому числі обов’язково — зрізів, що проходять через ніжку або широку основу пухлини. Низькодиференційований рак подекуди частково зберігає папілярну будову, але різко поліморфні клітини зазвичай позбавлені полярності.
Плоскоклітинний рак складає близько 5% випадків у зонах, не ендемічних за шистосомозом, а в зонах, де шистосомоз розповсюджений, на його частку припадає близько 75% новоутворень сечового міхура. Приблизно 0,5-2% злоякісних епітеліальних пухлин сечового міхура представлені аденокарциномою. Рідше має місце недиференційований рак.
Метастазування
Для раку сечового міхура характерне лімфогенне метастазування. Ураження регіонарних лімфовузлів відмічається у 66%-75% хворих з інвазивним і у 5% пацієнтів з поверхневим РСМ. В 78% випадків уражаються тазові лімфатичні вузли. Найчастіше виявляються метастази в обтураторних (74%), зовнішніх клубових (65%) і паравезикальних (16%) лімфовузлах.
Віддалені метастази розвиваються у 50% хворих з інвазивним РСМ і практично не зустрічаються при поверхневих пухлинах. Найчастіше зазнають ураження печінка (38%), легені (36%), кістки (27%), наднирник
(21%).
Класифікація раку сечового міхура
Понад 90% пухлин сечового міхура представлено перехідно-клітинним раком. Решта 10% складають плоскоклітинний рак та аденокарцинома.
Найбільш поширеною на сьогодні є класифікація TNM, стадіювання згідно з якою найбільш адекватно відображає прогноз захворювання.
TNM клінічна класифікація (шосте видання, 2002 р).
Класифікація принятна тільки до раку при наявності морфологічної верифікації діагнозу. Категорії Т, N, M оцінюються на підставі даних фізикального обстеження, променевих та ендоскопічних методів діагностики. Регіонарними лімфатичними вузлами є лімфовузли таза, які розташовуються нижче рівня біфуркації загальних клубових артерій.
Т - первинна пухлина
Додавання (m) має здійснюватися до відповідної категорії Т - для зазначення множинності ураження. Додавання (is) може бути зроблене до категорії Т - для зазначення одночасної наявності карциноми in situ.
ТХ - первинна пухлина не може бути оцінена Т0 - немає даних про первинну пухлину Та - неінвазивна папілярна карцинома
Tis - карцинома in situ (плоска пухлина)
Т1 - пухлина поширюється на субепітеліальну сполучну тканину Т2 - пухлинна інвазія м’язового шару
Т2а - пухлинна інвазія поверхневого м’язового шару (внутрішня половина)

Т2b - пухлинна інвазія глибокого м’язового шару (зовнішня половина) Т3 - пухлина поширюється на паравезикальну клітковину Т3а - мікроскопічно
Т3b - макроскопічно (екстравезикальний конгломерат)
Т4 - пухлина оширюється на будь-який з таких органів: передміхурову залозу, матку, піхву, стінку таза, черевну стінку Т4а - пухлинна інвазія
передміхурової залози або матки, чи піхви
Т4b - пухлинна інвазія стінки таза або черевної стінки.
|
Рис. 1. Стадія Т раку |
|
сечового міхура |
|
N - регіонарні імфатичні |
|
вузли |
NX |
- регіонарні лімфатичні вузли не можуть бути оцінені |
N0 |
- немає метастазів у регіонарних лімфатичних вузлах |
N1 |
- метастаз в одному регіонарному лімфатичному вузлі не |
перевищує 2 см у найбільшому вимірюванні |
|
N2 |
- метастаз в одному регіонарному лімфатичному вузлі понад 2 см, |
але не більше 5 см у найбільшому вимірюванні, або множинні лімфатичні вузли, жоден з яких не перевищує 5 см у найбільшому вимірюванні
N3 - метастази в регіонарних лімфатичних вузлах понад 5 см у найбільшому вимірюванні
|
М - віддалені метастази |
|
МХ |
- віддалені метастази не можуть бути оцінені |
|
М0 |
- |
немає віддалених метастазів |
М1 |
- |
віддалені метастази |
pTNM - патологоанатомічна класифікація
pT, pN і pM категорії відповідають T, N і М категоріям
|
G - гістопатологічна градація |
|
GX |
- |
ступінь диференціювання не може бути оцінений |
G1 |
- |
високодиференційована пухлина |
G2 |
- |
помірнодиференційована пухлина |
G3-4 - |
низькодиференційована/недиференційована пухлина |
|

|
Групування за стадіями |
Таблиця 11 |
|
|
|
||
Стадія 0а |
Та |
N0 |
M0 |
Стадія 0is |
Tis |
N0 |
M0 |
Стадія I |
T1 |
N0 |
M0 |
Стадія II |
T2a |
N0 |
M0 |
Стадія III |
T2b |
N0 |
M0 |
T3a |
N0 |
M0 |
|
|
T3b |
N0 |
M0 |
Стадія IV |
T4a |
N0 |
M0 |
T4b |
N0 |
M0 |
|
|
Будь-яка T |
N1,2,3 |
M0 |
|
Будь-яка T |
Будь-яка N |
M1 |
Необхідно ще зазначити, що у зв’язку з великою клінічною значущістю інвазії пухлини у м’язовий шар, іноді новоутворення розділяють на дві групи:
-поверхневі (Та, Tis і Т1)
-м’язово-інвазивні (Т2 - Т4)
Прийнято вважати, що в цілому, поверхневі пухлини характеризуються найбільш сприятливим прогнозом і потребують виконання менш розширених хірургічних втручань.
Клінічні прояви раку сечового міхура
Клінічні прояви захворювання залежать від стадії РСМ. Початкові стадії захворювання найчастіше характеризуються безсимптомним перебігом або схожі з симптомами інших захворювань сечовидільної системи, такими як інфекції сечовидільної системи, простатит, сечокам’яна хвороба тощо.
Основним і здебільшого найбільш раннім симптомом РСМ є макрогематурія. Зазвичай гематурія з’являється зненацька «серед повного благополуччя» і, на відміну від гематурії, при сечокам’яній хворобі, не супроводжується болями. Інтенсивність і тривалість гематурії не залежать ні від розмірів пухлини, ні від локалізації її у сечовому міхурі. Гематурія може припинитися таксамо раптово, як і почалась, і не повторюватись тривалий час; іноді інтервал між епізодами гематурії досягає декількох років.
Найчастіше гематурія буває тотальною, але при локалізації пухлини у шийці сечового міхура може носити термінальний характер, тобто виникати лише в кінці акта сечовипускання. Інтенсивна гематурія супроводжується виділенням згустків неправильної форми; іноді згустки можуть призводити до «тампонади сечового міхура» і затримки сечовипускання.
Дизурія – часте і болісне сечовипускання з наявністю імперативних позивів, посідає друге місце серед клінічних проявів РСМ. Патогенез дизурії при різних формах і стадіях хвороби різний. Так, у хворих з інтраепітеліальною карциномою (Tis) дизурія, скоріш за все, зумовлена зміненням порогу чутливості рецепторного апарату в структурах, які формують позиви до сечовипускання. При інфільтруючих формах раку часте
сечовипускання пов’язане, головним чином, з ригідністю стінок і зменшенням ємності сечового міхура внаслідок великого ураження пухлиною.
Екстраорганне поширення пухлинного інфільтрату супроводжується появою болів над лобком, у промежині і в зоні крижів. Обтурація усть сечоводів веде до уретеропієлоектазії, пієлонефритуінирковоїнедостатності.
Фізикальне обстеження
При огляді важливо оцінити загальний стан хворого. При масивній гематурії мають місце прояви анемії: блідість шкірних покривів, слабість, в’ялість. При тампонаді сечового міхура, гострій затримці сечі хворого непокоять постійні позиви на сечовипускання, відчуття розпирання у проекції сечового міхура, біль у надлобковій зоні. В даній ситуації переповнений сечовий міхур пальпується над лоном. При збільшенні об’єму пухлини знижується ємність сечового міхура, порушується його резервуарна функція, що проявляється постійними позивами до сечовипускання з виділенням невеликої кількості сечі, частковим нетриманням. При блокуванні пухлиною устя сечоводу і розвитку гідронефрозу наявний позитивний симптом постукування, пальпується збільшена нирка. Крім того, необхідні ретельний огляд і пальпація зон можливого лімфогенного метастазування. При місцево-розповсюдженому процесі інформативна бімануальна пальпація сечового міхура, яка дозволяє оцінити розміри, рухомість пухлини, наявність інфільтрації оточуючих тканин.
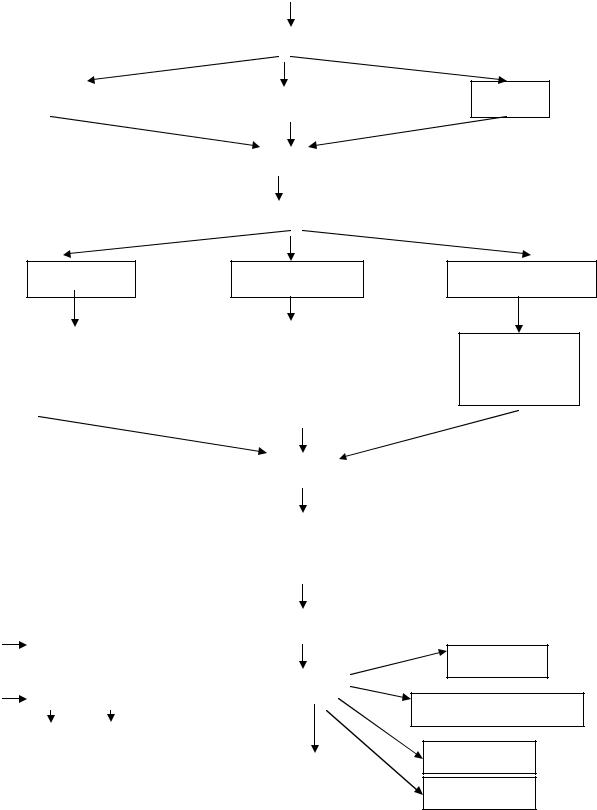
ТОДИ ДІАГНОСТИКИ РАКУ СЕЧОВОГО МІХУРА Діагностичний алгоритм при раку сечового міхура
|
|
|
|
|
Рак сечового міхура |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основні синдроми |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Болі внизу живота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гематурія |
|
|
|
|
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||||
|
|
|
|
Попередній діагноз |
|
|
|
|||
|
|
|
|
|
||||||
|
|
|
||||||||
|
|
Додаткові методи дослідження |
||||||||
|
|
|
|
|
|
|
|
|
|
|
Лабораторні Інструментальні
Загальний аналіз сечі |
|
|
1. |
|
Цитологія |
|
|
||||||||||||
Біохімічний аналіз крові |
|
|
2. |
|
УЗД |
|
|
||||||||||||
Загальноклінічний аналіз сечі |
|
|
3. |
|
КТ |
|
|
||||||||||||
Проба Земницького |
|
|
4. |
|
Екскреторн |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
урографія |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диференціальний діагноз |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Папілома |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цистит |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рак сечового міхура |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Остаточний діагноз |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
Прогноз |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Лікування |
|
|
|
|
|
|
|
Профілактика |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
Первинна |
|
|
Вторинна |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Симптоматична |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
терапія |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дизурія
Цитоморфологічні
Цитологія сечі Гістологія пухлини
Хірургічне
Променева терапія
Хіміотерапія
БЦЖ-терапія
Інструментальні методи обстеження
В діагностиці РСМ важливе місце належить скринінговим методам та дослідженням, спрямованим на установлення самого факту наявності пухлини. Однак для планування адекватного лікування необхідна наявність максимально повної інформації про новоутворення, такої як: гістологічна структура пухлини, її точна локалізація, глибина інвазії, наявність і характер метастазів, наявність мультицентричності, а також наявність синхронних новоутворень з уротелію. В даний час застосовуються:
•цистоскопія;
•біопсія;
•цитологічне дослідження;
•виявлення пухлинних маркерів;
•трансабдомінальна ультразвукова томографія;
•трансректальна ультрасонографія;
•трансвагінальна ультрасонографія;
•рентгенівська комп’ютерна томографія;
•магнітно-резонансна томографія;
•екскреторна урографія;
Незважаючи на стрімкий розвиток методів променевої діагностики, провідну роль в установленні діагнозу РСМ, як і багато десятиріч тому, продовжує відігравати цистоскопія.
Цистоскопія дає можливість констатувати наявність пухлини, закарбувати її повнокольорове зображення, визначити анатомічну форму росту і розміри новоутворення, а також уточнити стан неураженої слизової оболонки і ступінь утягнення в патологічний процес найважливіших у функціональному відношенні структур (трикутника Льєто, усть сечоводів, шийки сечового міхура). У випадку множинних осередків ураження кожен з них може бути охарактеризований окремо.
Виявлені при цистоскопії пухлини за характером росту прийнято ділити на три групи: екзофітні (які ростуть в отвір міхура), ендофітні (інфільтративні), змішані.
Екзофітні пухлини, як правило, розпізнаються легко, у той час як при ендофітному раку сечового міхура інтерпретація ендоскопічної картини може представляти значні труднощі.
При раку in situ цистоскопічна картина, на жаль, позбавлена специфічних рис і може бути абсолютно нормальною. Діагноз карциноми in situ може
бути установлений тільки на підставі морфологічних методів дослідження.
Суттєве покращання візуалізації дрібних пухлин досягається засто-
суванням методу флюоресцентної цистоскопії. Принцип дослідження полягає у виборчому накопиченні клітинами пухлини фотосенсибілізатора-5 амінолевулінової кислоти, який вводиться в порожнину сечового міхура (5 АЛК), що при опроміненні джерелом синього кольору з певною довжиною хвилі обумовлює їх інтенсивне червоне світіння. Метод характеризується високою чутливістю у розпізнанні уротеліальних новоутворень (96,5%), однак його суттєвим недоліком є велика кількість хибнопозитивних
результатів, що досягає 38%. На сьогодні дослідження за допомогою флюоресцентної цистоскопії не є стандартним методом діагностики, і її застосування носить статус клінічного експерименту.
Біопсія сечового міхура переслідує декілька цілей:
-морфологічне підтвердження діагнозу;
-визначення рівня гістологічного диференціювання пухлини;
-з’ясування глибини інвазії пухлиною стінки сечового міхура (визначення Т).
Біопсія може бути здійснена або за допомогою щипців, які вводяться
через цистоскоп (так звана «холодна біопсія», або за допомогою трансуретральної резекції сечового міхура (ТУР біопсія).
Достоїнством «холодної біопсії» є відсутність термічних коагуляційних пошкоджень, взятих для дослідження шматочків тканини. «Холодна» біопсія може використовуватись для пошуку осередків раку in situ. При цьому іноді виконується біопсія випадково обраних ділянок слизової оболонки сечового міхура (рандомізована біопсія), тому що змінення цистоскопічної картини при карциномі in situ часто відсутні. Можливості «холодної біопсії» обмежені отриманням маленьких шматочків тканини з поверхні слизової оболонки. Тому метод не дозволяє відповісти на питання про глибину пухлинної інфільтрації стінки сечового міхура.
Трансуретральна біопсія – необхідна для судження про рівень інвазії, зокрема, про поширення пухлини на м’язові шари. При цьому водночас з отриманням матеріалу для гістологічного дослідження нерідко вдається здійснити, так би мовну, «тотальну біопсію» - видалення пухлини у межах здорових тканин, тобто операція з діагностичної перетворюється в лікувальну.
Цитологічне дослідження осаду сечі (або промивної рідини) також дозволяє одержати морфологічне підтвердження діагнозу пухлини сечового міхура.
Достоїнствами методу є: неінвазивність, висока вірогідність результатів (від 40% до 83%) і відносна дешевизна. Завдяки саме цим рисам метод широко використовується для скринінгу раку сечового міхура, діагностики карциноми in situ і моніторингу після лікування поверхневих пухлин. Матеріал для цитологічного дослідження – осад сечі. Чутливість методу різна для пухлин різного диференціювання. При високо диференційованих пухлинах, за різними даними, чутливість складає від 20 до 40%. При помірнодиференційованих пухлинах – від 20 до 50%. При низько- і недиференційованих – від 60 до 90%.
Найбільш інформативне цитологічне дослідження сечі при раку in situ (більше 90%).
До недоліків дослідження можна віднести те, що цитологічна діагностика у значній мірі суб’єктивна, і вірогідність результату суттєво залежить від досвіду і кваліфікації лікаря-лаборанта.
Виявлення пухлинних маркерів раку сечового міхура в сечі
Цей напрямок у діагностиці новоутворень сечового міхура активно розвивається впродовж останнього десятиріччя. До числа маркерів, які одержали найбільшу популярність, належать:
-антиген пухлин сечового міхура (ВТА);
-протеїн ядерного матриксу (NMP 22);
-продукти деградації фібриногену;
-рівень теломерази;
-цитокератин СК20.
Вклінічних дослідженнях найбільша увага приділяється методам визначення в сечі специфічного антигену, асоційованого зі злоякісною пухлиною сечового міхура (bladder tumor antigen, ВТА). Запропоновані дві методики (тести), котрі грунтуються на використанні моноклональних антитіл. Вони є простими і доступними, не вимагають спеціальної лабораторії. При необхідності, можуть бути здійснені пацієнтом самостійно. Даний тест може рекомендуватися для скринінгу хворих на РСМ.
Іншим, добре вивченим маркером, є NMP 22 (білок матриксу ядер), який виявляється у сечі при десквамації та лізисі клітин уротелію на фоні розвитку раку сечового міхура. Тест за його визначенням реалізований як експрес - метод якісного аналізу і також може бути використаний для скринінгу. Решта тестів перебувають у стадії вивчення.
Трансабдомінальна ультразвукова томографія є одним з головних компонентів обстеження з приводу РСМ. Перевагами методики є: безпечність, можливість чітко візуалізувати більшість пухлин, розташованих
узоні бокових стінок сечового міхура, можливість оцінити стан нирок, верхніх сечових шляхів і зон метастазування.
Недоліки методу: погано виявляються пухлини, розташовані в зоні передньої стінки, шийки сечового міхура і трикутника Льєто (в таких випадках вдаються до трансректальної і трансвагінальної ультрасонографії).
Трансректальна і трансвагінальна ультрасонографія
Достоїнством методів є можливість візуалізації зон, недоступних при трансабдомінальній ультразвуковій томографії. Існує також і трансуретральний метод діагностики, однак він вважається інвазивним і рідко застосовується в практиці.
Ультразвукові дослідження незамінні у тих випадках, коли через пов’язану з гематурією непрозорість оптичного середовища неможливе застосування цистоскопії.
Рентгенівська комп’ютерна томографія може застосовуватись для виявлення первинної пухлини сечового міхура та її метастазів. На жаль, можливості методу в оцінці ступеня інтрамуральної інвазії дуже обмежені.
Магнітно-резонансна томографія дозволяє одержати досить обширну інформацію про глибину інфільтрації пухлиною стінки сечового міхура. Крім
того, важливим достоїнством МРТ є можливість виявляти на самих ранніх стадіях осередки метастатичного ураження кісток.
Екскреторна урографія застосовується для оцінки видільної функції нирок і стану верхніх сечових шляхів (зокрема, з метою виключення пухлин миски і сечоводу, які розвиваються синхронно).
Скринінг раку сечового міхура
Проводились численні дослідження із застосуванням різних варіантів скринінгових програм, однак жодна з них не була ефективною. Зараз скринінг РСМ не проводиться.
Фактори прогнозу
На виникнення і перебіг захворювання впливають стать, вік пацієнтів, тривалий вплив вищеперерахованих сприятливих факторів, гістологічна форма РСМ і ступінь його розповсюдження.
Лікування раку сечового міхура
Вирішальним моментом при виборі методу лікування та визначенні прогнозу є поділ пухлин сечового міхура на поверхневі (Tis-Ta-T1) та інвазивні (T2-T3-T4). Крім того, суттєвий вплив на лікувальну тактику чинить виділення у групі поверхневих пухлин Тis.
Carcinoma in situ (CIS) є інтраепітеліальною пухлиною, для клітин якої характерна відсутність здатності до адгезії. Втрата міжклітинних зв’язків є причиною агресивного клінічного перебігу даної пухлини, яка характеризується надто високим ризиком прогресії з розвитком інвазії стінки сечового міхура і дисемінацією пухлинного процесу. Ступінь гістопатологічного диференціювання також є значущим прогностичним фактором і впливає на вибір тактики лікування.
Лікування раку сечового міхура Ta і T1 стадій
Оптимальним методом лікування поверхневого раку Ta і Т1 стадій є трансуретральна резекція (ТУР) сечового міхура. При цьому виконується послідовна резекція екзофітного компоненту, а потім ніжки та основи пухлини за допомогою петлі резектоскопа. ТУР необхідно виконувати таким чином, щоб максимально зберегти архітектоніку стінки органа і співвідношення пухлини з усіма її шарами. З метою підвищення радикальності виконуваного втручання можливе застосування флуоресцентного контролю, заснованого на появі в синьому світлі червоного світіння пухлини, індукованого 5-амінолевуліновою кислотою.
Біопсія незміненої слизової повинна виконуватися в усіх випадках при позитивному результаті цитологічного дослідження сечі, навіть при
відсутності пухлини або наявності непапілярного новоутворення сечового міхура.
Усі видалені тканини підлягають гістологічному дослідженню. Шматочки пухлини і підозрілі у відношенні пухлинного росту ділянки стінки сечового міхура повинні бути промаркіровані з метою адекватної оцінки ступеня розповсюдження пухлинного процесу. З метою правильного установлення стадії Т необхідне роздільне вивчення екзофітного компонента та основи пухлини.
Основними ускладненнями ТУР сечового міхура є інтра- і післяопераційна кровотеча та перфорація сечового міхура.
При наявності невиликої кількості (1-3) дрібних поверхневих пухлин і верифікованому діагнозі можливе виконання трансуретральної коагуляції (ТУК) змінених ділянок слизової.
Відкрита резекція сечового міхура, показаннями до виконання є:
-первинне ураження сечового міхура;
-єдина пухлина по передній, задній, бокових стінках, на верхівці або дні сечового міхура;
-відстань від шийки не менше 3 см, розмір не більше 5 см;
-достатня ємність і функція сечового міхура.
Резекцію також виконують у хворих похилого віку з обтяжливим соматичним станом. При резекції сечового міхура бажано виконувати двосторонню тазову лімфаденектомію. У разі розташування пухлини поблизу устя сечоводу формують уретеро-неоцистоанастомоз.
При виборі методу подальшого лікування хворих на РСМ Ta і Т1 стадій необхідно брати до уваги ризик розвитку рецидиву і прогресування пухлинного процесу, можливість розвитку побічних ефектів і співвідношення: ціна - ефективність. Частота рецидивів поверхневого РСМ, навіть після адекватного лікування, дуже висока і досягає 30%-80%. Ризик рецидування і прогресії може бути передбачений на підставі клінічних і морфологічних даних.
Фактори прогнозу розвитку рецидиву, в порядку убування значущості,
такі:
-кількість пухлин на момент установлення діагнозу;
-частота рецидивів у попередньому періоді; рецидив через 3 місяці після лікування;
-розмір пухлини: чим більша пухлина, тим вищий ризик рецидиву;
-ступінь гістопатологічного диференціювання пухлини.
Найважливіше прогностичне значення розвитку інфільтра-тивного росту має ступінь анаплазії і стадія Т пухлини.
Грунтуючись на згаданих прогностичних факторах, усі поверхневі пухлини сечового міхура можуть бути розділені на такі групи ризику:
-група низького ризику: одиничні пухлини TaG1 менше 3 см в діаметрі;
-група високого ризику: T1G3, множинні або часто рецидивуючі пухлини, Tis;
-група помірного ризику: решта поверхневих пухлин
Ta-1 G1-2, множинні пухлини більше 3 см в діаметрі.
В усіх випадках безпосередньо після ТУР сечового міхура показана внутрішньоміхурова хіміотерапія. Це дозволяє знизити ризик розвитку рецидиву на 50%.
Хворим, які належать до груп помірного і високого ризику розвитку рецидиву, необхідне проведення 4-8–тижневого курсу внутрішньоміхурової БЦЖабо хіміотерапії. Показанням до того, щоб відкласти або припинити лікування, є тяжка дизурія. В основному, профілактичний вплив інтравезикальної терапії реалізується безпосередньо після її проведення. Тому у разі відсутності розвитку рецидиву більш ніж через 6 місяців після втручання, подальше застосування внутрішньоміхурової терапії не показане.
Пацієнтам групи низького ризику додаткове лікування не показане. Ад’ювантна внутрішньоміхурова БЦЖ-терапія, уперше запропонована
Morales в 1976 р., має високу ефективність при поверхневих пухлинах сечового міхура з високим ризиком розвитку рецидиву і є методом вибору при проведенні ад’ювантного лікування даної категорії хворих. Вакцина БЦЖ являє собою завись життєздатних бацил Кальмета-Герена, механізм її протипухлинної дії остаточно не вивчений, однак відомо, що в його основі лежить індукція місцевої імунної відповіді, в якій задіяні макрофаги, Т- лімфоцити і ряд цитокінів.
Ад’ювантна БЦЖ-терапія дозволяє знизити частоту рецидивів поверхневого раку після ТУР сечового міхура, а також сприяє збільшенню специфічного виживання даної групи хворих.
Найбільш поширеним ускладненням БЦЖ-терапії є цистит, який розвивається у 90% хворих. В 40% спостережень відзначають появу макрогематурії. Більш серйозними побічними ефектами є фебрильна лихоманка (3%), грануломатозний простатит (0,9%), пульмоніт і гепатит (0,7%). БЦЖ-сепсис має місце у 0,4% пацієнтів. В літературі описано декілька летальних наслідків розвитку даного ускладнення внутрішньоміхурової БЦЖ-терапії.
Тяжкі місцеві, а також системні ускладнення БЦЖ-терапії потребують проведення терапії протитуберкульозними препаратами (ізоніазид у дозі 300 мг на добу, рифампіцин у дозі 600 мг на добу, етамбутол у дозі 1200 мг на добу). Специфічне лікування БЦЖ-циститу проводять до моменту зникнення клінічних симптомів і, потім, протягом 2 тижнів після зникнення скарг. При генералізації інфекційного процесу протитуберкульозна терапія застосовується до 6 місяців.
Препаратом вибору для проведення внутрішньоміхурової хіміотерпії є протипухлинний антибіотик - мітоміцин С. Стандартна лікувальна доза препарату не визначена, у більшості випадків внутрішньоміхурово вводиться від 20 мг до 40 мг мітоміцину С, розведеного 20-40 мл дистильованої води. Рання профілактична інтравезикальна терапія мітоміцином С дозволяє знизити ризик рецидування поверхневого РСМ на 15%. Мітоміцин С дозволяє домогтися результатів, аналогічних таким при проведенні профілактичної імунотерапії.
З метою профілактики рецидивів РСМ можливе внутрішньо-міхурове введення тіофосфаміду і доксорубіцину, які значно поступаються за ефективністю мітоміцину С і вакцині БЦЖ.
За наявності субтотального і тотального поверхневого ураження сечового міхура та неможливості виконати радикальну ТУР, іа також у разі протипоказань до цистектомії можливе проведення 6-8-тижневих курсів лікувальної внутрішньоміхурової хіміотерапії. Частота досягнення повної регресії при застосуванні мітоміцину С складає 39%, ТіоТЕФ – 27%. Наявність резидуальної пухлини після проведення внутрішньоміхурової хіміотерапії є показанням до виконання ТУР сечового міхура.
Лікування carcinoma in situ сечового міхура
Стандартним лікуванням РСМ in situ є проведення шести щотижневих внутрішньоміхурових інстиляцій вакцини БЦЖ. Повна ремісія відзначається у 70% випадків. При збереженні позитивних результатів цитологічного дослідження сечі і гістологічного дослідження біоптату слизової, показане проведення додаткового курсу внутрішньоміхурової БЦЖ-терапії. Застосування другого курсу імунотерапії дозволяє домогтися повного ефекту ще у 15% хворих. З метою попередження рецидиву призначається підтримуюча терапія у вигляді щомісячних інстиляцій протягом 36 місяців. У разі неефективності другого курсу лікування, а також раннього розвитку рецидиву показане виконання цистуретректомії через безперспективність подальшого консервативного лікування.
Радикальна цистектомія на сьогодні є стандартом лікування інвазивних пухлин сечового міхура. Показаннями до цистектомії є:
•інвазивний рак сечового міхура T2-4аN0-xM0;
•часто рецидивуючі поверхневі пухлини, не вилікувані за допомогою ТУР та внутрішньоміхурової терапії;
•рак in situ не вилікуваний БЦЖ-терапією;
•пухлини T1G3;
•прогресуючі розповсюджені поверхневі новоутворення;
•множинні пухлини сечового міхура.
Говорячи про радикальну цистектомію мається на увазі видалення сечового міхура єдиним блоком з простатою і сім’яними міхурцями у чоловіків або маткою з придатками у жінок. Також видаляється проксимальний відділ уретри, видалення сечови-пусканьного каналу вважається необхідним при ураженні шийки сечового міхура у жінок і простатичного відділу уретри у чоловіків.
Радикальна цистектомія також може включати тазову лімфаденектомію з обох боків. Лімфодисекцію починають на 2 см вище від рівня біфуркації аорти: видаляються загальні, зовнішні і внутрішні клубові, а також запираючі лімфовузли з обох боків, що дозволяє одержати додаткову інформацію, яка стосується прогнозу захворювання. Лікувальна роль лімфодиссекції при
раку сечового міхура не знайшла підтвердження в рандомізованих дослідженнях.
Цистектомія є травматичним хірургічним втручанням, яке супроводжується значною кількістю післяопераційних ускладнень (11%-
70%): тривалий парез кишечника (6%-70%), недостатність уретрорезервуарного анастомозу (19%), недостатність міжкишкового анастомозу (4%-12%). Післяопераційна летальність коливається від 1% до 4%.
Відведення сечі після повного видалення сечового міхура є основним питанням, від рішення якого залежить подальша якість життя хворих. На сьогодні існує три основних методи відведення сечі після цистектомії:
-зовнішнє відведення сечі (уретерокутанеостомія, кишкова пластика з формуванням «сухої» або «вологої» стоми);
-внутрішнє відведення сечі у безперервний кишечник;
-створення кишкових резервуарів, що забезпечує можливість контрольованого сечовипускання.
Найтиповіші операції:
-Операція Брикера (створення ілеального кондуїту) – після радикальної цистектомії виділяють сегмент клубової кишки довжиною 15–20 см і проксимальний кінець сегмента ушивають. Дистальний кінець сегмента виводять на шкіру. Накладають анастомози між сечоводами і проксимальною частиною сегмента, відступивши від ушитого кінця на 3-4 см. Операція Брикера була запропонована в 1950 р. і досі широко застосовується у клінічній практиці, будучи стандартом, з яким порівнюються результати інших операцій деривації сечі. Операція Брикера забезпечує задовільні функціональні результати, однак у віддаленому післяопераційному періоді у 20% хворих розвиваються стриктури стоми, в 30% випадків відзначається дилатація чашково-мискової системи, хронічний пієлонефрит.
-Операція Стьюдера (формування ортотопічного резервуара) – після виконання радикальної цистектомії виділяють сегмент клубової кишки, довжиною 55–60 см. З детубулязованих дистальних 40 см сегмента формують сферичний резервуар. Накладають анастомози між сечоводами і нерозсіченою привідною частиною сегмента (довжина привідного відділу 15 см). Формують анастомоз з уретрою.
Післяопераційна летальність після подібних операцій у великих центрах складає 2–5%.
Основним фактором, який визначає якість життя після цистектомії, є можливість контролювати виділення сечі. У зв’язку з цим запропоновано безліч варіантів утримуючих сечу резервуарів, які пацієнт, у міру необхідності, опорожнює шляхом аутокате-теризації.
Для створення утримуючих резервуарів використовуються різні відділи шлунково-кишкового тракту: шлунок, сегмент клубової кишки, ілеоцекальний відділ, сигмовидна і пряма кишки.
Запропоновано численні варіанти створення утримуючих сечу механізмів:
- інвагінаційний клапан на відвідному з резервуара сегменті кишки, звуження відвідного сегмента клубової кишки і Баугінієвої заслінки спеціальними швами (Indiana pouch),
-інвагінування відвідного сегмента кишки та проведення інвагінату через Боугінієву заслінку (Mainz pouch),
-використання апендикса, проведеного через підслизовий тунель. З метою профілактики розвитку пієлонефриту дистальні відділи сечоводів імплантуються в резервуар з використанням антирефлюксних методик.
При формуванні утримуючих резервуарів у 12% пацієнтів розвиваються ранні, у 37% - пізні ускладнення. Основними ускладненнями у віддаленому післяопераційному періоді є стриктура і/або обструкція сечоводів, сечонетримання, складності аутокатетеризації, формування конкрементів у порожнині резервуара. Досить часто у даної категорії хворих відзначаються метаболічні розлади.
Як уже зазначалося вище, заміщення сечового міхура ділянками тонкої і товстої кишки з формуванням анастомозу між кондуїтом і уретрою є операцією вибору, але не завжди здійсненною. Не можна її виконати у таких випадках:
-при пухлинному ураженні уретри;
-при рубцевих і постпроменевих зміненнях сечовипускального каналу;
-при виникненні в ході операції ускладнень, які унеможливлюють виконання первинної пластики;
-в ситуаціях, коли виконання цистектомії і пластики в один етап не можливе (кровотеча з вираженою анемією, блокування верхніх сечовивідних відділів, тяжкі супутні захворювання, сумніви щодо радикальності операції).
В подібних випадках необхідно виконувати цистектомію з формуванням кондуїту і відведенням сечі, минаючи сечовипускальний канал.
Клініка онкології Донецького державного медичного університету на протязі більше 30 років розроблює оптимальні варіанти пластичних втручань, спрямованих на заміщення сечового міхура.
Ректоцистопластика розроблена у клініці в 1967 р, досвід виконання подібних операцій дозволяє рекомендувати цей варіант як метод вибору. Методика формування штучного сечового міхура з прямої кишки полягає у тому, що після виконання цистектомії здійснюють перев’язку і перетин верхньої прямокишкової артерії на рівні малого таза, мобілізують пряму кишку на рівні верхньоампулярного відділу. Кишку прошивають механічним швом, куксу занурюють у попередньо накладений кисетний шов. При необхідності додатково накладають серо-серозні вузлові шви. Приступають до формування тунелю ззаду кукси прямої кишки до м’язів тазового дна. Після цього пересаджують сечоводи в ізольовану куксу прямої кишки, використовуючи інвагінаційний анастомоз. З боку промежини, інтрасфінктерно, зводять сигмовидну кишку на промежину. Через 10-12 діб відсікають надлишок зведеної кишки.
Методика створення штучного сечового міхура з тонкої кишки зі зведенням дистального її відділу через сфінктер прямої кишки на промежину.

Після радикальної цистектомії клубову кишку перетинають на відстані 20-25 см від ілеоцикального кута і мобілізують на протязі 30-35 см, де повторно перетинають. Безперервність тонкої кишки відновлюють. Мобілізовану петлю тонкої кишки з брижею вкладають так, щоб її дистальну ділянку можна було звести на промежину. З кишки формують Т-подібний резервуар, у який пересаджують сечоводи. Між слизовою і сфінктером прямої кишки формують тунель, через який дистальну ділянку мобілізованої тонкої кишки зводять на промежину. Утримання сечі здійснюється за допомогою сфінктерів прямої кишки. Тонкокишковий штучний сечовий міхур дозволяє утримувати сечу 4-6 годин і контролювати позиви до сечовипускання.
Другим варіантом методу тонкокишкової цистопластики є методика зі зведенням дистального кінця кишки через уретральний сфінктер на шкіру промежини під калиткою.
Цистопластика за допомогою ізольованого відрізка сигмовидної кишки та її зведенням через анальний сфінктер на промежину є альтернативою способу формування штучного сечового міхура з тонкої кишки.
Після виконання зазначених оперативних втручань хворі, як правило, не відзначають безконтрольного відходження сечі, яка утримується анальним або уретральним сфінктером протягом 3-5 годин.
У тих випадках, коли пухлинний процес не поширюється на проксимальний відділ уретри, для формування штучного сечового міхура у ДОПЦ використовуються різні відділи тонкої, товстої кишки або ілеоцекального кута з накладанням неоцистоуре-троанастомозу.
Надто складною проблемою є формування штучного сечового міхура з тонкої і товстої кишки у тих випадках, коли використання з пластичною метою уретри з тих чи інших причин неможливе. У цьому випадку операцією вибору залишається формування ректального сечового міхура, або один із способів створення сечоприйомника з клубової або сигмовидної кишки з використанням анального сфінктера або м’яза тазового дна, який мав би достатню ємність і затульний апарат, здатний попереджувати безконтрольне відходження сечі. Запропоновані варіанти хірургічних втручань дозволяють у ряді випадків успішно вирішити дану проблему.
Рецидиви найчастіше розвиваються протягом 24 місяців після операції. Можливе виникнення рецидивних пухлин у порожнині малого таза (15%- 20%), а також метастазів у регіонарні лімфовузли (10%-15%) і віддалених метастазів. Крім того, слід брати до уваги ризик прогресування пухлини в уретрі (5%-13%) і, рідко, верхніх сечових шляхах (1%-3%).
П’ятирічне виживання після цистектомії складає 40%-60%. Незалежними факторами, котрі впливають на прогноз, є тільки стадія Т і наявність регіонарних метастазів. Так, 5-річне виживання хворих при стадії рТis
складає 78%-100%, рТ1 – 69%-95%, рТ2 – 63%-70%, рТ3а – 47%-53%, рТ3в –
31%-33%, рТ4 – 19%-28%. Наявність метастазів у регіонарні лімфовузли різко погіршує прогноз: рубіж 5 років переживає тільки 7% пацієнтів зі стадією N+.
Променева терапія є альтернативним методом лікування інвазивного РСМ. Результати опромінення поступаються таким при хірургічному втручанні. Тому променева терапія проводиться пацієнтам, які мають протипоказання до цистектомії або відмовились від операції. Однак у ряді країн опромінення залишається методом вибору при інфільтративних пухлинах.
Радикальна променева терапія застосовується при РСМ T1-4N0M0. Проведення опромінення можливе при достатній ємності і збереженій функції сечового міхура, відсутності тяжкої сечової інфекції, передуючих запальних захворюваннях органів таза або хірургічних втручаннях на них, які спричинилили розвиток вираженого зростового процесу.
Найчастіше застосовують зовнішню дистанційну променеву терапію. Прийнятий обсяг опромінення включає сечовий міхур, паравезикальну клітковину і лімфатичні вузли нижче біфуркації загальних клубових артерій. Однак до цього часу не одержано переконливих даних, які б свідчили про те, що опромінення тазових лімфовузлів сприяє збільшенню виживання. Опромінення проводять до сумарної осередкової дози 60-65 Гр у разових осередкових дозах 1,8-2 Гр. Тривалість лікування складає 6-7 тижнів.
Брахітерапія є альтернативою дистанційній променевій терапії при солітарних пухлинах менше 5 см в діаметрі. Даний метод дозволяє підвести джерела опромінення безпосередньо до новоутворення, що створює умови для максимального пошкодження пухлини при мінімальному впливові на оточуючі тканини. Внутрішньотканинна терапія дозволяє досягти оптимального співвідношення між загальною та осередковою дозами.
Застосовуються методики введення постійного радіоактивного джерела (Au98) і гнучких джерел (Cs137,Ir192,Ta182), які видаляються.
В даний час широко досліджується роль симультанної хіміотерапії як індуктора ефекту опромінення.
У більшості хворих, які одержують променеву терапію на зону таза, розвиваються ентерит, проктит, цистит. Зазвичай дані ускладнення помірно виражені і купіруються самостійно. Еректильна дисфункція виникає у 2/3 чоловіків, які одержують променеву терапію.
Повна регресія відзначається у 30%-50% хворих з інвазивним РСМ, які зазнали опромінення. Виконання ТУР сечового міхура перед початком променевої терапії забезпечує покращення місцевого ефекту лікування. Факторами, корелюючими з високою ефективністю консервативного лікування інвазивного РСМ, є невеликі розміри пухлини, відсутність гідронефрозу, радикальне виконання ТУР сечового міхура і повний ефект індукційного лікування.
Частота рецидування після опромінення за радикальною програмою складає близько 50%.
Променева терапія забезпечує задовільне 5-річне виживання, яке досягає 24%-46%. Прогноз захворювання залежить від стадії Т: віддалене виживання при стадії Т2 складає 26%-59%, Т3а – 35%-52%, Т3в – 23%-29%. Крім того,
на тривалість життя пацієнтів, які одержували променеву терапію, впливають ступінь анаплазії, розмір і локалізація пухлини, стан верхніх сечовивідних шляхів.
Неповна регресія пухлини, а також виникнення рецидиву є показанням до виконання цистектомії. Виконати радикальну рятівну цистектомію після спроби радикальної променевої терапії вдається в 80% випадків. При цьому 5-річне виживання прооперованих хворих складає 35%-50%.
Хіміотерапія раку сечового міхура
На сьогодні активно досліджується роль неоад’ювантної, ад’ювантної, сполученої з опроміненням і проведеної в монорежимі хіміотерапії.
Неоад’ювантну хіміотерапію проводять перед хірургічним або променевим лікуванням. Мета неоад’ювантної хіміотерапії:
•зменшення об’єму пухлини;
•вплив на субклінічні мікрометастази;
•підвищення резектабельності пухлини;
•підвищення виживання.
Головна перевага неоад’ювантної хіміотерапії – можливість оцінити її вплив на первинний осередок, що може визначати тактику подальшого лікування. Неоад’ювантна хіміотерапія відіграє важливу роль у подальшому рішенні про органозберігаюче лікування. Показання до неоад’ювантної хіміотерапії – стадії Т2–Т4а РСМ. Рекомендована схема: 3 курси MVAC (метотрексат, вінбластин, адріаміцин і цисплатин).
В рандомізованих дослідженнях не знайшов підтвердження факт, що неоад’ювантна хіміотерапія сприяє збільшенню виживання, однак її ефективність є прогностично значущим фактором. Окремим хворих на
інвазивний рак проведення неоад’ювантної хіміотерапії дозволяє зберегти сечовий міхур. Більшість дослідників не виявили переваги виживання внаслідок застосування ад’ювантної хіміотерапії.
Ад’ювантна хіміотерапія при інвазивному РСМ забезпечує 3-річне безрецидивне виживання, котре досягає 56%. Ад’ювантну хіміотерапію проводять після радикальної операції та отримання результатів гістологічного дослідження. Лікуванню підлягають хворі зі стадією рТ2b– 4N0–1М0, соматично збережені, здатні перенести не менше 4 курсів хіміотерапії. Проводились рандомізовані дослідження із застосуванням різних схем ад’ювантної хіміотерапії, у більшості з них були одержані дані про продовження безрецидивного періоду, порівняно з контрольною групою (тільки радикальна операція). Рекомендовані режими MVAC, цисплатин / гемцитабін.
При РСМ з віддаленими метастазами довгий час найбільш ефективним методом лікування було проведення поліхіміотерапії за схемою М-VAC (метотрексат, вінбластин, адріаміцин, цисплатин). При цьому віддалене виживання досягає 15%-20%; у групі пацієнтів з вісцеральними метастазами
– 15%, у хворих з ураженням лімфовузлів – 30%. Середня тривалість життя складає 13 місяців. На жаль, даний режим характеризується вираженою токсичністю. Нещодавно введена в клінічну практику схема, яка включає гемцитабін і таксани, дозволяє домогтися аналогічних результатів. При цьому токсичність даного режиму набагато нижча, ніж M-VAC. Крім того, показано, що застосування гемцитабіну в поєднанні з таксанами дозволяє домогтися відчутного ефекту у пацієнтів, яким безрезультативно проводилось лікування M-VAC.
Розроблені в клініці ДОПЦ варіанти проведення ад’ювантної
ендолімфатичної і внутрішньоартеріальної поліхіміотерапії дозволяють значно покращити результати лікування хворих на РСМ після виконання великих резекцій сечового міхура за рахунок більш тривалого контакту хіміоагента у високих концентраціях із зоною резекції і шляхами лімфовідтоку.
Диспансеризація та спостереження за хворими після ТУР сечового міхура
Нерадикальне видалення пухлини, імплантація клітин раку у травмовану слизову сечового міхура, а також швидкий ріст епітеліальної пухлини призводять до частих рецидивів перехідно-клітинного раку протягом перших трьох місяців після ТУР. Тому усім хворим необхідне виконання контрольної цистоскопії через 3 місяці після операції. При низькодиференційованих поверхневих пухлинах рекомендується виконувати повторну контрольну ТУР зони резекції менш ніж через 3 місяці після хірургічного втручання, наступне обстеження може бути виконане через 9 місяців, а далі – щорічно протягом 5 років. При виникненні рецидивної пухлини у 95% випадків її гістологічні ознаки аналогічні таким у первинного новоутворення.
Традіційного виконання екскреторної урографії при динамічному спостереженні не вимагається через рідкісне утворення пухлин верхніх сечових шляхів у хворих на РСМ. Даний метод обстеження показаний пацієнтам з carcinoma in situ при збереженні позитивних результатів цитологічного дослідження сечі.
Спостереження за хворими після радикальної цистектомії
Протягом першого півріччя після радикальної цистектомії обстеження має проводитися кожні 3 місяці, протягом наступних 1,5 року – кожні 6 місяців, далі – щороку. Контрольне обстеження включає УЗКТ порожнини малого таза, печінки і нирок, а також уретроскопію і рентгенографію органів грудної клітки.
Динамічне спостереження при органозбереженому лікуванні:
Рекомендують дотримуватися таких алгоритмів динамічного спостереження.:
•Цистоскопічне дослідження з цитологічним аналізом сечі, УЗД малого таза, черевної порожнини, біохімічний і загальний аналізи крові у перші 2 роки 1 раз у 3 міс., 3–4-й рік – 1 раз у 6 міс., далі – 1 раз на рік.
•Рентгенографічне дослідження грудної клітки 1 раз у 6 міс.
•КТ, МРТ, внутрішньовенна урографія 1 раз на 1–2 роки.
•При радикальній цистектомії:
•УЗД малого таза, черевної порожнини, нирок, рентгенографія грудної клітки, загальний і біохімічний аналізи крові 1 раз у 3 міс. протягом 1 року, наступні 3 роки – 1 раз у 6 міс., далі – 1 раз на рік.
•КТ, МРТ, внутрішньовенна урографія 1–2 рази на рік.
Сканування кісток скелета, КТ грудної клітки виконують при підозрі на наявність віддалених метастазів (для динамічного спостереження) у хворих з генералізованим РСМ.
Прогноз залежить від стадії РСМ і характеру проведеного лікування. Після радикальної операції 5-річне виживання доходить до 50%. Найкращі результати спостерігають при комбінованому лікуванні (резекція сечового міхура з променевою терапією). П’ятирічне виживання при стадіях Т 1-2
складає 50-80%, стадіях ТЗ-4 – 20-30%.
За даними більшості авторів, найчастіше рецидив після радикальної цистектомії виникає протягом перших 2-х років. Найбільш значущими прогностичними факторами, які впливають на розвиток рецидиву, є глибина проростання пухлини, ступінь диференціювання, утягнення лімфатичних вузлів.
Рецидиви раку після резекції сечового міхура відзначаються в 56%-65,5% випадків. При цьому можливе виникнення рецидивних пухлин на значній відстані від зони операції.
П’ятирічне виживання хворих з інвазивним РСМ після резекцій різного обсягу складає 32,5%-79,4%. Імовірність рецидивів і тривалість життя пацієнтів залежать від стадії Т і ступеня анаплазії пухлини. Відзначено
збільшення частоти рецидивів і зменшення виживання після резекцій сечового міхура при локалізації новоутворення в зоні шийки і трикутника Льєто.
Віддалені результати органозберігаючого лікування інвазивного РСМ покращуються при використанні комбінованого підходу з проведенням неоад’ювантної променевої, хіміоабо хіміопроменевої терапії.
Змінення ставлення до питань якості життя останнім часом викликає підвищення інтересу до органозберігаючого лікування інфільтративних пухлин. Якість життя залишається задовільною за умови збереження більше 50% об’єму органа. Після операцій великого обсягу накопичувальна і скорочувальна функції сечового міхура, як правило, порушуються.
Радикальна цистектомія з деривацією сечі – одне з найскладніших оперативних втручань в реконструктивній урології, котре вимагає від уролога знання у декількох суміжних дисциплінах. Строк життя пацієнтів при виникненні рецидиву після радикальної хірургії РСМ найменший, порівняно з аналогічною ситуацією після нефректомії або радикальної простатектомії. Прагнення позбавити пацієнта від раку і зберегти колишню якість життя змушує продовжувати пошуки у хірургічному і консервативному лікуванні РСМ.
Профілактика раку сечового міхура
Профілактика РСМ полягає у проведенні заходів спрямованних на усунення професійних шкідливостей хімічного виробництва: у першу чергу виключається безпосередній контакт працівників з хімікатами, крі того суворі вимоги ставляться до проведення їх диспансеризації. Радикальному лікуванню методом електрокоагуляції або хірургічного видалення підлягають усі доброякісні папіломи сечового міхура. Нагальню потребою є своєчасне лікування запальних захворювань.
Проведені останнім часом дослідження виявили безпосередній зв'язок РСМ з палінням, тому відмова від паління є необхідним профілактичним заходом для попередження різних онкологічних захворювань, у тому числі і пухлин сечового міхура.
Список літератури:
1.Аль Шукри С.Х., Ткачук В.Н. Опухоли мочевого пузыря в пожилом и старческом возрасте. – СПб: Узд-во СПбГМУ, 1999. – 176 с.
2.Аль Шукри С.Х., Ткачук В.Н. Опухоли мочеполовых органов.– СПб:
Питер, 2000. – 320 с.
3.Клейн Е.А. Переходноклеточная карцинома мочевого пузыря // Секреты урологии / Под ред. Резник М., Новик Е. Пер. с англ.– М.: Бином, 1997.– С.106 115.
4.Левковский Н. С. Трансуретральная резекция предстательной железы
имочевого пузыря. – СПб: Вита Нова, 2002.–208 с.
5.Матвеев Б.П. Рак мочевого пузыря // Клиническая онкоурология / Под ред. Б.П.Матвеева.– М.: Вердана, 2003. – 406с.
6.Матвеев Б. П., Фигурин К. М., Карякин О.Б. Рак мочевого пузыря. –
М.: Вердана, 2001.– 243 с.
7.Переверзев А.С., Петров С.Б. Опухоли мочевого пузыря. – Харьков:
Факт, 2002. – 301с.
8.Фигурин К.М. Рак мочевого пузыря // Соврем. онкол. – 2003. – Т.5,
№2. – С.59 -61.
9.Шипилов В.И. Рак мочевого пузыpя. – М.: Медицина, 1983. – 192 с.
РАК ШИЙКИ МАТКИ
Вступ
Рак шийки матки (РШМ), який протягом майже сторіччя вважали одним з найпоширеніших видів патології серед злоякісних новоутворень жіночої репродуктивної системи, за останні два десятиріччя ХХ століття привернув до себе особливо пильну увагу. Щороку у світі виявляється понад 500000 хворих на РШМ. Крім того, підвищений інтерес до проблеми з боку спеціалістів обумовлений рядом обставин.
По-перше, за останні 10 років різко зріс (більш ніж на 38%) і продовжує зростати стандартизований показник частоти раку шийки матки серед населення не тільки промислово розвинутих, але і ряду країн, що розвиваються. Дедалі більше поширення РШМ вивело його в Європі і США на друге місце після раку молочної залози у структурі онкозахворювання жінок.
По-друге, у ряді країн спостерігається прогресуюче збільшення частоти захворювання на РШМ у молодому віці. В Росії приріст показників захворювання на РШМ у віковій групі хворих до 30 років склав 51,6%, у Скандинавських країнах – більш ніж 60%. Високу частоту захворюваності на РШМ більшість авторів пов’язують з поширенням серед молоді паління, різким збільшенням інфікування вірусом папіломи людини (ВПЛ), Chlamydia trachomatis, які передаються статевим шляхом. У зв’язку з цим було запропоновано віднести цервікальний рак до сексуально індукованих хвороб.
По-третє, РШМ належить до тієї онкопатології, успіхи радикального лікування якої за останнє десятиріччя найбільш очевидні і вражаючі. Особливо це положення стосується результатів лікування захворювання на ранніх стадіях.
Епідеміологія раку шийки матки
На протязі багатьох десятиліть було прийнято вважати, що РШМ проявляється лише у віці 50-60 років і старше. Усі фундаментальні роботи, присвячені проблемі діагностики і лікування раку шийки матки, ґрунтуються на вивченні захворюваності хворих середнього і похилого віку. Відповідні дослідження у молодих жінок базувались, в основному, на невеликій кількості спостережень.
Захворюваність на РШМ в цілому знижується, однак, чітко простежується зростання захворюваності на РШМ серед молодих жінок до 40 років і, особливо, у віковій групі до 29 років. Найбільш значущими факторами ризику є: ранній початок статевого життя, велика кількість сексуальних партнерів, ранні перші пологи і вагітність, чоловічий фактор (вплив смегми і сперми), паління, низький соціально-економічний рівень життя, низька статева гігієна. Дискутується питання про вплив оральних контрацептивів і деяких інфекційних захворювань, які передаються статевим шляхом.
Етіологія раку шийки матки
Вірусам папіломи людини (ВПЛ) відводять головну роль в індукції пухлинного росту. Найбільшу потенціальну онкогенну небезпечність мають типи 16, 18, 33, 45, 56, 58; менший ступінь онкогенності притаманний типам 31, 35, 51, 52, а до так званої «групи низького ризику» входять ВПЛ-6, 11, 42, 43, 44. Причому відзначено, що тип 16 найчастіше виявляється при плоскоклітинному раку, а тип 18 – у тканині залозистого.
Роль вірусного канцерогенезу у виникненні РШМ практично повністю доведена:
•доведена асоціація вірусу папіломи людини і злоякісної пухлини;
•установлені фактори ризику і шляхи передачі інфекції;
•ідентифіковані трансформуючі вірусні гени і механізми їх канцерогенного впливу;
•ідентифіковані клітинні гени, інгібування яких призводить до
розвитку канцерогенезу.
Систематичне цитологічне і кольпоскопічне обстеження більше 2 тисяч сексуально активних підлітків Франції у віці до 20 років дозволило виявити різні типи патологічних процесів зовнішніх та внутрішніх статевих органів, такі як неспецифічне проліферативне запалення (11%), вірусні прояви типу кондилом або герпесу (59%), виражені диспластичні змінення різного ступеня тяжкості (11%). Усі ці змінення можуть служити морфологічною основою для розвитку в подальшому у цих підлітків раку шийки матки.
У Федеративній Республіці Німеччині, відповідно до закону про ранню схему виявлення злоякісних пухлин, було здійснено експертну оцінку 96483 мазків з шийки матки молодих жінок (у віці до 30 років). Преканкрозні змінення виявлені у 28,7%. Інвазивний сквамозний рак виявлений у 12 молодих пацієнток або 9,7% відносно загальної кількості таких випадків. Відзначено збільшення кількості хворих на рак шийки матки протягом 5 років практично в 2,5 рази.
Останнім часом у Великобританії та країнах Європи активно використовується імунопрофілактика РШМ у вигляді HPV – вакцини, рекомендованої усім жінкам до початку статевого життя. Можливо, у зв’язку з цим найближчим десятиріччям структура захворюваності на РШМ може докорінно змінитися.
Передпухлинні стани
Морфологічно до передраку відносять осередки атипового розростання незрілого епітелію незапального характеру, що виникають часто мультицентрично і не виходять за межі базальної мембрани. У шийці матки передраком є дисплазія, особливо її тяжка форма.
На II Міжнародному конгресі з питань патології шийки матки і кольпоскопії (1975 г.) для позначення поняття дисплазії прийнято термін «цервікальна інтраепітеліальна неоплазія (CIN)».
Розрізняють три ступені CIN: легкий, помірний і тяжкий. 57% CIN I спонтанно регресують, 32% зберігаються у вигляді CIN I протягом тривалого часу, 11% прогресують у CIN II - CIN III і тільки 0,5% - в інвазивну карциному. На відміну від дисплазії слабкого ступеня, CIN III перетворюється в інвазивний рак у 12% випадків протягом 2-х років, а регресують досить рідко.
Наступною за ступенем тяжкості клітинних і тканинних змінень є карцинома in situ (передінвазивний рак), яка потребує негайного хірургічного лікування, тому що практично завжди переходить в інвазивний рак.
Преінвазивна форма раку (стадії 1 - IA1) є проміжною ланкою у розвитку наступного етапу – мікроінвазивного раку шийки матки (МРШМ). Виділення мікроінвазивного варіанта є визначенням етапу переходу пухлинного процесу з локального стану у стан початкової генералізації (регіонарне метастазування). Ранньою формою інвазивного РШМ є мікроінвазивний рак. Першими морфологічними ознаками мікроінвазії пухлини у строму шийки матки служить мікроскопічне виявлення патологічних виступів на межі епітелію і строми. При прогресуванні хвороби ці змінення визначаються вже у стромі. Надзвичайно важливими критеріями, які дозволяють стадіювати мікроінвазивний РШМ, є глибина і поширення мікроінвазії. Діагноз МРШМ установлюється на основі гістологічного дослідження. Адекватним мінімальним хірургічним втручанням, яке дозволяє діагностувати мікроінвазію пухлини в строму шийки матки, є конізація шийки матки. Сьогодні цілком точно можна вказати на два критерії, рекомендовані Всесвітньою асоціацією гінекологів онкологів, за якими будується гістологічна концепція МРШМ:
-стромальна інвазія на глибину до 3 мм (при об’ємі пухлини не більше
100 мм3)
-відсутність комплексу пухлинних клітин у лімфатичних судинах шийки матки (LVI -).
Анатомічні особливості шийки матки
Артеріальною кров’ю шийка матки постачається двома матковими артеріями, які беруть початок від внутрішньої клубової артерії, венозний відтік здійснюється по маткових венах, які впадають у внутрішню клубову вену. Лімфатичні судини шийки утворюють двошарову мережу, розташовуючись під прямим кутом до шийки матки. Лімфатичні вузли, в яких перериваються лімфатичні колектори шийки, відрізняються сталістю анатомічного розташування відносно до судин таза.
Розрізняють такі групи лімфатичних вузлів, через які здійснюється лімфовідтік від шийки матки:
-підчеревні;
-крижові;
-клубові (зовнішні, нижні і загальні);
-аортальні.
Кожен лімфатичний вузол цих груп пов’язаний приносними і виносними судинами з рештою лімфатичних вузлів, що надзвичайно важливо для визначення об’єму лімфаденектомії під час хірургічного втручання.
Метастазування раку шийки матки
РШМ метастазує лімфогенним і гематогенним шляхом – поява метастазів є прогностично несприятливим фактором. Умовно прийнято розрізняти декілька етапів лімфогенного метастазування:
1етап – зовнішні і внутрішні клубові, затульні лімфовузли;
2етап – загальні клубові лімфовузли;
3етап – поперекові лімфовузли;
4етап – лімфовузли середостіння і надключичних зон.
При метастатичному ураженні тазових лімфовузлів можливий розвиток ретроградних метастазів у пахових лімфовузлах.
Частота лімфогенного метастазування корелює з глибиною інвазії пухлини:
-при глибині інвазії менше 1 мм розвиток метастазів у регіонарні лімфовузли не відбувається;
-при глибині інвазії до 3 мм частота регіонарних метастазів не перевищує 1%;
-приглибиніінвазії3–5 ммчастотарегіонарнихметастазівдосягає5-8%;
-при 1В стадії частота регіонарних метастазів складає 15-18%;
-при ІІ стадії частота регіонарних метастазів складає 20-30%;
-при ІІІ стадії частота регіонарних метастазів досягає 50-60%.
Гематогенні метастази виникають при місцево-інфільтративному поширенні пухлини внаслідок розвитку лімфогенного метастазування. Гематогенні метастази найчастіше викликають ураження легень, печінки і кісток.
Морфогенез і гістогенез раку шийки матки
Морфологічні форми РШМ розрізняються відповідно до їх гістогенезу за класифікацією ВООЗ від 1992р.
|
|
Таблиця 12 |
|
|
|
Плоскоклітинний рак: |
Аденокарцинома: |
|
- зроговілий; |
- муцинозна (ендоцервікальна, |
|
- незроговілий; |
- кишкова і персневидно- |
|
- бородавчастий; |
клітинна); |
|
- кондиломатозний; |
- ендометріоїдна; |
|
- перехідно-клітинний |
- світлоклітинна; |
|
|
|
- малігнізована аденома; |
Інші епітеліальні пухлини: |
- залозисто-папілярна; |
|
- |
аденоплоскоклітинна |
- серозна; |
|
|
- мезонефроїдна. |
-карцинома;
-світлоклітинний рак;
-аденоїдно-кістозний рак;
-аденоїдно-базальний рак;
-карциноїдоподібна пухлина;
-дрібноклітинний рак;
-недиференційований рак.
Лімфоепітеліальноподібний рак
Найбільш прогностично сприятливим є плоскоклітинний зроговілий рак (а), плоскоклітинний незроговілий і аденокарцинома (б) – характеризуються несприятливим прогнозом.
|
Стадіювання раку шийки матки |
Таблиця 13 |
|||
|
|
||||
TNM |
FIGO |
Описання |
|
|
|
категорії |
Стадії |
|
|
|
|
TX |
0 |
Недостатньо даних для оцінки первинної пу- |
|||
T0 |
I |
хлини |
|
|
|
T1 |
Первинна пухлина не визначається |
||||
T1a |
IA |
РШМ обмежений шийкою (поширення на тіло |
|||
матки не враховується) |
|
||||
|
|
Інвазивна |
пухлина |
діагностується тільки |
|
T1a1 |
IA1 |
мікроскопічно. Усі макроскопічно виявлені |
|||
ураження (навіть при поверхневій інвазії) по- |
|||||
|
IA2 |
значають як Tlb/IB |
|
|
|
T1a2 |
Стромальна інвазія до 3 мм у глибину і до 7 мм |
||||
|
|
в ширину |
|
|
|
|
|
Стромальна інвазія до 5 мм в глибину і до 7 мм |
|||
|
|
в ширину. Примітка: глибина інвазії від основи |
|||
|
|
поверхневого або залозистого епітелію повинна |
|||
|
|
бути не більше 5 мм. Глибину інвазії |
|||
|
|
позначають як поширення пухлини від |
|||
T1b |
IB |
епітеліально-стромального |
сполучення |
||
найбільш поверхневого епітеліального виросту |
|||||
|
|
до самої глибокої точки інвазії. Ураження |
|||
T1b1 |
IB1 |
судинних структур, венозних або лімфатичних |
|||
капілярів не впливає на класифікацію |
|||||
T1b2 |
IB2 |
Клінічно виявлений осередок ураження, |
|||
T2 |
II |
обмежений шийкою, або мікроскопічно |
|||
виявлене |
ураження |
більшого |
розміру, ніж |
||
|
|
Т1а2/1А2 |
|
|
|
T2a |
IIA |
Клінічно виявлений осередок ураження до 4 см |
|||
в найбільшому вимірі |
|
|
|||
|
|
Клінічно виявлений осередок ураження |
|||
|
|
Продовження таблиц |
|
|
|
|
|
T2b |
IIB |
більше 4 см в найбільшому вимірі |
|
T3 |
III |
Пухлина шийки матки з поширенням за межі |
|
|
|
матки, але без проростання стінки таза або |
|
T3a |
IIIA |
нижньої третини піхви |
|
Без інвазії параметрію |
|
||
|
|
|
|
T3b |
IIIB |
З інвазією параметрію |
|
|
|
РШМ з поширенням на стінку таза і/або |
|
T4 |
IVA |
ураженням нижньої третини піхви, і/або |
|
|
|
спричиненням гідронефрозу і |
|
|
|
нефункціонуючої нирки |
|
|
|
Пухлина викликає ураження нижньої третини |
|
|
|
піхви, але не поширюється на стінку таза |
|
M1 |
IVB |
Пухлина поширюється на стінку таза і/або |
|
|
|
призводить до гідронефрозу і нефункціонуючої |
|
|
|
нирки |
|
|
|
Пухлина поширюється на слизову оболонку |
|
|
|
сечового міхура або прямої кишки і/або вихо- |
|
|
|
дить за межі малого таза |
|
|
|
Примітка: наявності бульозного набряку недос- |
|
|
|
татньо для класифікації пухлини як Т4 |
|
|
|
Віддалені метастази |
|
Клінічні прояви РШМ
Ранніми клінічними проявами РШМ можна вважати рясні водянисті білі, контактні кровомазання, ациклічні кров’янисті виділення у жінок репродуктивного віку.
Пізні клінічні прояви, пов’язані з поширенням пухлини на прилеглі органи, полягають у контактних кров’янистих виділеннях з піхви,
менорагії, альгодисменореї, болях у малому тазу, дизуричних розладах, порушеннях дефекації.
Основні методи діагностики
Стандартні методи обстеження: огляд у дзеркалах і бімануальне ректо-
вагінальне дослідження – не дозволяють виявити РШМ на початкових стадіях. Вирішальне значення в діагностиці РШМ мають інструментальні методи діагностики: кольпоскопія; цитологічні; гістологічні.
З метою визначення меж поширення пухлинного процесу і коректного стадіювання виконуються:
-ультразвукова ехографія внутрішніх геніталій та інших органів черевної порожнини, заочеревинних лімфатичних вузлів таза і поперекової зони, сечовивідних шляхів;
-рентгенологічні дослідження органів грудної клітки;
-цистоскопія;
-ректороманоскопія;
-у разі необхідності – комп’ютерна томографія, екскреторна урографія, радіоізотопне дослідження функції нирок, іригоскопія.
Методи лікування раку шийки матки
Приступаючи до лікування початкових форм РШМ, необхідно мати чіткий переконливий гістологічний діагноз. Поряд з цим, дуже важливо одержати максимально повну інформацію про гінекологічний і спадковий анамнез, знати плани пацієнтки щодо репродукції. Усе це в сукупності визначає основний принцип, за яким повинна формуватися програма лікування при початковому РШМ – оптимально-радикальне, але максимально функціонально зберігаюче лікування.
Хірургічне лікування раку шийки матки
16 листопада 1898 року Ernst Wertheim уперше виконав черезчеревну радикальну гістеректомію з приводу РШМ. Для декількох поколінь лікарів ця операція служила класичним клінічним, хірургічним і науковим еталоном.
На протязі понад 100 років хірургічний метод лікування РШМ є або основним (при ранніх стадіях), або використовується при запущених формах хвороби в комбінації з іншими методами, такими як променева і поліхіміотерапія.
Сьогодні при преінвазивному РШМ застосовуються:
-конусоподібна електроексцизія;
-ножова ампутація, кріодеструкція;
-лазерна деструкція, лазерна конусоподібна ексцизія;
-ультразвукова ампутація шийки матки.
При мікроінвазивному РШМ найбільш поширеним і надійним методом лікування є екстирпація матки без придатків у пацієнток репродуктивного періоду та екстирпація матки з придатками у пацієнток, яким більше 50 років. Поряд з цим, останніми роками стали розглядатись варіанти органозберігаючого лікування (видалення тільки шийки матки) у молодих пацієнток, які бажають зберегти генеративну функцію. Однак подібний підхід вимагає особливо ретельного і точного з’ясування розповсюдження меж захворювання, уважного вивчення операційного препарату по лінії розрізу і цілеспрямованих заходів щодо патогенетичної профілактики. Такі пацієнтки потребують суворого динамічного спостереження з обов’язковим цитологічним і кольпоскопічним контролем.
З 1970 року методом вибору хірургічного лікування РШМ є черезчеревна
радикальна гістеректомія у сполученні з тазовою лімфаденектомією.
Піхвовій екстирпації матки в її різних модифікаціях при лікуванні цервікального раку стали відводити обмежену роль. Однак завдяки простоті виконання, операція виявилась все ще корисною і сьогодні. Її здійснюють в пацієнток або дуже похилого віку, або в дуже молодих жінок з раннім інвазивним раком, з досить високим ризиком рецидування.
Основними звичайними і найбільш частими ускладненнями при виконанні радикальної екстирпації матки і лімфаденектомії вважаються пошкодження великих тазових судин і стінки сечового міхура, що тягнуть за собою сечову інфекцію (20,8%), дисфункцію міхура (9,2%) і сечовідні фістули (2,9%).
Зпоявою світловолоконної оптики і створенням лапароскопа, починаючи
з1989 року, зроблено спроби комбінувати піхвову радикальну екстирпацію
матки з лапароскопічною тазовою і парааортальною лімфаденектомією.
РШМ нерідко виникає у молодих жінок, які, звичайно хотіли б зберегти здатність до народження дитини. Для цього контингенту хворих з ранньою стадією інвазивного раку в 1995 році у Франції (м.Ліон) уперше була розроблена і виконана черезпіхвова радикальна екстирпація шийки матки (з видаленням параметральної клітковини) у поєднанні з лапароскопічною лімфаденектомією, яка дає можливість зберегти функцію матки.
Черезпіхвову резекцію (екстирпацію) шийки матки у пацієнток з цервікальним раком позначають як "операцію Schauta". Удосконалена модифікація – поєднання черезпіхвової екстирпації шийки матки з лапараскопічною лімфаденектомією і резекцією параметральної клітковини - у франкомовній літературі одержала назву – “операція Dargent”. На думку більшості авторів, така операція відносно проста (але, безумовно, вимагає певного онкогінекологічного навику) і забезпечує необхідний при інвазивному раку шийки матки радикалізм та збереження репродуктивної функції у молодих пацієнток.
В2001 році запропонована ще одна модифікація радикальної ампутації шийки матки. Автори пропонують застосовувати лапароскопічну лімфаденектомію попередньо або паралельно до черевної екстирпації шийки матки. Автори вважають, що така операція технічно здійсненна і дозволяє досвідченому онкогінекологу проводити більш широку параметральну резекцію, ніж при радикальній піхвовій ампутації шийки матки з меншою загрозою імовірних інтра- і післяопераційних ускладнень.
Онкогінекологічні критерії вилікування мікроінвазивного раку шийки матки (МРШМ) включають в себе такі принципи:
- ретельне вивчення післяопераційного препарату, особливо країв розрізу, виконання серійно-ступінчастих зрізів;
- обов’язкове дослідження стану лімфатичних судин видаленого органа; - тривале динамічне спостереження за пацієнткою (не менше 5 років) з
цитологічним контролем.
Комбінована терапія раку шийки матки
Променева терапія РШМ дозволяє досягти найкращих віддалених результатів, порівняно з іншими глибоко розташованими пухлинами, завдяки вдосконаленню технології лікування, можливості підведення високих доз до первинної пухлини, дистанційного опромінення параметральних інфільтратів, а також зон регіонарного метастазування, внаслідок високої чутливості тканини новоутворення до дії променевої енергії.
Дозою, здатною забезпечити тотальну загибель пухлинної паренхіми, є 60 Гр. Рубіж 60 Гр(за рахунок поєднення дистанційної і внутрішньопорожнинної гамма-терапії) визначається толерантністю оточуючих пухлину нормальних тканин - перевищення цього рівня тягне за собою розвиток тяжких променевих уражень.
Однак використання підвищених доз опромінення при проведенні променевої терапії РШМ IB - IIA стадій призводить до пошкодження тканин та органів малого таза, що, у свою чергу, лімітує подальше збільшення дози опромінення. У зв’язку з цим, з початку 70-х років інтенсивно вивчається можливість впровадження в клінічну практику хіміотерапії (ХТ) та її поєднення з променевою терапією і хірургічним лікуванням. Проведені дослідження показали, що цитостатики посилюють променеве пошкодження пухлинних клітин за рахунок порушення механізму репарації ДНК, синхронізації вступу пухлинних клітин у фази клітинного циклу, які найбільш чутливі до променевого впливу. Також відзначено, що цитостатики забезпечують зменшення кількості пухлинних клітин, які знаходяться у фазі спокою, і сприяють девіталізації резистентних до ПТ пухлинних клітин, що перебувають у стані гіпоксії.
Виявлено, що пухлина буває більш хіміочутливою перед ПТ або операцією. У зв’язку з цим зменшення об’єму пухлини за рахунок попередньої хіміотерапії (XT) може сприяти збільшенню ефективності ПТ або підвищенню можливості хірургічного видалення пухлини зі значним зниженням ризику інтраопераційної дисемінації пухлинними клітинами.
Сьогодні не існує одностайної думки стосовно того, який з режимів ХТ є стандартом у поєднанні з ПТ. Однак, враховуючи помірно виражену токсичність і значне зменшення ризику смерті хворих при застосуванні платиноутримуючих схем, при проведенні ХПЛ кращою є терапія з включенням препаратів платини. Проведення курсу попередньої ХТ дозволяє у ряді випадків згодом виконувати радикальні хірургічні втручання з видаленням потенційно резистентних метастатичних осередків, що, врештірешт, значно покращує безрецидивне виживання.
Схема лікування в подібних випадках виглядає таким чином: дистанційна ПТ на зону малого таза проводиться до сумарної осередкової дози 45 Гр, через 2 тижні – брахітерапія до сумарної дози на точку А – 85 Гр; одночасно проводиться ХТ цисплатином у дозі 75 мг/м2 і 5-фторурацилом 4 г/м2 (в/в), такий же цикл ХТ повторюється на 22-й день і далі одночасно з проведенням брахітерапії.
Перспективним видається застосування внутрішньоартеріальної хіміотерапії при місцево-розповсюджених формах РШМ. Проведені дослідження демонструють, що ефективність методу і вираження загально-
токсичних реакцій не поступаються таким при системному викори-станні цитостатиків.
Доцільність призначення хіміотерапії у післяопераційному періоді виправдана лише у разі виявлення метастазів у регіонарних лімфатичних вузлах з обов’язковим включенням препаратів платини. Однак потрибують уточнення питання про вибір дози цитостатика та оптимальну кількість циклів, які проводяться.
Хіміопроменева терапія при метастатичному і/або рецидивуючому РШМ
Даний контингент хворих складають пацієнтки з IV стадією, які мають віддалені метастази або рецидиви захворювання після раніше проведеного радикального лікування. Прогноз несприятливий, і тому для даної категорії хворих основним видом лікування є системна паліативна хіміотерапія або променевий метод. На сучасному етапі умовним стандартом при проведенні хіміотерапевтичного лікування залишаються схеми з препаратами платини. Основні труднощі хіміотерапії метастатичного РШМ можуть бути пов’язані як з генетичною, так і з цитокінетичною резистентністю пухлинних клітин. Крім того, внаслідок раніше проведеної променевої терапії виникає виражений фіброз м’яких тканин та облітерація судин малого таза, що порушує транспорт цитостатиків до пухлини і знижує їх ефективність. До того ж попереднє опромінення малого таза значно зменшує резерви кістковомозкового кровотворення, часто викликає порушення функції нирок, що в свою чергу підвищує токсичність хіміотерапії. З нових цитостатиків у лікуванні РШМ заслуговує на увагу іринотекан (кампто), капецитабін (кселода), таксани (таксол, таксотер), гемцитабін, навельбін. В даний час монохіміотерапія при розповсюдженому РШМ практично не застосовується.
Результати лікування РШМ
Узагальнюючи аналіз лікувальної допомоги хворим на РШМ, слід відзначити, що з позицій забезпечення якості і тривалості життя, єдиною своєчасно виявляючою стадією захворювання можна визнати тільки I, яка серед госпіталізованих хворих складає не більше 18%. Досить висока питома вага III і IV стадій дозволяє оцінити існуючу ситуацію як відносно несприятливу, котра вимагає зміщення акценту на виявлення пухлин у більш ранніх фазах.
Згідно з даними Американської асоціації акушерів-гінекологів, п’ятирічне виживаннядляінвазивнихформРШМтаке:
-мікрокарцинома– до95%;
-IA – IB до84%;
-IIA – 75%;
-IIB – IIIB невище45%;
-IV – менше14%.
Вирішальним фактором прогнозу в операбельних хворих на РШМ Iв-IIа стадій є метастатичне ураження регіонарних лімфатичних вузлів. 5-річне виживання знижується на 50% при ураженні лімфатичних вузлів таза і не
перевищує 25% при метастазах у поперекові лімфатичні вузли. При двосторонніх множинних метастазах ризик регіонарного рецидиву РШМ в 2 рази вищий, ніж у хворих з 1-3 метастазами, локалізованими в лімфатичних вузлах таза з одного боку.
При розмірах первинної пухлини менше 2 см 5-річне виживання складає 90%, від 2 до 4 см – тільки 40%.
У зв’язку з різноманітністю методів лікування РШМ, труднощами вибору найбільш оптимального варіанта з безлічі існуючих і складностями його здійснення хворі зазначеної категорії мають перебувати у спеціалізованих онкологічних стаціонарах, забезпечених необхідними діагностичними, радіотерапевтичними установками і належним арсеналом цитостатичних засобів.
Ускладнення при променевих методах лікування РШМ
Ускладнення при променевих методах лікування являють собою одну з актуальних проблем сучасної онкології. При лікуванні РШМ основним фактором, обмежуючим підведення до тканини пухлини запланованих осередкових доз, є небезпечність променевого пошкодження піхви, сечового міхура і слизової кишковика та розвиток променевих реакцій і пошкоджень. Використання сучасних методик як дистанційного, так і внутрішньопорожнинного опромінення при сукупченому променевому лікуванні раку шийки матки викликало змінення частоти, тяжкості і характеру променевих реакцій та ускладнень.
Місцеві променеві пошкодження при лікуванні РШМ у переважній більшості спостережень пов’язані з навмисним або цілеспрямованим застосуванням доз, що перевищують природу толерантність опромінюваних тканин. Факторами, які сприяють розвитку ранніх і пізніх променевих ускладнень, є підвищена індивідуальна чутливість прилягаючих до пухлини тканин, наявність хронічних і гострих запальних процесів в органах, гістогенез пухлини тощо.
Якість життя пацієнтів як одна з основних задач сучасних підходів у лікуванні РШМ
Сучасна медицина розглядає якість життя як кінцеву мету реалізації складного комплексу медичних, психологічних, духовних і соціальних програм допомоги хворому. За визначенням авторів, «якість життя – це інтегральна характеристика фізичного, психологічного, емоційного, духовного і соціального функціонування хворого, яка ґрунтується на його суб’єктивному сприйнятті».
З метою оцінки розповсюдження і серйозності психосексуальної дисфункції серед жінок після радикальної екстирпації матки за Вертгеймом з приводу РШМ проведено ретроспективне вивчення якості життя 105 пацієнток шляхом анкетного опитування та інтерв’ю у строки від 6 місяців до 5 років після операції. 90% жінок до операції були сексуально активні, з цієї групи у 15% сексуальне спілкування було перервано після оперативного втручання. Після променевої терапії відсутність статевого потягу була звичайною проблемою – 82% жінок у віці молодше 50 років страждали на статеву дисфункцію. Вважається, що статева дисфункція продовжує
залишатись хронічною проблемою у жінок після радикальної екстирпації матки з приводу РШМ. Таксамо як і органічні причини, дуже сильним є психогенний елемент, викликаний втратою гормональної і репродуктивної функції, що супроводжується депресією і стурбованністю подальшими відносинами зі статевим партнером.
Хворим з гінекологічними формами раку після проведення як комбінованого, так і променевого лікування рекомендується широко використовувати рівномірне розширення піхви як спосіб збереження її для доброго сексуального функціонування.
Проблеми якості життя та психологічної реабілітації хворих на рак шийки матки (РШМ) набули останнім часом помітного соціального значення
узв’язку з важливими тенденціями:
-по-перше, у зв’язку зі збільшенням загального числа хворих на РШМ, відзначеного за останнє десятиріччя у більшості країн світу, включаючи й Україну, де РШМ, котрий за частотою займає четверте місце, перемістився на друге;
-по-друге, через прогресуюче збільшення частоти захворюваності на рак шийки матки у жінок фертильного віку, особливо у вікових групах до 35 років;
-по-третє, на фоні успіхів комбінованого лікування й удосконалення методів променевої терапії цервікального раку, що дозволяють помітно покращити показники п’ятирічного виживання;
-по-четверте, у зв’язку з тим, що адекватно виконані хірургічні операції, які дозволяють зберегти функцію яєчників, не тільки позбавляють від страждань, але й покращують якість життя пацієнток.
Збільшення тривалості життя основної маси хворих на РШМ сьогодні ставить питання не тільки про те, скільки прожила пацієнтка, але і як вона їх прожила. У зв’язку з цим зростає роль організаційних заходів щодо реабілітації такого контингенту онкологічних хворих.
Важливо підкреслити, що на сьогоднішній день в Україні застосовувані методи лікування не завжди відповідають міжнародним вимогам, а методології визначення якості життя як одна з основних цілей лікування онкологічних хворих здебільшого бракує. Тому в роботі Донецького протипухлинного центру усі перераховані вище аспекти мають першочергове значення, а розроблені принципи лікування неухильно дотримуються усіма спеціалістами.
Литература.
1. Бохман Я.В. Руководство по онкогинекологии. – Ленинград:
Медицина. - 1989. – 351 с.
2. Вишневская Е.Е. Предопухолевые заболевания и злокачественные опухоли женских половых органов. - Мн.: Выш. Шк., 2002. - 416 с.
3.Атлас онкологических операций / Под ред. Б.Е. Петерсона, В.И. Чиссова, А.И. Пачеса - М.: Медицина, 1987. - 536 с.
4.Руководство по химиотерапии опухолевых заболеваний / Под редакцией Переводчиковой Н.И. - М, 2005. – 698 с.
5.Энциклопедия клинической онкологии: Руководство для практикующих врачей / М.И.Давыдов, Г.Л.Вышковский и др.; Под общ. ред. М.И.Давыдова, Г.Л.Вышковского. - М.: РЛС - 2005, 2004. – 1536 С.
РАК ТІЛА МАТКИ
Захворюваність на рак тіла матки
Рак ендометрію(РЕ) зустрічається значно рідше, ніж рак молочної залози. В Україні число захворілих на ці новоутворення в усіх вікових групах дорівнювало в 2000 р., відповідно, 12,5 і 38,2 на 100000 населення, а середньорічний приріст захворюваності за 1991–2000 рр. тримався на рівні 3,13% і 2,63%. У той же час, за матеріалами програми SEER, серед жіночого населення США ніякого приросту захворюваності на рак ендометрію за вказаний період часу не відбулось (24,5 в 1991 р. і 24,4 в 2000 р.). З іншого боку, число захворілих на рак молочної залози (насамперед, за рахунок жінок постменопаузального віку), за тими ж даними, продовжувало зростати. Подібні відмінності між захворюваністю населення двох країн і між захворюваністю на окремі новоутворення (яка у США в цьому випадку вірогідно вища, ніж в Україні) можуть пояснюватися як соціальноекономічними і етнічними факторами, так і певними відмінностями в природі самих цих пухлин і асоційованих з ними гормонально-метаболічних порушень.
У 2000 р. на частку раку тіла матки припадало 6,5% усіх випадків злоякісних новоутворень жіночого населення (для порівняння: рак молочної залози – 19,3%, рак шийки матки – 5,3%, рак яєчників – 5,0%). Захворюваність на РЕ у віковому інтервалі від 40 до 54 років робить різкий стрибок, збільшуючись приблизно в 4 рази, поступово досягаючи піку до 60– 64 років, після чого помітно знижується. Таким чином, захворюваність на РЕ і її динаміка в різних країнах вказують на безсумнівні специфічні особливості цього захворювання і залежність його виникнення від комплексу причин ендогенної та екзогенної природи.
Фактори ризику раку ендометрію
Основна роль в патогенезі РЕ відводиться надмірній естрогенній стимуляції ендометрію, яка поєднується з недостатністю прогестерону, і тому одержала назву «unopposed» (тобто, яка не потребує протидії). Як припускають, надмірний вплив естрогенів в умовах дефіциту прогестерону може призводити до гіперплазії ендометрію, яка, незважаючи на свою оборотність, здатна прогресувати в атиповий варіант, у 20–25% випадків схильний до перетворення в аденокарциному. У зв’язку з цим виділяють такі фактори ризику розвитку раку тіла матки:
1)Синдром Штейна-Левенталя, гормонопродукуючі пухлини яєчників;
2)Безпліддя, пов’язане з ановуляторними циклами, котре супроводжується відносною гіпоестрогенією;
3)Відсутність пологів;
4)Ожиріння і пов’язана з ним посилена екстрагонадна продукція естрогенів;
5)Пізня менопауза;
6) Неадекватна гормонозамісна терапія у жінок в менопаузі. Одним із серйозних доказів гормонозамісної терапії в патогенезі РЕ
служать дані про підвищення частоти виявлення цього захворювання у жінок постменопаузального віку, які протягом тривалого часу одержували замісну терапію (ЗГТ) естрогенутримуючими препаратами. Таке ускладнення проявляється, переважно, у жінок, які не палять, що може бути пов’язано і з «антиестрогенним» ефектом тютюнового диму та з його впливом на метаболізм естрогенів. Прийом тамоксифену при лікуванні раку молочної залози також чинить естрогеноподібну стимулюючу дію на ендометрій.
7)Наявність цукрового діабету;
8)Наявність в анамнезі гіперпластичних процесів ендометрію.
Передракові захворювання
До фонових для раку тіла матки процесів відносять залозисту гіперплазію та ендометріальні поліпи. Залозиста гіперплазія ендометрію
(ЗГЕ) часто визначається у хворих з ановуляторними матковими кровотечами. Клініцисти не бачать суттєвих відмінностей між залозистою і залозисто-кістозною гіперплазією ендометрію, тому що кістозне розширення залоз свідчить не про ступінь гіперпластичного процесу, а радше про атрофічні змінення ендометрію. Поліпи ендометрію розвиваються внаслідок проліферації залоз базального шару ендометрію. Неодмінна анатомічна властивість поліпа – наявність ніжки, яка складається з фіброзної і гладком’язової тканини. Ознака «органоїдності» відрізняє поліп від поліповидної форми ЗГЕ, яку іноді позначають як поліпоз ендометрію.
Атипова гіперплазія ендометрію (АГЕ) - це передракове захворювання тіла матки. Мікроскопічно АГЕ характеризується значною перевагою залозистих елементів над стромальними, чого не буває при ЗГЕ. Але при АГЕ цитогенна строма між атиповими залозами завжди зберігається, що відрізняє її від високодиференційованої аденокарциноми ендометрію. Дискусійним залишається питання про правомірність діагнозу «Са in situ» ендометрію, тому що з точки зору біологічної поведінки тяжка АГЕ еквівалентна сучасним уявленням про преінвазивний рак і гістологічно її важко відрізнити від високодиференційованої аденокарциноми ендометрію. За зведеними літературними даними, прогресія АГЕ в інвазивний рак відмічається у 20-50% спостережень (в середньому 40%) на протязі від одного року до 13 років, що визначає необхідність її виявлення і негайного лікування.
Морфологічна класифікація раку тіла матки
Міжнародна класифікація раку ендометрію, яка використо-вується в нинішній час, виділяє дві групи ендометріальних карци-ном: ендометріоїдні і неендометріоїдні (рідкісні).
Морфологічна класифікація ендометріальних карцином (ВООЗ, 1994).
1. Ендометріоїдні 1.1. Аденокарцинома 1.1.1. Секреторна
1.1.2. Циліарно-клітинна (війчасто-клітинна)
1.2. Аденокарцинома зі сквамозною диференціацією
1.2.1.Аденокарцинома зі сквамозною метаплазією (адено-акантома)
1.2.2.Аденосквамозна карцинома
2.Серозно-папілярний рак*
3.Світлоклітинна аденокарцинома*
4.Муцинозна аденокарцинома*
5.Плоскоклітинна карцинома*
6.Змішана карцинома*
7.Недиференційована карцинома*
*- рідкісні форми (серозно-папілярний, світлоклітинний, муцинозний, плоскоклітинний, змішаний і недиференційований рак).
Метастазування раку ендометрію
Переважаючим типом метастазування раку ендометрію є лімфогенний, зазвичай у сполученні з гематогенним або імплантаційним. Спочатку з’являються метастази в лімфатичних вузлах таза, потім у поперекових, рідше в пахових лімфатичних вузлах і у віддалених органах. Виділяють три етапи клінічного перебігу раку ендометрію.
Перший етап клінічного перебігу раку тіла матки охоплює період від виникнення інвазивного раку до моменту його глибокого проростання в міометрій. Цей етап характеризується розвитком самої первинної пухлини, що відбувається у напрямку її поступового дедиференціювання. Виявлення високодиференці-йованого залозистого раку є відображенням повільних темпів прогресії пухлини. І навпаки, зниження диференціювання пухлини свідчить про швидкі темпи її росту і зростання автономності.
Другий етап клінічного перебігу раку тіла матки характеризується місцево-регіонарним розповсюдженням. Він починається з глибокого проростання пухлини в міометрій, після чого темпи її росту можуть прискорюватись. Це зумовлено руйнуванням м’язового і субсерозного лімфатичних сплетінь, котре призводить до значного збільшення частоти утворення метастазів у лімфатичних вузлах таза. Основними шляхами метастазування є клубові і парааортальні лімфовузли. Ураження клубових лімфатичних вузлів спостерігається при раку, який локалізується в нижньому сегменті матки і цервікальному каналі. При 1-ій стадії метастази виявляються в 10% випадків, при 2-ій стадії – в 35%.
Дисемінація процесу характеризує третій етап клінічного перебігу раку тіла матки, який вимірюється проміжком часу від проростання пухлини за серозну оболонку матки і утворення регіонарних метастазів до широкої лімфогематогенної та імплантаційної дисемінації. При проростанні серозної оболонки матки або ураженні яєчників можливий «оваріальний» тип метастазування – метастази по парієтальній очеревині, у великому сальнику, асцит.
Класифікація раку тіла матки за системою ТNМ
ТNМ – клінічна класифікація
Т– первинна пухлина
ТX |
– |
недостатньо даних для оцінки первинної пухлини |
ТО |
– |
первинна пухлина не визначається |
Тis О – |
саrcinoma in situ (преінвазивна карцинома) |
|
Т1 |
– |
пухлина обмежена тілом матки |
Т1а – |
пухлина обмежена ендометрієм |
|
Т1в – |
пухлина уражає не більше половини товщини міометрію |
|
Т1с – |
пухлина викликає ураження більше половини товщини |
|
міометрію |
||
Т2 |
– |
пухлина поширюється на шийку матки, але не за межі матки |
Т2а – |
захоплює тільки ендоцервікальні залози |
|
Т2в – |
цервікальна стромальна інвазія |
|
ТЗ |
– |
локальне і (або) регіонарне поширення |
ТЗа – |
пухлина проростає в серозний шар і (або) в придатки (пряме |
|
розповсюдження або метастаз) і (або) ракові клітини в асцитичній рідині або перитонеальних змивах
ТЗв – поширення на піхву (пряме розповсюдження або метастаз) Т3сN1 – метастази в тазові і (або) парааортальні лімфатичні вузли
Т4 – пухлина проростає у слизовий шар сечового міхура і (або) товстої кишки
П р и м і т к а: бульозного набряку недостатньо, щоб класифікувати пухлину як Т4
М1 – віддалені метастази (за винятком метастазів у піхві, серозній оболонці таза або в придатках, але включно з метастазами і в інших, крім парааортальних, внутрішньоочеревинних лімфатичних вузлах)
Класифікація раку тіла матки за стадіями (FIGO, 1992)
1 стадія – рак обмежений тілом матки; 1А стадія – пухлина не виходить за межі ендометрію;
1В стадія – пухлина проростає не більш ніж половину товщі міометрію; 1С стадія – пухлина проростає міометрій на глибину більше його
половини; 2 стадія – пухлина проростає в шийку матки, але не поширюється за межі
матки; 2А стадія – ураження тільки залозистого шару шийки матки;
2В стадія - ураження строми шийки матки; 3 стадія – рак поширюється за межі матки, але не за межі малого таза,
відзначається місцеве і/або регіонарне розповсюдження; 3А стадія – пухлина поширюється на серозну оболонку і/або придатки
матки, і/або наявність ракових клітин в асцитичній рідині або змиві з черевної порожнини;
3В стадія – пухлина проростає піхву; 3С стадія – метастази в тазових і/або парааортальних лімфовузлах;
4 стадія – пухлина поширюється за межі малого таза і/або проростає слизову оболонку сечового міхура і прямої кишки;
4А стадія – проростання в сечовий міхур і/або в пряму кишку; 4В стадія – віддалені метастази.
Клінічні прояви раку тіла матки
Основний симптом раку тіла матки – маткові кровотечі, які відзначаються в 95-98% випадків. Поява метрорагії у жінок в менопаузі є грізним симптомом, яке змушує запідозрити рак тіла матки. Одноразове нерясне кровомазання (окрім раку ендометрію) може бути симптомом ендометріального поліпа, або атрофічного ендометриту. У той же час, постійні рясні метрорагії є прямим указанням на злоякісну пухлину матки.
Поява кровомазання у жінок в менопаузі є абсолютним показанням до фракційного діагностичного зскоблення порожнини матки і цервікального каналу (або біопсії ендометрію під контролем гістероскопії). В даній ситуації консервативне лікування або тактика очікування є глибоко помилковими і утруднюють подальше лікування хворої.
У міру росту пухлини матки та її вторинного інфікування кров’янисті виділення з матки стають більш рясними і набувають смердючого запаху. Для раку ендометрію також характерні, але менш постійні, лейкорея і болі. Останні відмічаються при стенозі шийкового каналу внаслідок накопичення виділень в порожнині матки. В задавнених випадках больовий синдром зумовлений стисненням і запаленням замикального або сідничного нервів лімфогенними метастазами або інфільтратами.
Методи діагностики раку тіла матки
В діагностиці РТМ застосовуються неінвазивні та інвазивні методи. При ознайомленні з анамнестичними даними хворих на рак ендометрію слід уточнити стан менструальної функції (початок першої менструації, тривалість репродуктивого періоду, наявність ациклічних маткових кровотеч, особливості перебігу клімаксу та час настання менопаузи) і генеративної функції. Велике значення має виявлення обмінних порушень, ожиріння і цукрового діабету.
Обстеження хворих на рак ендометрію починається з бімануального ректовагінального дослідження. При цьому ректальне дослідження є обов’язковим, оскільки дозволяє визначити через еластичну стінку прямої кишки стан параметріїв і дугласового простору, що є принциповим моментом для визначення стадії пухлинного процесу та операбельності самої пухлини.
Серед інструментальних методів дослідження, у зв’язку з високою інформативністю і простотою, на першому етапі застосовується цитологічне дослідження аспірату ендометрію. Чутливість цитологічного методу виявлення раку ендометрію 92,1%, специфічність 99%. При підозрінні і наявності атипової гіперплазії ендометрію або раку ендометрію наступним
діагностичним прийомом стає гістероцервікографія або гістероскопія для уточнення особливостей пухлинного росту – локалізації і протяжності ураження. При відсутності можливості виконання гістероскопії виконують роздільне діагностичне зіскоблення слизової оболонки матки і цервікального каналу. Однак, слід відзначити, що при використанні цього доступного і, в той же час «сліпого», методу, приблизно в 10% випадків морфологічне заключення може бути помилковим, у 3% випадків біопсійний матеріал не інформативний.
Важливу роль у діагностиці РТМ відіграє ультразвукове дослідження (сонографія), незважаючи на те, що її інформативність при первинній діагностиці РТМ не перевищує 66,3%. Слід зазначити, що інформативність сонографії у пацієнток постменопаузального періоду значно вища (86,0%), ніж у групі хворих перименопаузального періоду (57,9%). Основна частка помилкових висновків при атипових кровотечах у перименопаузі припадає на гіперпластичні процеси, атрофію ендометрію та аденоміоз. Виходячи з вищесказаного, сонографію не слід вважати досить інформативною при установленні причин атипових маткових кровотеч, у подібних випадках основне значення приділяється морфологічній верифікації патологічного процесу.
Використання сонографії на початкових етапах діагностики дозволяє виключити оглядову гістероскопію, наприклад, при переконливих ультразвукових ознаках раку або атрофії ендометрію. У першому випадку обстеження доповнюється аспіраційною біопсією, у другому – виконується за показаннями лікування і спостереження. З цієї точки зору, більш ефективною є оглядова гістероскопія з прицільною аспіраційною біопсією ендометрію.
Профілактика раку тіла матки
В практичному значенні профілактичні заходи при РТМ менш поширені, ніж при раку молочної залози, причини чого (з урахуванням обсягу накопичених знань) не зовсім зрозумілі. З профілактичною метою вважається виправданим лікування безпліддя і синдрому полікістозних яєчників, зниження зайвої маси тіла та усунення порушень вуглеводного обміну/інсулінорези-стентності (зокрема, за допомогою антидіабетичних бігуанідів, глітазонів і статинів), використання пероральних стероїдних контрацептивів, спостереження за жінками, які користуються замісною гормонотерапією (ЗГТ) в менопаузі, і за хворими на рак молочної залози, які довгий час приймають тамоксифен. Поки що не досягнуто повного консенсусу у питанні про прогестиновий компонент ЗГТ (тривалість і характер прийому, метод уведення, доза), раціональним може виявитися пошук «селективних» прогестинів, які не чинять несприятливого впливу на молочну залозу. Потребує обговорення питання доцільністі застосування з профілактичною метою інгібіторів ароматази, деяких препаратів групи SERM, які не справляють стимулюючого впливу на ендометрій, і
нестероїдних протизапальних засобів, частина з яких, з-поміж іншого, здатна пригнічувати й активність ароматази.
У плані формування груп ризику, поряд з орієнтацією на певні ендокринні стигмати, можуть представити інтерес деякі варіанти генотипування. Необхідно також мати на увазі, що при однаковому надлишку маси тіла ризик виникнення раку ендометрію нижчий у тих жінок, які ведуть рухомий спосіб життя і слідкують за підтриманням певного рівня фізичної активності. Таким чином, існує досить великий набір підходів до попередження раку ендометрію, що базується на сучасних уявленнях про фактори ризику і патогенез захворювання, але на практиці, на жаль, реалізується рідко і, як правило, безсистемно.
Скринінг раку раку тіла матки
Скринінг раку раку тіла матки включає в себе три складових моменти:
–*соціально-культурний або етнічний аспект;
–**медичний аспект;
–***економічний аспект.
Врамках охорони здоров’я вирішуються задачі методології та організації скринінгу. У проблемі раку ендометрію методологічною базою скринінгу є сонографія, ультразвукові критерії скринінгу при патологічних процесах ендометрію мають ряд обмежень і спираються на такі принципи:
1 – в репродуктивному і перименопаузальному періодах УЗД повинне виконуватись в ранній I фазі менструального циклу;
2 – при цьому серединні маткові структури (М-ехо) «нормального» ендометрію не повинні перевищувати 6 мм;
3 – в постменопаузі основна ультразвукова ознака атрофії відповідає товщині серединних маткових структур, які не перевищують 4 мм.
Узагальнені дані літератури свідчать про те, що більшість дослідників за пороговий діагностичний критерій гіперпластичних процесів ендометрію в постменопаузальному періоді обирають товщину М-ехо 4 або 5 мм.
Найбільш доцільно диференціювати 3 категорії рішень з урахуванням даних товщини М-ехо.
При першому варіанті (М-ехо до 4 мм) можна обмежитись динамічним (не більше 1 разу у 2–3 роки) ультразвуковим спостереженням. При другому варіанті (М-ехо до 12 мм) необхідна гістероскопія, візуальна оцінка характеру змінень у порожнині матки з подальшою прицільною аспіраційною біопсією ендометрію. При третьому варіанті (М-ехо більше 12 мм) різко зростає імовірність злоякісного процесу у порожнині матки, що робить доцільним обмеження аспіраційною біопсією ендометрію. Слід сказати, що в такому важливому питанні, як чітке диференціювання характеру патологічного процесу в порожнині матки, необхідно орієнтуватися лише на прицільну, адекватну біопсію з гістологічним заключенням.
Прогностичні фактори при раку ендометрію
Найбільш значущими факторами, які визначають прогноз захворювання при раку ендометрію, є: поширення пухлинного процесу (стадія захворювання) і ступінь диференціювання пухлини. Помічено, що найбільш сприятливий прогноз відзначається у хворих з високодиференційованою аденокарциномою ендометрію з міні-мальною інвазією в міометрій. У міру зниження диференціювання пухлини, збільшення глибини її інвазії, поширення на серозний покрив матки, придатки, метастазування в регіонарні лімфатичні вузли прогноз значно погіршується.
Хірургічна анатомія матки
Матка розташовується в малому тазу між сечовим міхуром і прямою кишкою. Вона складається з двох відділів: верхнього – тіла матки і її дна та нижнього – шийки матки. З боків від матки листки очеревини утворюють широкі зв’язки матки, розташовані у фронтальній площині. У вільному краю широких зв’язок матки закладені придатки матки, маткові труби. До заднього листка широкої зв’язки матки за допомогою брижів фіксований яєчник. Кровопостачання матки здійснюється двома матковими артеріями (aa. uterinae), яєчниковими артеріями (aa. ovaricae) та артеріями круглої зв’язки матки. В оперативній гінекології найбільший інтерес представляють топографоанатомічні взаємовідношення маткових судин і сечоводів, оскільки при мобілізації цих анатомічних утворень трапляється найбільша кількість ятрогенних ускладнень. Початок маткової артерії (яка є гілкою внутрішньої клубової артерії) прикритий зверху сечоводом. На відстані 4-5 см вниз від місця відходження маткова артерія проникає в основну зв’язку матки, яка лежить біля основи широкої зв’язки, і, не доходячи 2 см до шийки матки, перетенає сечовід зверху. Біля бокового краю матки артерія віддає піхвову гілку і піднімається вверх по ребру матки.
Хірургічне лікування раку тіла матки
Хірургічний метод є основою лікування хворих на РТМ.
Хірургічні втручання виконуються як на ранніх, так і на пізніх стадіях захворювання. Саме високою частотою РТМ I–II стадій пояснюється те, що хірургічне лікування проводиться переважній більшості хворих з цією злоякісною пухлиною. У міру вдосконалення хірургічної техніки, анестезії, передопераційної підготовки і післяопераційного ведення стає все менше хворих на РТМ, яким операція протипоказана через супутні захворювання. Серед хворих на РТМ ранніх стадій не підлягають операції через тяжкі супутні захворювання лише 13%. Обов’язковим є ретельне передопераційне обстеження хворої. Воно має включати фізикальне дослідження (пальпацію живота, лімфатичних вузлів, гінекологічне дослідження), загальний аналіз крові і сечі, біохімічне дослідження крові, коагулограму, ЕКГ, рентгенографію грудної клітки, УЗД малого таза, черевної порожнини і
заочеревинного простору. Визначення рівня CA-125 у сироватці дозволяє припускати про поширення пухлини. За показаннями проводять КТ, МРТ, екскреторну урографію, цистоскопію, ректороманоскопію, іригоскопію. У невеликої частини хворих на РТМ при обстеженні виявляється дисемінація пухлини, яка перешкоджає операції. Це масивний перехід пухлини на шийку матки, інфільтрати в параметріях, вростання у сечовий міхур або пряму кишку, віддалені метастази. Враховуючи те, що РТМ зазвичай спостерігається у похилих жінок, необхідне всебічне обстеження, спрямоване на виявлення супутніх захворювань, і ретельна підготовка до хірургічного лікування.
Першим етапом лікування більшості хворих на РТМ I і II стадії пухлинного процесу є екстрафасціальна екстирпація матки з придатками.
Хірургічний доступ дозволяє провести повноцінну ревізію малого таза й черевної порожнини і при необхідності виконати лімфаденектомію. Найчастіше виконують нижню серединну лапаротомію з обходом пупка зліва. Але можливі і поперечні доступи з перетином прямих м’яз живота (доступ за Мейлердом) або з їх відсіченням від лобкових кісток (доступ за Черні).
Після розтину черевної порожнини виконують змиви з очеревини піддіафрагмальної зони, бокових каналів і малого таза. Для змиву з кожної зони беруть 50 мл ізотонічного розчину NaCl. Щоб одержати змиви з піддіафрагмальних просторів, до шприца можна під’єднати гумовий катетер.
Далі проводять ревізію черевної порожнини і малого таза, оглядають серозну оболонку матки, ретельно оглядають і пальпують діафрагму, печінку, великий сальник, тазові і поперекові лімфатичні вузли.
Після ревізії приступають до мобілізації матки. Пересікають міхурноматкову складку і сечовий міхур відшаровують вниз до переднього склепіння піхви. Потім з обох боків розсікають задній листок широкої зв’язки, контролюючи хід сечоводу. Матку підтягують наверх, по її ребрах чітко проступають маткові судини, на які на рівні внутрішнього зіву точно перпендикулярно до шийки матки накладаються затискачі Мікулича. Судини пересікають і перев’язують. Потім паралельно до шийки матки на шийкову гілку маткової артерії накладають затискач Кохера, пересікають і перев’язують. Також паралельно до матки накладають затискачі на паравагінальні гілки, які пересікають і перев’язують. Піхвова трубка пересікається на рівні її верхньої третини. Стінки піхви ушиваються, відновлюється цілісність тазової очеревини.
Видалення придатків матки обов’язкове, оскільки в них нерідко виявляються метастази. Крім того, у хворих на РТМ підвищений ризик синхронного і метахронного раку яєчників. Останнім часом з’являються роботи, присвячені органозберігаючому лікуванню хворих на РТМ. Рідкісність РТМ у жінок дітородного віку не дозволяє поки що дати загальних рекомендацій з впровадження в клінічну практику абляції ендометрію і гормонотерапії як самостійних методів лікування РТМ ранніх стадій. Необхідні подальші клінічні дослідження, які дозволять оцінити ефективність цих методик і віддалені результати лікування. Що стосується
збереження яєчників у жінок дітородного віку, які не планують мати дітей, то такий підхід вважається недоцільним, оскільки, з одного боку, це робить неадекватним визначення морфологічної стадії і може призвести до серйозних помилок у плануванні лікування, а з іншого – існує альтернатива збереженню яєчників у хворих на РТМ – замісна гормональна терапія. РТМ довгий час вважали протипоказанням до замісної гормональної терапії, вважаючи, що естрогени можуть стимулювати ріст мікрометастазів. Між тим, клінічні дані про те, що замісна гормональна терапія підвищує ризик прогресування РТМ у вилікуваних хворих відсутні. Більш того, результати проведених досліджень переконливо довели, що застосування естрогенів у хворих, вилікуваних від РТМ, не підвищують ризик прогресування пухлини. Проводити замісну гормональну терапію бажано, оскільки багато хворих страждають від наслідків оваріектомії: вазомоторних порушень, атрофічного вагініту, остеопорозу та ішемічної хвороби серця.
Комбіноване лікування раку тіла матки
Комбіноване лікування включає, як правило, хірургічний і променевий компоненти, які здійснюються в одному з двох різних варіантів: 1) хірургічне втручання + післяопераційне опромінення; 2) передопераційне опромінення + наступна радикальна операція + післяопераційне опромінення.
Найбільш визнаним варіантом комбінованого лікування раку ендометрію є метод з післяопераційним опроміненням.
Післяопераційне опромінення спрямоване на закріплення ефекту, досягнутого завдяки операції, і попередження можливого розвитку місцевих рецидивів пухлини. Питання про післяопераційне опромінення вирішується індивідуально, з урахуванням даних гістологічного дослідження операційного препарату. При високодиференційованій аденокарциномі, відсутності глибокого проростання пухлини в міометрій і виключенні метастазів у віддалених лімфатичних вузлах післяопераційне опромінення не показано. Воно необхідне при локалізації пухлини в нижніх відділах матки та ендоцервіксі, низькодиференційованій структурі, глибокій інвазії пухлини в міометрій і наявності метастазів у лімфатичних вузлах малого таза. Дистанційне опромінення проводять з таким розрахунком, щоб за курс лікування на рівні залягання кукси піхви і параметральних відділів таза була створена доза порядку 40 Гр. Опромінення проводиться дрібними фракціями, разова осередкова доза складає 2-2,5 Гр. Променеві пошкодження прямої кишки і сечового міхура є найчастішими ускладненнями променевої терапії і визначають якість життя вилікуваних від пухлини хворих. Профілактика променевих ускладнень прямої кишки і сечового міхура передбачає раціональне дотримання сумарних поглинених доз, дотримання дозних обмежень, які грунтуються на даних радіочутливості органів і тканин. Важливим елементом профілактики променевих ускладнень є санація сечового міхура (уросептики, сечогінні) і прямої кишки (регуляція функції кишковика, лікувальні мікроклізми) до початку лікування.
Хіміотерапія раку тіла матки
У хворих з дисемінованим раком ендометрію з метастазами в легенях і кістках, а також при виникненні рецидивів і метастазів пухлини лікування доповнюють хіміотерапією у вигляді моноабо поліхіміотерапії. Найчастіше при раку ендометрію використо-вуються такі препарати як: цисплатин, адріаміцин, фторурацил. Застосування хіміотерапії дозволяє домогтися ремісії у 30-40% хворих на рак тіла матки з запущеними формами.
Променева терапія раку тіла матки
Променева терапія, як самостійний метод лікування при раку ендометрію, використовується в таких клінічних ситуаціях:
–місцево-поширені форми раку: перехід пухлини на шийку матки, піхву, параметральну клітковину;
–локалізований рак ендометрію на фоні суб- і декомпенсованої соматичної патології, який є абсолютним протипоказанням для хірургічного лікування;
–рак ендометрію з факторами несприятливого прогнозу (низькодиференційовані пухлини з великою внутріорганною протяжністю);
–резектабельні форми пухлини з морфологічно підтвердженою глибокою інвазією міометрію або з поширенням на придатки, що суттєво погіршує прогноз захворювання.
Методика проведення поєднаного променевого лікування включає дистанційну гамма-терапію з двох протилежних полів. При цьому передбачають одночасний променевий вплив на первинну пухлину і зону регіонарного метастазування. Сумарні поглинені дози у хворих на рак тіла матки 1-ої стадії складають 30-40 Гр, 3-ої стадії – до 45 Гр. Методика внутрішньопорожнинної променевої терапії раку ендометрію джерелами високої активності передбачає підведення сумарної дози 50 Гр 10 фракціями
зразовою осередковою дозою 5 Гр.
Гормонотерапія раку тіла матки
Більша частина ендометріальних карцином експресує естрогенні і прогестеронові рецептори, від їх рівня залежить модулюючий ефект прогестинів, антиестрогенів, інгібіторів ароматази.
Прогестерон-позитивні пухлини в 50–70% реагують на прогестинотерапію. На жаль, первинні пухлини ендометрію з високим ризиком рецидиву (низьке диференціювання, неендо-метріодні форми: серозно-папілярний або світлоклітинний рак та ін.) малочутливі до прогестеронотерапії, також як і рецидиви і метастази ендометріоїдного раку з початково високим і помірним ступенем диференціювання. Для подолання первинної гормонорезистентності і підвищення чутливості карциноми ендометрію до гестагенів використовують тамоксифен. Найчастіше
