11. Химия - Chemistry / Біонеорганічна, фізколоїдна і біоорганічні хімія. Вибрані лекції _Л.О. Гоцуляк, О.О. Мардашко та ін. - О_ ОДМУ, 1999. - 248 с
.pdf
Ефірний метод для розділення α-амінокислот був запропонований Е. Фішером (1901). Це відкрило шлях до аналізу білкових гідролізатів.
3. Утворення галогеноангідридів
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
|
R |
|
|
CH C + SOCl2 |
|
|
|
R |
|
|
CH |
C + SO2 + HCl |
|||
|
|
|
|
|
|
|||||||||||
CH3 |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
Cl |
|
C |
|
NH |
CH3 |
|
C |
|
NH |
||||||||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
||
Галогеноангідриди використовуються у синтезі пептидів для активації карбоксильної групи α-амінокислот. Аміногрупу попередньо «захищають» ацилюванням.
4. Декарбоксилювання У лабораторних умовах декарбоксилювання відбувається
при нагріванні α-амінокислот за наявності поглиначів СО2, наприклад, Ва(ОН)2.
В організмі ця реакція перебігає з участю ферментів декарбоксилаз із утворенням біогенних амінів:
N |
|
|
|
CH2 |
|
CH |
|
COOH |
|
|
|
N |
|
|
|
|
CH2 |
|
CH2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
NH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
N |
|
|
|
|
|
N |
2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
Гістидин |
|
|
|
|
|
|
|
Гістамін |
||||||||||
Реакції за аміногрупою
1. З мінеральними кислотами амінокислоти утворюють солі подібно до амінів
|
|
CH |
|
COOH + HCl |
|
|
|
|
|
CH |
|
|
|
|
|
||
R |
|
|
|
|
R |
|
|
COOH |
Cl |
||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
NH3 |
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||||
2. Утворення N-ацильних похідних
R |
|
CH |
|
COOH |
+ R |
|
C |
|
O |
|
R |
|
CH |
|
COOH |
|||
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
R |
|||
|
|
NH2 |
|
|
Cl |
|||||||||||||
|
|
|
|
|
|
|
NH |
|
C O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
229

Ця реакція широко застосовується для «захисту» аміногрупи в синтезі пептидів.
N-ацильні похідні легко гідролізуються зі звільненням вихідної α-амінокислоти.
3. Дезамінування Під дією азотистої кислоти поза організмом утворюються
гідрокислота, азот і вода.
R |
|
CH |
|
COOH + HO |
|
N |
|
O |
|
|
|
R |
|
CH |
|
COOH |
|
|
|
|
R |
|
|
CH |
|
COOH |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
H2O |
|
|
|
|
|
N2 |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
OH |
|
|
|
|
OH |
|
|
|||||||
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
α-Гідрокcикислота
В організмі дезамінування відбувається тільки фермента-
тивним шляхом з участю ферментів дезаміназ і коферменту НАД+.
4. Утворення основ Шіффа
|
|
CH |
|
COOH + R |
δ+ |
Oδ |
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
R |
|
|
|
C |
|
|
|
|
R |
|
|
|
|
COOH |
|
R |
|
|
COOH |
||||||||||||||
|
|
|
H |
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
R' |
|
|
|
|
|
|
CH |
|
R' |
|||||||
|
|
NH |
2 |
|
|
|
NH |
|
|
|
|
N |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
Заміщений амін |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
5. Залежно від положення NH2-групи відноcно СООН-групи амінокислоти поводять себе при нагріванні не однаково:
а) α-амінокислоти утворюють дикетопіперазини
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
||
R |
|
CH |
|
C |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
R |
|
CH |
C |
|||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||||
NH2 |
+ |
|
|
OH |
|
|
|
HN |
|
|
NH |
||||||
HO |
|
NH2 |
|
|
2H |
O |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
C HC |
|
R |
2 |
|
|
|
C |
|
HC |
|
R |
||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||||||
|
O |
|
|
|
|
|
|
|
|
O |
|
|
|
||||
б) β-амінокислоти відщеплюють аміак і утворюють ненасичену кислоту (можливе утворення її амонійної солі)
CH2 |
|
CH |
|
COOH |
|
|
|
CH2 |
|
CH |
|
COOH |
|
|
|
|
|
|
|
|
|||||||
NH2 |
|
|
|
|
|
|
NH3 |
||||||
H |
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||
230

в) γ і δ-амінокислоти утворюють внутрішні аміди — лакта-
ми
CH2 |
|
CH2 |
|
|
|
H2C |
|
CH2 |
||||
|
|
|
|
|||||||||
H2C |
|
C |
O |
|
H2O |
H2C |
|
C |
|
O |
||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||
N H HO |
|
|
|
N |
||||||||
H |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
H |
||||||
|
|
|
|
|
|
|
|
|
||||
Якісні реакції на виявлення α-амінокислот
1.Для ідентифікації α-амінокислот використовується нінгідринна реакція, в результаті якої утворюється продукт, забарвлений у синьо-фіолетовий колір.
2.Ксантопротеїнова реакція на виявлення α -амінокис- лот, що містять у радикалі бензольне ядро (фенілаланін, тирозин)
OH |
OH |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
HNO3 |
|
|
NO2 |
+ |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
NH |
Оранжеве |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
забарвлення |
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH2 |
|
|
|
CH |
|
COOH |
CH2 |
|
|
|
CH |
|
COOH |
|
|||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|||||||||||||||||||
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Жовте забарвлення |
|
||||||||
3. Проба на сірковмісні амінокислоти (сульфгідрильна проба)
а) |
CH |
|
|
CH |
|
COOH + 3NaOH |
t°° |
CH |
|
|
|
CH |
|
COONa + Na |
S + 2H |
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
SH |
2 |
|
|
|
|
Водневий |
|
|
2 |
|
|
|
|
|
2 |
|
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
NH2 |
|
OH |
|
|
|
NH2 |
|
|
|
|
|||||||||||
|
|
|
|
Цистеїн |
розчин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
б) |
Na |
|
S |
+ |
(CH COO) Pb |
|
|
|
PbS |
|
+ |
|
2CH COONa |
|
|
|
|||||||||
|
|
|
|
|
|||||||||||||||||||||
|
2 |
|
|
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|||
Чорний
осад
231
Білки
Голландському хіміку Герхарду Йогану Мульдеру (1883) приписують запровадження в наукову термінологію слова білок. Як у рослинах, так і тваринах, за думкою вченого, наявна речовина, яка виконує важливу функцію. Вона є одним із відомих компонентів живої матерії, і, мабуть, без неї життя було б не можливе. Цю речовину Мульдер назвав білком чи протеїном (від грец. proteus — перший).
Більше ніж двохсотлітня історія хімії білка сповнена безперестанним удосконаленням експериментальних засобів і багата на різні теоретичні концепції. Вагомий внесок у розвиток хімії білка зробили як вітчизняні вчені — О. Я. Данилевський, М. Д. Зелінський, B. C. Садиков та ін., так і зарубіжні дослідники: Е. Фішер, Т. Курціус, М. Бергман, Ф. Сенжер.
Хімія білка завжди поєднувала ідеї та методи біології, медицини, хімії, фізики. Білки становлять матеріальну основу хімічної діяльності клітини. Вони поділяються на прості (протеїни) і складні (протеїди). При гідролізі протеїнів як продукти розщеплення утворюються тільки α-амінокислоти. Протеїди при гідролізі розпадаються на білкову частину, що складається з α-амінокислот, і небілкову, тобто інші органічні та неорганічні сполуки. Небілкову частину називають простетичною групою.
Протеїди зазвичай класифікують за характером простетичних груп:
—глікопротеїди — містять вуглеводи як небілкову частину;
—ліпопротеїди — містять ліпіди;
—нуклеопротеїди — містять нуклеїнові кислоти;
—фосфопротеїди — містять залишок фосфорної кислоти;
—металопротеїди — містять залізопорфіринвмісні білки (міоглобін, гемоглобін), а також металоферменти.
Розглянемо особливості та властивості простих білків — протеїнів.
Пептиди і білки — група сполук, подібних за будовою, які
відрізняються тільки за розміром молекули. Вони є поліамідами, які утворені α-амінокислотами, що мають спільний фрагмент
O
C NH CH
232
Умовно вважають, що пептиди містять у молекулі близько 100 (молекулярна маса близько 1000), а білки — понад 100 амінокислотних залишків.
Розрізняють олігопептиди (низькомолекулярні), які містять у ланцюзі не більше 10 амінокислотних залишків, і поліпептиди, що містять від 10 до 100 амінокислотних залишків.
Білки є основною складовою частиною м’якої структурної тканини тварин і мають велике значення в біології.
Протягом останніх 100 років вчені доклали чимало зусиль, намагаючись визначити структури різноманітних білків, оскільки саме структура білка визначає його властивості.
Нові відомості про будову білкових молекул надають велику допомогу при розробленні засобів лікування хворих на сер- цево-судинні, спадкові захворювання, рак.
Вперше наявність пептидних груп у молекулі білка довів професор Харківського університету О. Я. Данилевський (1883). Він вивчав продукти гідролізу білка і виявив, що внаслідок неповного гідролізу білків утворюються амінокислоти та залишки білкової молекули, причому ці залишки дають біуретову реакцію: при взаємодії з лужним розчином сульфату міді утворюються сполуки, забарвлені в фіолетовий колір. При проведенні повного гідролізу така реакція не спостерігається. Тому О. Я. Данилевський припустив, що в основі будови білків полягає «біуретова структура», тобто зв’язок типу HN C
O
між залишками окремих α-амінокислот з утворенням поліпеп-
тидних ланцюгів.
Зв’язки між окремими амінокислотами є сильними. Їх на-
зивають поліпептидними, чи «біуретовими зв’язками» О. Я.
Данилевського. Поліпептидних зв’язків у макромолекулі багато. Порядок чергування амінокислотних залишків у поліпептидних фрагментах, що визначає біологічну функцію і спе-
цифічність білка, називають первинною структурою білкової молекули.
Наприклад, сироватковий альбумін утворює ланцюг, який складається з понад 500 амінокислотних залишків і виконує двояку функцію: підтримує осмотичний (онкотичний) тиск у крові і здійснює транспорт із кров’ю біологічно активних речовин, наприклад, ліків.
233
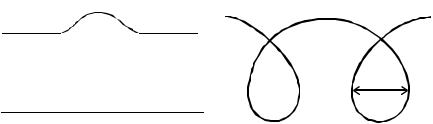
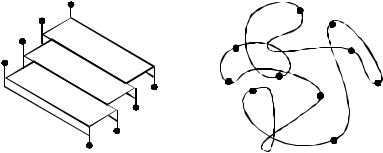
Фредерік Сенжер (1953) — автор стратегічного плану визначення амінокислотної послідовності в білках («блочний» метод) — вперше виявив послідовність амінокислотних залишків у найпростішому білку — інсуліні, за що був удостоєний Нобелівської премії 1958 р. У 1980 р. йому вдруге було присуджено Нобелівську премію за роботи, пов’язані з розшифруванням генетичного коду. Інсулін складається з двох пептидних ланцюгів А і В, ланцюг А містить 21, а ланцюг В — 30 амінокислотних залишків.
Виявилось, що в інсуліні пептидний зв’язок не є єдиним хімічним зв’язком у будові білка (рис. 6.3). Є ще три дисульфідних зв’язки, які спричиняють скривлення ланцюга А.
Дійсно, молекула білка не лежить у площині, тому знання первинної структури білка не достатнє для повного розуміння його будови.
Американські вчені Л. Полінг і Р. Корі довели, що в деяких білках (міозин і актоміозин) декілька поліпептидних ланцюгів скручені в спіраль і утворюють джгути. При цьому діаметр спіралі завжди дорівнює 0,54 нм, на окремому витку розміщується 3,6 амінокислотних залишків (рис. 6.4).
Це так звана α-структура. Окремі ланцюги в α-спіралі можуть бути сполучені хімічними (дисульфідними) і нехімічними зв’язками. Водневі зв’язки виникають між С=О і NH-групами поліпептидних зв’язків окремих ланцюгів. Звичайно дисульфідних зв’язків виникає мало, а водневих — багато.
Як правило, водневі зв’язки встановлюються між першим і п’ятим амінокислотними залишками всередині одного ланцюга, що приводить до скручування його в α-спіраль. Енергія водневого зв’язку Eзв = 5–20 кДж/моль, тобто такий зв’язок є слаб-
3,6,6амінокислотнихзалишку амі окисзалишківот
— S — S — ланцюг А |
|
|
|
S S
S |
S |
|
|
|
|
|
|
|
|||
0,54 нм |
|||||
|
ланцюг В |
||||
Рис. 6.3. Будова фрагменту лан- |
Рис. 6.4. α-Структура |
||||
цюга інсуліну
234
ким. Водневі зв’язки встановлюються і розриваються легко, без витрати значної кількості енергії, і виконують дві важливі біологічні функції:
—завдяки своїй численності забезпечують стійкість молеку-
ли;
—дозволяють утворювати комплекси двох молекул. Умовою комплексування є принцип структурної відповідності (комплементарність).
У деяких білках поліпептидні ланцюги розміщуються паралельно один до одного у вигляді стрічок, які можуть утворювати структуру зморщеної стрічки (рис. 6.5). Це відбувається внаслідок виникнення водневих зв’язків між пептидними група-
ми різних амінокислотних ланцюгів. Утворюється структура β-зморщеної стрічки (β-фіброїн).
За рахунок спіралізації, чи укладання в пучки, макромолекула набуває тримірності, утворюючи вторинну структуру білка.
Уформуванні третинної структури білка поряд із водневими беруть участь інші зв’язки — електростатичні (іонні), гідрофобні, дисульфідні.
Було доведено, що в цілому для сукупності всіх залишків амінокислот спостерігається закономірна локалізація гідрофобних груп (вуглеводневих радикалів) у внутрішній ділянці макромолекули. Гідрофільні (полярні) групи розміщуються на поверхні молекул (рис. 6.6).
Третинну структуру білка називають субодиницею. Декілька субодиниць утворюють четвертинну структуру білка.
УКембриджському університеті Д. Кендрю виявив третинну структуру білка міоглобіну кашалота, який забезпечує роботу м’язів за анаеробних умов і складається з 153 залишків амінокислот і одного залізовмісного гему (Мr = 17000), а М. Перутц встановив четвертинну структуру гемоглобіну. Цей білок містить по дві пари поліпептидних ланцюгів двох типів:
дві α-спіралі (α1 і α2) із 140 залишків і дві β-структури (β1 і β 2) з 146 залишків α -амінокислот у кожній. До кожного поліпептидного ланцюга прикріплений залізовмісний гем.
Четвертинна структура зумовлена комбінацією чотирьох субодиниць третинних структур, що утримуються одна біля одної слабкими зв’язками (здебільшого, силами Ван-дер-Вааль- са). Таким чином, особливостями будови біополімерів, що визначають їх властивості, є існування двох різних типів зв’язків
235